
科学实验探究(2) 考点测试 2021年中考化学专题复习试卷
展开《科学实验探究》专题2
班级 姓名 学号
一、知识梳理
1.科学探究的题型结构思维模式:
2.注意实验操作(加入某种试剂、对药品进行加热等)、实验现象(有无沉淀、气体、溶液颜色变化等)、实验结论(有无某种物质、猜想是否正确等)之间的对应关系:
二、考点透视
考点1 物质性质和变化条件的探究
例1 某兴趣小组在做完碳还原氧化铜实验后,进行了如图所示的探究。
【猜想】把氧化铜还原成铜的物质是:Ⅰ.石墨棒;Ⅱ.__________。
【实验】用天平称量1.5 g氧化铜粉末,直接用铝箔包裹。按上述操作步骤实验,黑色粉末____________,那么猜想Ⅱ不成立。
【结论】石墨棒能使氧化铜还原成铜,该反应的化学方程式为_________________________________。
【改进】把石墨棒换成铝粉,重复上述操作,又获成功。那么,称取等量的铝粉并进行同样的操作,其目的是________________。改进后的实验证明,金属铝与铜的活动性顺序是________________,该反应的化学方程式为__________________________________。
【拓展】如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好。联想在空气中灼热的铁丝不能燃烧,而铁粉能燃烧,其原因是____________________________________。
考点2 影响化学反应速率因素的探究
例2 某化学小组对金属与酸的反应进行探究,他们利用图1所示装置,取相同质量的镁和铁进行实验。
探究一:影响金属与盐酸反应速率的因素有哪些?
【作出猜想】猜想1:可能与金属的种类有关;猜想2:可能与金属的形状有关。
【设计并进行实验】室温下,小组同学分别取10%的盐酸20 mL,进行了以下4组实验:
实验编号 | 金属的种类(均取2 g) | 金属的形状 | 收集50 mL氢气所用的时间/s |
① | 镁 | 粉状 | 60 |
② | 铁 | 粉状 | 80 |
③ | 镁 | 片状 | 102 |
④ | 铁 | 片状 | 120 |
【实验结论与交流】(1)镁与盐酸反应的化学方程式为____________________________。
(2)进行实验③④前需要将铁片与镁片进行打磨,目的是__________________________。
(3)根据表中实验数据,能得出的结论是_________________________(写一条)。
探究二:小组同学反思,温度对金属与盐酸反应的速率是否有影响?
【设计并进行实验】小组同学分别取一定质量的铁粉与等质量的盐酸反应,相关数据如下:
实验编号 | 盐酸的浓度/% | 反应开始时盐酸的温度/℃ | 反应开始到2分钟产生的气体体积/mL | 反应结束时共产生的气体体积/mL |
⑤ | 10 | 20 | 19 | 118 |
⑥ | x | 35 | 75 | 118 |
(4)表中x的数值是__________。根据以上实验,你能得出的结论是___________________
_______________________________________________。
(5)实验⑥结束后,根据表中数据计算消耗铁粉的质量大于实际消耗铁粉的质量,你认为计算结果偏大的原因可能是____________________________________________________。
【实验反思】该实验是通过比较_______________________________来确定温度对该反应速率的影响。
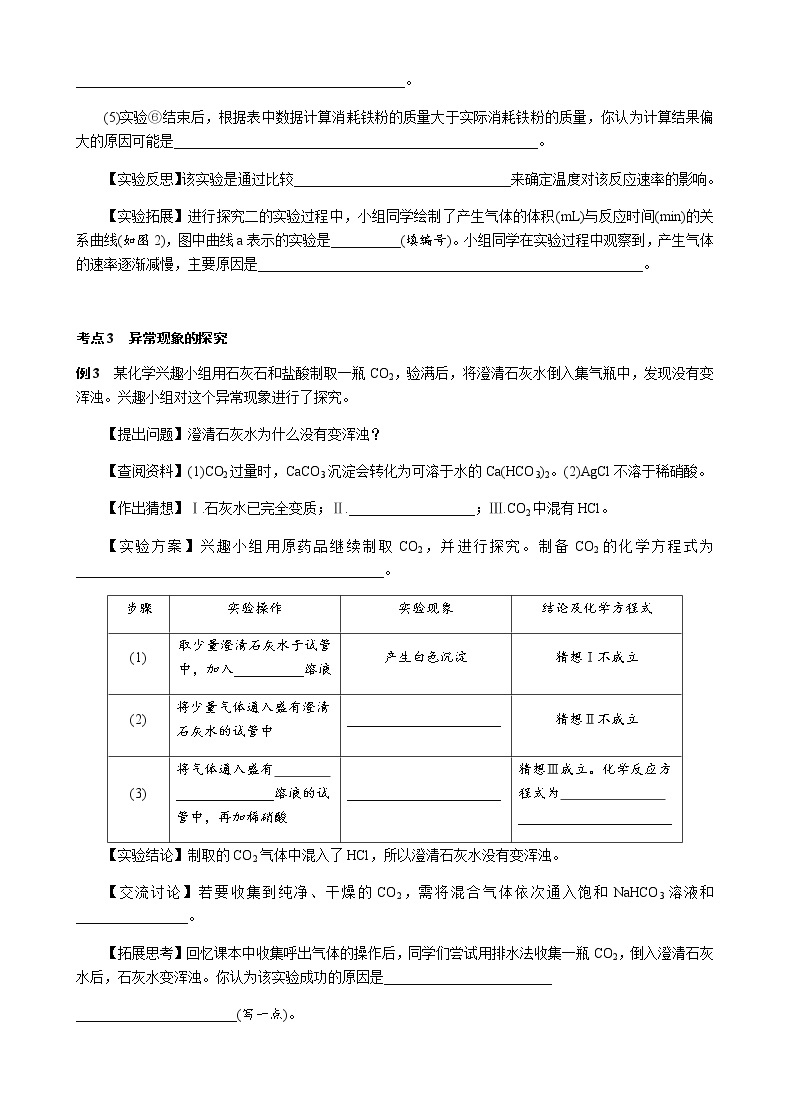
【实验拓展】进行探究二的实验过程中,小组同学绘制了产生气体的体积(mL)与反应时间(min)的关系曲线(如图2),图中曲线a表示的实验是__________(填编号)。小组同学在实验过程中观察到,产生气体的速率逐渐减慢,主要原因是_______________________________________________________。
考点3 异常现象的探究
例3 某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
【提出问题】澄清石灰水为什么没有变浑浊?
【查阅资料】(1)CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2。(2)AgCl不溶于稀硝酸。
【作出猜想】Ⅰ.石灰水已完全变质;Ⅱ.__________________;Ⅲ.CO2中混有HCl。
【实验方案】兴趣小组用原药品继续制取CO2,并进行探究。制备CO2的化学方程式为____________________________________________。
步骤 | 实验操作 | 实验现象 | 结论及化学方程式 |
(1) | 取少量澄清石灰水于试管中,加入__________溶液 | 产生白色沉淀 | 猜想Ⅰ不成立 |
(2) | 将少量气体通入盛有澄清石灰水的试管中 | ______________________ | 猜想Ⅱ不成立 |
(3) | 将气体通入盛有 ______________溶液的试管中,再加稀硝酸 | ______________________ | 猜想Ⅲ成立。化学反应方程式为 ______________________ |
【实验结论】制取的CO2气体中混入了HCl,所以澄清石灰水没有变浑浊。
【交流讨论】若要收集到纯净、干燥的CO2,需将混合气体依次通入饱和NaHCO3溶液和________________。
【拓展思考】回忆课本中收集呼出气体的操作后,同学们尝试用排水法收集一瓶CO2,倒入澄清石灰水后,石灰水变浑浊。你认为该实验成功的原因是________________________
_______________________(写一点)。
三、课堂训练
1.某化学小组初步探究氢氧化钠的性质、变化和获得方法。
【查阅资料】
Ⅰ.部分酸、碱和盐的溶解性如下表(室温)
阴离子 阳离子 | OH- | NO | Cl- | SO | CO |
H+ |
| 溶、挥 | 溶、挥 | 溶 | 溶、挥 |
K+ | ★溶 | 溶 | 溶 | 溶 | 溶 |
Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
Cu2+ | 不 | 溶 | 溶 | 溶 | — |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
Ⅱ.氢氧化钠的工业制法:电解氯化钠饱和溶液
2NaCl+2____________ 2NaOH+H2↑+Cl2↑
【性质与变化】
(1)上表★处“溶”对应的物质是____________。
(2)完成下列物质转化,各写出一个符合要求的化学方程式。
① :____________________________________________。
② :____________________________________________。
【实践与应用】工业上常用电解氯化钠饱和溶液的方法生产氢氧化钠。
(3)工业生产中可制得NaOH溶质质量分数约为45%的液碱产品,经进一步处理还可以制得固体氢氧化钠产品。请根据已有知识,简述“进一步处理”中使用的方法并说明理由:_________________________________________________________________。
(4)工业固体氢氧化钠质量指标如图所示,请对产品中的杂质来源作出合理分析。
碳酸钠:_____________________________________________________。
氯化钠:_____________________________________________________。
2.丙酸钙为白色固体,易溶于水,可作食品防霉剂,国家标准规定了其用于制作面食、糕点时每千克面粉中的最大使用量。小组同学实验探究其性质和防霉的效果。
Ⅰ.探究丙酸钙的性质
【进行实验】用如图装置(夹持仪器已略去)进行实验,记录如下:
序号 | ① | ② |
装置 | ||
现象 | 试管内壁有水雾 | 注入酸后,有气泡产生,石灰水变浑浊 |
【解释与结论】(1)实验②中现象说明有CO2产生。CO2与石灰水反应的化学方程式为________________________________________________________。
(2)查阅资料得知丙酸钙与盐酸反应无气体生成。由实验②可得出的结论是______________________。
Ⅱ.探究丙酸钙防霉的效果
【进行实验】分别按下列①~⑧的配方蒸制8个馒头,冷却后置于密封袋中,记录如下:
组别 | 第1组 | 第2组 | |||||||
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
配方 | 面粉/g | 50 | 50 | 50 | 50 | 50 | 50 | 50 | 50 |
酵母/g | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | 0.75 | |
蔗糖/g | 0 | 0 | 0 | 0 | 5 | 5 | x | 5 | |
丙酸钙/g | 0 | 0.06 | 0.10 | 0.15 | 0 | 0.06 | 0.10 | 0.15 | |
开始发霉时间 | 第3天 | 第4天 | 第5天 | 第6天 | 第3天 | 第4天 | 第5天 | 第6天 | |
【解释与结论】(3)设计第1组实验的目的是_____________________________________。
(4)第2组⑦中x的值为__________。
(5)对比第1组、第2组实验可得到的结论是____________________________________。
【反思与评价】(6)某同学认为“制作面食、糕点时,丙酸钙用量越大越好”,你是否同意此观点,并说明理由:_________________________________________________。
3.化学实验社团在老师的指导下开展了“模拟酸雨形成”的相关实验。
【联想与实验】模仿二氧化碳与水反应进行如图一所示实验:
【问题与猜想】亚硫酸不稳定,为什么红色液体微热后不变为紫色?其原因可能为:
猜想1.加热不够充分 猜想2.与空气中氮气有关 猜想3.与空气中氧气有关
【探究与验证】填写表格中的空格。
编号 | 操作 | 现象 | 结论 |
1 | 将图一中红色液体继续加热至沸腾 | 仍为红色 | 猜想1不成立 |
2 | 如图二所示,先通入适量SO2,然后用酒精灯微热 | 先变红后变紫 | 猜想2不成立 |
3 | 如图二所示,先通入适量SO2,再改通入氮气,最后用酒精灯微热 | ___________________ | |
4 | 如图二所示,先通入适量SO2,再改通入____________,最后用酒精灯微热 | ___________________ | 猜想3成立 |
【分析与结论】红色液体微热后不变为紫色的原因是:H2SO3在空气中会被氧化生成另一种酸,进一步实验证明是硫酸。
测定时间 | 5:05 | 5:15 | 5:25 | 5:35 | 5:45 |
pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
【应用与拓展】收集某硫酸厂(生产过程中产生SO2)附近刚降到地面的雨水水样,用pH计测得每隔十分钟数据如下表:
(1)分析表中数据,5:15至5:25时间段内水样中主要酸性溶质有__________________。
(2)实验社团提出一种处理废气的方案如图,利用CaCO3粉末、空气为原料在高温下吸收SO2,写出该反应的化学方程式:________________________________________________。
参考答案
二、考点透视
例1
【猜想】铝箔 【实验】不变红
【结论】2CuO+C 2Cu+CO2↑
【改进】对比实验(或控制变量法) Al>Cu(或铝>铜)
2Al+3CuO Al2O3+3Cu
【拓展】反应物间的接触面积(或物质形状)影响反应速率(或反应物间的接触面积大,反应速率大等)
例2
(1)Mg+2HCl=== MgCl2+H2↑
(2)除去金属表面的氧化物和污物
(3)其他条件相同时,镁与盐酸反应的速率比铁快(或其他条件相同时,粉状金属与盐酸反应的速率比片状快)
(4)10 其他条件相同时,反应开始时盐酸的温度越高,反应速率越快
(5)盐酸挥发出的HCl气体和反应放热产生的水蒸气混入了产生的气体中,使体积偏大
【实验反思】相同时间内产生气体的体积
【实验拓展】⑥ 随着反应的进行,盐酸浓度降低,反应速率减慢
例3
【作出猜想】CO2过量(或石灰水不足)
【实验方案】CaCO3+2HCl=== CaCl2+H2O+CO2↑
(1)Na2CO3(或可溶性碳酸盐)
(2)澄清石灰水不变浑浊
(3)AgNO3(或硝酸银) 产生白色沉淀 HCl+AgNO3=== AgCl↓+HNO3
【交流讨论】浓硫酸(或浓H2SO4)
【拓展思考】排水过程中除掉了HCl(或排水法能收集到CO2等)
三、课堂训练
1.
H2O
(1)KOH
(2)①2NaOH+Cu(NO3)2=== Cu(OH)2↓+2NaNO3(合理即可) ②Na2CO3+Ca(OH)2=== CaCO3↓+2NaOH
(3)降温结晶。氢氧化钠的溶解度受温度影响较大
(4)氢氧化钠吸收空气中的二氧化碳生成碳酸钠 氯化钠饱和溶液电解不充分,有少量残留的氯化钠混入
2.
(1)CO2+Ca(OH)2=== CaCO3↓+H2O
(2)丙酸钙受热后生成的物质能与稀盐酸反应且生成二氧化碳
(3)探究丙酸钙的质量大小是否对丙酸钙防霉的效果有影响
(4)5
(5)其他条件相同时,有无蔗糖对丙酸钙防霉的效果无影响
(6)不同意。国家标准规定了丙酸钙用于制作面食、糕点时每千克面粉中的最大使用量,说明过量使用可能有害,故不是越多越好
3.
【探究与验证】先变红后变紫 氧气(或O2) 先变红,微热后仍为红色
【应用与拓展】(1)H2SO3和H2SO4
(2)2SO2+2CaCO3+O22CaSO4+2CO2
中考化学二轮复习 重难点考点10—实验探究题专题突破(二)(含解析): 这是一份中考化学二轮复习 重难点考点10—实验探究题专题突破(二)(含解析),共50页。
中考化学二轮复习 重难点考点09—实验探究题专题突破(一)(含解析): 这是一份中考化学二轮复习 重难点考点09—实验探究题专题突破(一)(含解析),共40页。
中考化学二轮复习重难点考点10—实验探究题专题突破(二)(含解析): 这是一份中考化学二轮复习重难点考点10—实验探究题专题突破(二)(含解析),共50页。












