

2.化学反应的计算_2021年浙教版科学准九年级上学期暑假讲义(word,无答案)
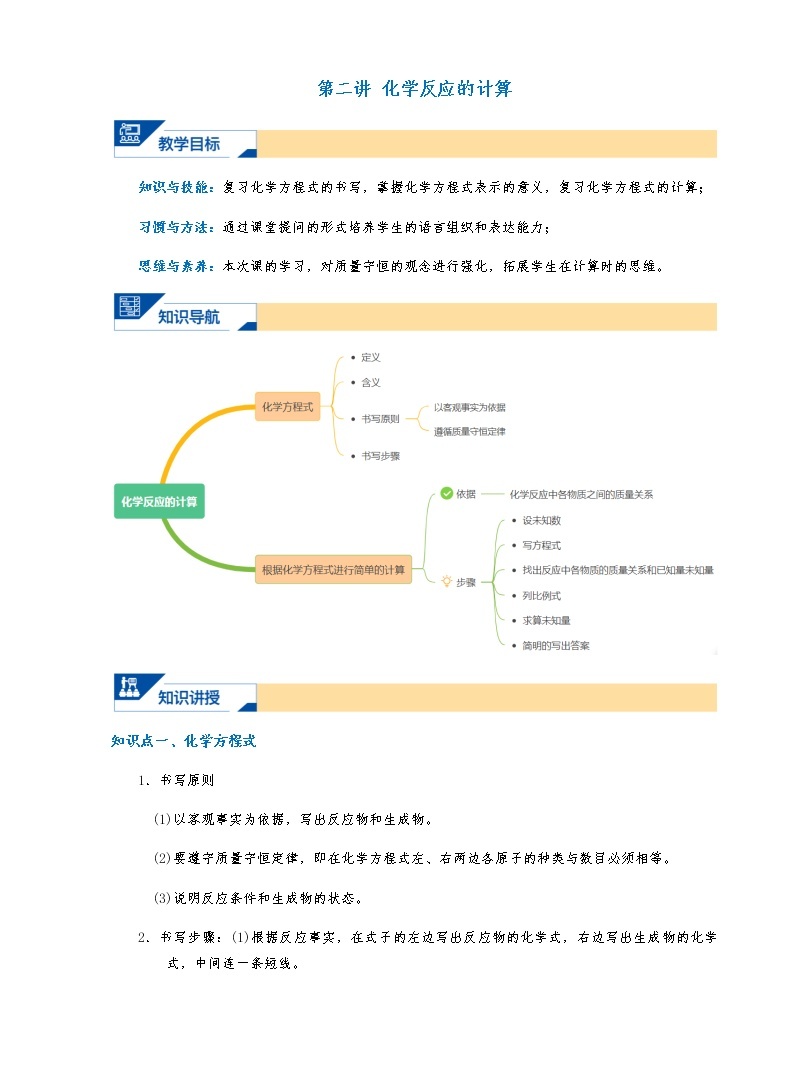
展开第二讲 化学反应的计算
知识与技能:复习化学方程式的书写,掌握化学方程式表示的意义,复习化学方程式的计算;
习惯与方法:通过课堂提问的形式培养学生的语言组织和表达能力;
思维与素养:本次课的学习,对质量守恒的观念进行强化,拓展学生在计算时的思维。
知识点一、化学方程式
1.书写原则
(1)以客观事实为依据,写出反应物和生成物。
(2)要遵守质量守恒定律,即在化学方程式左、右两边各原子的种类与数目必须相等。
(3)说明反应条件和生成物的状态。
2.书写步骤:(1)根据反应事实,在式子的左边写出反应物的化学式,右边写出生成物的化学式,中间连一条短线。
(2)配平化学方程式。在式子左、右两边的化学式前面,要配上适当的化学计量数,使式子两边每一种元素的原子总数相等。式子两边各元素的原子数配平后,把短线改成等号。
(3)说明反应条件和生成物的状态。
3.意义
如反应2H2O22H2O+O2↑表示的意义为:
(1)宏观:
①质的方面:过氧化氢在MnO2催化作用下反应生成水和氧气。
②量的方面:每68份质量的过氧化氢在催化剂作用下反应生成36份质量的水和32份质量的 氧气。
(2)微观:
2个过氧化氢分子在催化剂作用下反应生成2个水分子和1个氧气分子。
知识点二、根据化学方程式进行简单的计算
1.化学方程式的应用——根据化学方程式行有关计算根据化学方程式计算的一般解题步骤 是:
注意:①解题的关键在于正确地书写化学方程式,列出比例式。
②根据化学方程式的计算若反应物或生成物的量是气体的体积时,应先将其换算成质量。
③代入化学方程式的量,必须是纯净物的质量。
若是气体体积需换算成质量;
若为不纯物质或者溶液,应先换算成纯物质的质量或溶液中溶质的质量。
涉及的公式有:纯净物的质量=不纯物的总质量×纯度(或1-杂质的质量分数)
精熟讲授① 下列化学方程式书写正确的是( )
A.生石灰遇水放热 CaO+H2O=Ca(OH)2
B.加热分解氧化汞2HgO2Hg+O2
C.硫在氧气中燃烧 S+O2=SO2
D.白磷自燃P+O2=P2O5
高效演练1-1 下列方程式正确的是( )
A. B.
C. D.
精熟讲授② “气体烙铁”是一种以气体X为燃料的加热仪器,加热温度可达1300℃,反应的化学方程式为。燃料X的化学式为( )
A.C3H10 B.C4H10 C.C8H20 D.C4H10O
高效演练2-1 英国化学家戴维将光气与氨作用合成尿素,该反应的化学方程式为:COCl2 + 4NH3 =2X + CO(NH2)2,其中X的化学式为( )
A.H2 B.HCl C.NH4Cl D.Cl 2
高效演练2-2 石灰氮(化学式为CaCN2)是一种固态肥料,遇水发生反应的化学方程式为CaCN2+3H2O=CaCO3+2X,则x化学式为( )
A.NO B.N2 C.CO2 D.NH3
精熟讲授①如图是某反应的微观示意图,下列说法正确的是( )
A.催化剂能使生成的丙和丁更多 B.该反应不属于氧化反应
C.反应前后元素的化合价不变 D.甲中碳氧元素的质量比是3:4
高效演练1-1 中国科学院科研团队研究成果表明,在常温、常压和可见光条件下,基于LDH(一种固体催化剂),用氮气和水合成氨气(NH3)的原理如图所示。下列说法不正确的是( )
A.四种物质中有一种属于氧化物 B.原料气N2可通过分离液态空气获得
C.LDH在反应前后的质量和性质不改变 D.参加反应的N2与H2O的分子个数比为1∶3
精熟讲授②同学们从山上采集到一种石灰石,他们取40克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
反应时间t/s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m/g | 40 | 37.5 | 35 | 33 | 31 | 29 | 29 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为______g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
高效演练2-2 在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的t1和t2两个时刻各物质的质量如下表所示,其中 a、b、c、d 分别表示相应物质的质量。下列数据不正确的是( )
时间 | 甲 | 乙 | 丙 | 丁 |
反应前 | 70g | 14g | 6g | 10g |
t1 时刻 | a | 11g | c | d |
t2时刻 | 42g | b | 40g | 10g |
A.a=56g B.b=8g
C.c=17g D.d=10g
精熟讲授③ 在实验室中可选择下图装置制取气体。
(1)用过氧化氢制取O2的化学方程式为___________;其发生装置可选择B或C,与B相比较,C 的主要优点是___________。
(2)实验室用加热氯酸钾和二氧化锰的混合物制取氧气,反应的化学方程式为___________。其 基本反应类型是:________,能用装置D收集氧气,检验氧气是否收满的方法是___________。
(3)欲使用装置G进行排水法收集氧气,其操作步骤是:________。
(4)某小组利用高锰酸钾160g制取氧气,一段时间后发现试管中剩余固体共150.4g,问生成氧 气质量是多少?参加反应的高锰酸钾质量是多少?
高效演练3-1 以下是在实验室里制取气体时常用的仪器,回答下列问题。
(1)仪器E的名称为_________。
(2)在实验室里,用5%的过氧化氢溶液和二氧化锰混合制O2,并用排水法进行收集。
①应选用图中A、G、H、L、M、N、O和_______来组装装置。
②当观察到导管_______气泡出现时,开始收集氧气。
(3)若用加热高锰酸钾的方法制取氧气,除图中所示仪器外,还需补充_______________。
(4)小明同学用50g含碳酸钙80%的石灰石与足量稀盐酸反应(杂质不与酸反应),产生CO2 的质量为___________g。
精熟讲授① 有化学反应3A+B+2C=D,将 A、B、C各15g混合均匀后加热,生成了30gD。向残留物中加入10g A后,反应又继续开始,待反应再次停止后反应物中只剩余C。以下说法中正确的是( )
A.第一次反应停止时B剩余了9g B.第一次反应停止时C剩余了6g
C.反应中A和C的质量比为5:3 D.第二次反应后C剩余了5g
高效演练1-1 3g碳放在盛有6g氧气的密闭容器中燃烧,反应结束后容器中气体是( )
A.CO B.CO2 C.CO和CO2 D.CO2和O2
高效演练1-2下图是以空气和其他原料合成NH4NO3的工业流程。下列说法错误的是( )
A.①中发生的是物理变化
B.上述流程中涉及的化合反应有2个
C.③中参加反应的NH3和O2质量比为17:40
D.理论上,若③和⑤中NH3的量相同,则合成NH4NO3时氨气的利用率最高
高效演练1-3在3A+B=3C+4D反应中,已知84gA与160gB恰好完全反应,生成132gC,A的化学式量为28,则D的化学式式量为( )
A.28 B.144 C.112 D.56
精熟讲授② 某碳酸钙样品中含有不和盐酸反应的杂质。某同学取12g该样品于烧杯中,再向烧杯中将100g稀盐酸分五次加入样品中,充分反应使气体全部逸出后,称得烧杯中所盛物质的总质量(不包含烧杯自身质量)如下表所示:
实验序号 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
烧杯中所盛物质的总质量/g | 30.90 | 49.80 | m | 87.60 | 107.05 |
请填空:
(1)碳酸钙和盐酸反应的化学方程式为________________________________________;
(2)m的值为_____g。
(3)12g石灰石样品中碳酸钙的质量分数等于__________;
(4)求反应完全后,溶液中氯化钙的质量(写计算过程,保留两位小数)。
高效演练2-1 小洋同学为测定某石灰石样品中碳酸钙的质量分数(杂质不与酸反应,也不溶于酸和水),向12.0g石灰石样品中逐滴加入稀盐酸至恰好不再产生气泡为止,共滴加了40.0g稀盐酸,反应后测得剩余物质总质量为47.6g,试计算:
(1)该反应生成二氧化碳的质量为 g。
(2)求该石灰石样品中碳酸钙的质量分数。(写出计算过程,结果精确至0.1%)
精熟讲授③ 在学生完成“实验活动1氧气的实验室制取与性质”后,吴老师发现部分小组制取氧气后的试管内还有暗紫色固体。吴老师称得某实验小组剩余固体的质量为9.36g,经溶解过滤、洗涤、烘干后所得黑色固体的质量为1.74g。请计算:
(1)高锰酸钾中锰元素和氧元素的质量比是_________。
(2)生成氧气的质量_______________。
(3)该实验小组高锰酸钾的分解率。
(查阅资料)
①含钾元素的化合物都能溶于水
②分解率=×100%
高效演练3-1 某实验室需用氧气做实验。现将29.4g氯酸钾与5.6g二氧化锰的混合物加热一定时间后,冷却称量剩余固体为25.4g,请回答:
(1)制得氧气的质量为_____。
(2)剩余固体中存在哪些物质?分别是多少?
中老年人缺钙会患骨质疏松症。某补钙品(有效成分为碳酸钙,其他成分不含钙元素),其说明书中标明含钙量为30%。小斌同学为了检验该产品是否属实,于是取了5克补钙产品放入盛有50克稀盐酸的烧杯中,其中的碳酸钙跟稀盐酸恰好完全反应(其他成分与稀盐酸不反应),反应后剩余固体和液体的总质量为54.56克。请你计算∶(所有计算结果保留两位小数)
(1)碳酸钙中钙元素的质量分数?
(2)反应生成的二氧化碳质量?
(3)碳酸钙在补钙品中的质量分数,补钙品中的实际含钙量是否属实?
(4)所用盐酸中的溶质质量分数?
14.表格型化学计算_2021年浙教版科学准九年级上学期暑假讲义(word,无答案): 这是一份14.表格型化学计算_2021年浙教版科学准九年级上学期暑假讲义(word,无答案),共10页。学案主要包含了有关化学方程式计算的要点归纳,表格型化学计算等内容,欢迎下载使用。
12.物质的鉴别、除杂_2021年浙教版科学准九年级上学期暑假讲义(word,无答案): 这是一份12.物质的鉴别、除杂_2021年浙教版科学准九年级上学期暑假讲义(word,无答案),共13页。学案主要包含了物质的鉴别,方法,常见物质的检验与鉴别等内容,欢迎下载使用。
13.图像型化学计算_2021年浙教版科学准九年级上学期暑假讲义(word,无答案): 这是一份13.图像型化学计算_2021年浙教版科学准九年级上学期暑假讲义(word,无答案),共10页。学案主要包含了有关化学方程式计算的要点归纳等内容,欢迎下载使用。