

高考化学(2011~2020)真题专项练习 专题36 水的电离与溶液的pH(教师版)
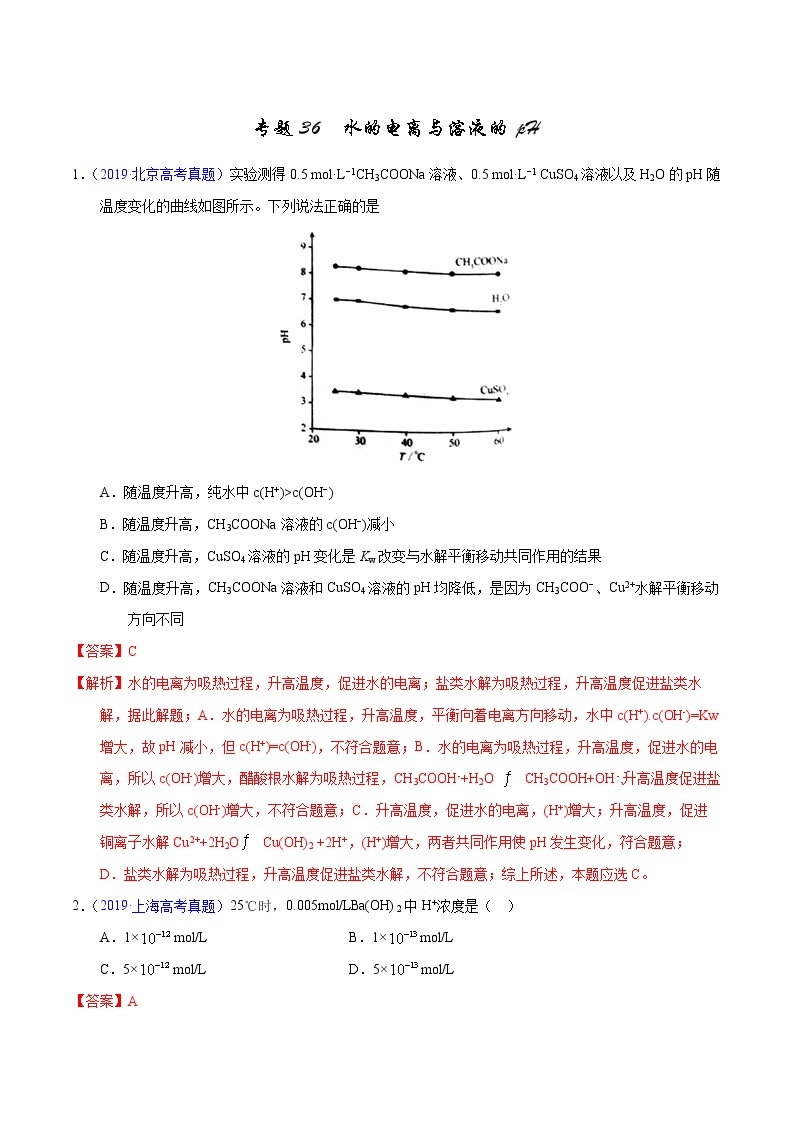
展开A.随温度升高,纯水中c(H+)>c(OH−)
B.随温度升高,CH3COONa溶液的c(OH−)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO−、Cu2+水解平衡移动方向不同
【答案】C
【解析】水的电离为吸热过程,升高温度,促进水的电离;盐类水解为吸热过程,升高温度促进盐类水解,据此解题;A.水的电离为吸热过程,升高温度,平衡向着电离方向移动,水中c(H+).c(OH-)=Kw增大,故pH减小,但c(H+)=c(OH-),不符合题意;B.水的电离为吸热过程,升高温度,促进水的电离,所以c(OH-)增大,醋酸根水解为吸热过程,CH3COOH-+H2O CH3COOH+OH-,升高温度促进盐类水解,所以c(OH-)增大,不符合题意;C.升高温度,促进水的电离,(H+)增大;升高温度,促进铜离子水解Cu2++2H2OCu(OH)2 +2H+,(H+)增大,两者共同作用使pH发生变化,符合题意;D.盐类水解为吸热过程,升高温度促进盐类水解,不符合题意;综上所述,本题应选C。
2.(2019·上海高考真题)25℃时,0.005ml/LBa(OH)2中H+浓度是( )
A.1×ml/LB.1×ml/L
C.5×ml/LD.5×ml/L
【答案】A
【解析】溶液中的氢氧根离子浓度为0.01ml/L,根据水的离子积常数计算,氢离子浓度为 ml/L。故选A 。
3.(2017·上海高考真题)下列物质的水溶液呈酸性,并且使水的电离平衡向正方向移动的是:
A.Na2CO3 B.NH4Cl C.H2SO4 D.NaHCO3
【答案】B
【解析】A.Na2CO3是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,促进水电离,错误;B.氯化铵是强酸弱碱盐,铵根离子水解,溶液显酸性,促进水的电离,正确;C.硫酸完全电离生成氢离子而导致溶液中c(H+)增大,溶液显酸性,抑制水的电离,错误;D.碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,溶液显碱性,促进水的电离,错误;故选B。
4.(2017·浙江高考真题)下列说法不正确的是
A.pH<7的溶液不一定呈酸性
B.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)相等
C.在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-)
D.氨水和盐酸反应后的溶液,若c(Cl―)=c(NH4+),则溶液呈中性
【答案】B
【解析】A.pH<7的溶液不一定呈酸性,只有当溶液中c(OH-)<c(H+)时溶液显酸性,A正确;B.氢氧化钠是强碱,完全电离,一水合氨是弱碱,部分电离,在相同温度下,物质的量浓度相等的氨水、NaOH溶液,c(OH-)不相等,前者小于后者,B错误;C.盐酸、CH3COOH溶液中存在电荷守恒:c(H+)=c(OH-)+c(Cl-)、c(H+)=c(OH-)+c(CH3COO-),因此在相同温度下,pH相等的盐酸、CH3COOH溶液,c(Cl-)=c(CH3COO-),C正确;D.氨水和盐酸反应后的溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH-)+c(Cl-),若c(Cl―)=c(NH4+),则c(H+)=c(OH-),溶液呈中性,D正确。答案选B。
5.(2017·浙江高考真题)下列物质的水溶液不能使酚酞变红的是
A.NaOHB.Na2CO3C.NaClD.NH3
【答案】C
【解析】A.NaOH是强碱,溶液显碱性,能使酚酞变红,不选;B.Na2CO3属于强碱弱酸盐,水解后溶液显碱性,能使酚酞变红,不选;C.NaCl是强酸强碱盐,溶液显中性,不能使酚酞变红,选;D.NH3的水溶液显碱性,能使酚酞变红,不选;故选C。
6.(2012·全国高考真题)已知温度T时水的离子积常数为KW,该温度下,将浓度为a ml·L-1的一元酸HA与b ml·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)= ml.L-1
D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
【答案】C
【解析】A.没有给具体的温度和酸、碱的强弱,A错误;B.由于没有给具体的温度,pH=7,不一定是中性,B错误;C.判断溶液呈中性的依据只能是c(H+)=c(OH-),此时c(H+)=ml·L-1,C正确; D.根据电荷守恒,不论溶液是酸性、中性、还是碱性,都成立,D错误;故合理选项为C。
7.(2013·全国高考真题)下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
【答案】D
【解析】A、由图像知,两曲线上的任意点均是平衡点,且温度一定,所以其水的离子积是一个常数,A正确;B、XZ连线的斜率是1,存在c(H+)=c(OH-),在X、Z连线的上方,c(H+)<c(OH-),在X、Z连线的下方,c(H+)>c(OH-),B正确;C、水的电离是吸热反应,升温促进水电离,c(H+)、c(OH-)及Kw都增大,所以T1<T2,C正确;D、X曲线在25℃时c(H+)=10-7ml/L,pH=7,而Z曲线温度高于25℃,其pH<7,D错误。答案选D。
8.(2010·海南高考真题)常温下,将0.1 ml·L-1氢氧化钠溶液与0.06 ml·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
【答案】B
【解析】
设溶液的体积都是1L,则氢氧化钠的物质的量为1L×0.1ml•L-1=0.1ml,
硫酸的物质的量为1L×0.06ml•L-1=0.06ml,H+的物质的量为0.06ml×2=0.12ml,
则当酸碱发生中和时H+和OH-的物质的量分别为0.12ml和0.1ml,
则硫酸过量,过量的H+的物质的量为0.12ml-0.1ml=0.02ml,
则反应后溶液中H+的物质的量浓度为c(H+)==0.01ml•L-1,
pH=-lg10-2=2.0,故选B.
9.(2008·全国高考真题)实验室现有3种酸碱指示剂,其pH的变色范围如下:甲基橙:3.1~4.4,石蕊:50~8.0,酚酞:8.2~10.0,用0.1000ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
【答案】D
【解析】NaOH与CH3COOH恰好完全反应生成CH3COONa,CH3COONa为强碱弱酸盐,水解后溶液呈碱性,为了减少滴定误差,应选择指示剂的pH范围与CH3COONa溶液的pH接近,所以指示剂选择酚酞,故答案为D。
ml/L=7.6×10-12ml/L,所以该点溶液pH<12,正确;故选D。
10.(2007·天津高考真题)25℃时,水的电离达到平衡:H2OH++ OH-;ΔH > 0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
【答案】B
【解析】A.氨水能抑制水的电离,但碱性是增强的,A不正确;B.硫酸氢钠是强酸的酸式盐,溶于水显酸性,水的离子积常数只和温度有关,所以B是正确的;C.醋酸钠是强碱弱酸盐,水解显碱性。水解是促进水的电离的,所以C不正确;D.电离是吸热的,因此加热促进水的电离,水的离子积常数增大,pH降低,D不正确。答案选B。
11.(2014·广东高考真题)常温下,0.2ml/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
【答案】D
【解析】A、0.2ml/L一元酸HA与等浓度的NaOH溶液等体积混合后,得到的溶液为0.1ml/L的NaA溶液,若HA为强酸,则溶液为中性,且c(A-)=0.1ml/L,与图不符,所以HA为弱酸,A错误;B、根据A的分析,可知该溶液的pH>7,B错误;C、A-水解使溶液显碱性,所以溶液中的粒子浓度的大小关系是c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),所以X是OH-,Y是HA,Z表示H+,C错误;D、根据元素守恒,有c(A-)+c(HA)=c(Na+),D正确;答案选D。
12.(2014·海南高考真题)NaOH溶液滴定盐酸实验中,不必用到的是
A.酚酞B.圆底烧瓶C.锥形瓶D.碱式滴定管
【答案】B
【解析】在酸碱中和滴定中要用滴定管滴加试剂,待测溶液盛装在锥形瓶中,用指示剂酚酞来判断滴定终点。因此不使用的仪器是圆底烧瓶。答案选B。
13.(2008·上海高考真题)常温下,某溶液中由水电离出来的c(H+)=1.0×10-13ml·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④B.①②C.②③D.③④
【答案】A
【解析】依据常温下溶液中由水电离出来的c(H+)=1.0×10-13ml·L-1,说明水的电离受到抑制,溶液为强酸或强碱溶液。①二氧化硫溶于水生成了亚硫酸,亚硫酸电离出氢离子,会抑制水的电离,故①正确;②氯化铵是强酸弱碱盐,铵根离子会发生水解,水解的本质是促进水的电离,故②错误;③硝酸钠是强酸强碱盐,溶液为中性,水的电离程度不会减小,故③错误;④氢氧化钠为强碱,会抑制水的电离,故④正确。综上所述,本题正确答案为A。
14.(2012·上海高考真题)常温下a ml/L CH3COOH稀溶液和b ml/L KOH稀溶液等体积混合,下列判断一定错误的是
A.若c(OH-)>c(H+),a=bB.若c(K+)>c(CH3COO-),a>b
C.若c(OH-)=c(H+),a>bD.若c(K+)<c(CH3COO-),a<b
【答案】D
【解析】A.若c(OH−)>c(H+),溶液为醋酸钾溶液或醋酸钾和KOH的混合液,则a⩽b,不符合题意;B.若c(K+)>c(CH3COO−),由电荷守恒c(CH3COO−)+ c(OH−)= c(H+)+ c(K+)可知,c(OH−)>c(H+),则a⩽b,若当a>b,也就是弱酸强碱中和时,弱酸过量,溶液可能呈酸性、中性或碱性,醋酸过量的极少,所以过量的醋酸电离出的H+小于醋酸根水解产生的OH−,有可能成立,不符合题意;C.若c(OH−)=c(H+),溶液显中性,一定为醋酸和醋酸钾的混合液,则a>b,不符合题意;D.若c(K+)<c(CH3COO−),由电荷守恒可知c(CH3COO−)+ c(OH−)= c(H+)+ c(K+),c(OH−)<c(H+),则a>b,符合题意;答案选D。
15.(2015·广东高考真题)一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
【答案】C
【解析】A.温度升高,水的离子积常数增大,水溶液中,氢离子和氢氧根离子浓度都增大,将不在曲线上,A错误;B.b点c(H+)=c(OH-)=1.0×10-7,故Kw=1.0×10-7×1.0×10-7=1.0×10-14,B错误;C.加入FeCl3,由于氯化铁为强酸弱碱盐,在溶液中Fe3+水解结合水电离出的OH-,促进水的电离平衡右移,最终使溶液中氢离子浓度增大,氢氧根离子浓度减小,可以由b到a点,符合图象变化趋势,C正确;D.由c点到d点,水的离子积常数减小,温度不变,Kw不变,故不能利用稀释使其形成此变化,D错误;故合理选项是C。
16.(2008·全国高考真题)常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01ml·L-1B.0.017ml·L-1
C.0.05ml·L-1D.0.50ml·L-1
【答案】C
【解析】设NaOH和HCl的物质的量浓度均为c,NaOH和HCl溶液以3:2体积比相混合,体积分别为3V、2V,酸碱混合后pH=12,则碱过量,剩余的氢氧根离子浓度为:c(OH−)=0.01 ml·L-1,则:c(OH−)==0.01 ml·L-1,解得:c=0.05ml·L-1,正确,答案选C。
17.(2010·天津高考真题)下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐
B.pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-)
【答案】B
【解析】A、某物质的溶液pH<7,则该物质可能是酸或强酸弱碱盐或弱酸弱碱盐或NaHSO4等,弱酸弱碱盐的水溶液有可能也显酸性,A错误;B、pH=4.5的番茄汁中c(H+)=1.0×10-4.5ml/L,pH=6.5的牛奶中c(H+)=1.0×10-6.5ml/L,前者c(H+)是后者的100倍,B正确;C、浓度相同的CaCl2和NaCI溶液中的Cl-浓度不同,前者c(Cl-)是后者的2倍,根据氯化银的溶解平衡判断,氯离子浓度增大,平衡左移,氯化银的溶解度减小,所以AgCl在同浓度的CaCl2和NaCI溶液中的溶解度不同,前者较小,C错误;D、pH=5.6的CH3COOH与CH3COONa混合溶液显酸性,说明醋酸的电离大于醋酸根离子的水解程度,所以c(Na+)<c(CH3COO-),D错误;答案选B。
18.(2009·四川高考真题)关于浓度均为0.1 ml/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A.c(NH+4):③>①
B.水电离出的c(H+):②>①
C.①和②等体积混合后的溶液:c(H+)=c(OH)+c(NH3·H2O)
D.①和③等体积混合后的溶液:c(NH+4)>c(Cl)>c(OH)>c(H+)
【答案】B
【解析】A.氯化铵为强电解质完全电离后产生大量的NH4+,氨水为弱电解质只有少量的NH4+产生,A正确;B.在水中加入酸和碱都抑制水的电离,但是盐类水解促进水的电离,不正确。C.盐酸和氨水混合后恰好完全反应,但因生成的盐为强酸弱碱盐,溶液显酸性,而多余的H+为水解产生,此等式可表示溶液中的质子守恒,正确。D.①和③等体积混合后的溶液显碱性,氯化铵是强电解质,而一水合氨是弱电解质,故离子浓度的大小顺序为c(NH+4)>c(Cl−)>c(OH−)>c(H+),D正确。故选B。
19.(2007·全国高考真题)室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
【答案】C
【解析】A.一水合氨为弱电解质,溶液中只能部分电离出氢氧根离子,pH=3的盐酸中氯化氢浓度为0.001ml/L,而pH=11的氨水中一水合氨浓度远远大于0.01ml/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH一定大于7,错误;B.盐酸是强酸,氢氧化钡是强碱,完全电离,所以pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合,二者恰好完全反应产生水,所以溶液的pH=7,错误;C.pH=3的醋酸中,醋酸为弱电解质,醋酸的物质的量浓度大于0.001ml/L,pH=11的氢氧化钠溶液中氢氧化钠的浓度为0.001ml/L,两溶液等体积混合后醋酸过量,溶液显示酸性,溶液的pH一定小于7,正确;D.一水合氨为弱电解质,溶液中只能部分电离出氢氧根离子,pH=3的硫酸中硫酸浓度为0.001ml/L,而pH=11的氨水中一水合氨浓度远远大于0.01ml/L,两溶液等体积混合后氨水过量,溶液显示碱性,溶液的pH一定大于7,错误;综上所述,答案为C。
20.(2012·上海高考真题)水中加入下列溶液对水的电离平衡不产生影响的是( )
A.NaHSO4溶液B.KF溶液C.KAl(SO4)2溶液D.NaI溶液
【答案】D
【解析】水的电离H2O⇌H++OH-,加入酸或碱抑制水的电离,加入能水解的盐促进水的电离。A.硫酸氢钠在水溶液中完全电离,电离出氢离子和硫酸根离子和钠离子,溶液呈酸性,水的电离H2O⇌H++OH-,抑制了水的电离,水的电离向逆反应方向移动,错误;B.KF为强电解质,电离出钾离子和氟离子,钾不水解,氟离子水解生成氢氟酸,促进水的电离,错误;C.KAl(SO4)2为强电解质,电离出钾离子和铝离子和硫酸根离子,钾离子、硫酸根离子不水解,铝离子水解生成氢氧化铝,促进水的电离,错误;D.NaI为强电解质,在溶液中电离出钠离子和碘离子,这两种离子都不水解,对水的电离平衡无影响,正确;答案选D
21.(2007·广东高考真题)下列可用于测定溶液pH且精确度最高的是( )
A.酸碱指示剂B.pH计C.精密pH试纸D.广泛pH试纸
【答案】B
【解析】A.酸碱指示剂只能大概知道溶液的酸碱性,不能定量,错误;B.pH计能读到小数点后面两位小数,正确;C.精密pH试纸能测到0.2数量级,错误;D.广泛pH试纸仅能读出整数,错误;答案选B。
22.(2008·海南高考真题)用pH试纸测定溶液pH的正确操作是( )
A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
【答案】A
【解析】A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照,A正确;B.用pH试纸测定溶液pH值时,若用蒸馏水润湿试纸,相当于把待测液加水稀释,导致所测的pH值可能不准,故试纸是不能事先润湿的,B不正确;C.不能将试纸在待测液中蘸一下,这样会污染试剂,C不正确;D.不能将试纸用蒸馏水润湿,D不正确。本题选A。
23.(2014·山东高考真题)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1ml·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
【答案】D
【解析】A.酸溶液、碱溶液抑制了水的电离,溶液显示中性前,随着氨水的加入,溶液中氢离子浓度逐渐减小,水的电离程度逐渐增大;当氨水过量后,随着溶液中氢氧根离子浓度逐渐增大,水的电离程度逐渐减小,所以滴加过程中,水的电离程度先增大后减小,错误;B.由CH3COONH4的水解常数Kh= ,随着氨水的加入,c(H+)逐渐减小,Kh不变,则始终减小,错误;C.n(CH3COOH)与n(CH3COO-)之和为0.001ml,始终保持不变,由于溶液体积逐渐增大,所以c(CH3COOH)与c(CH3COO-)之和逐渐减小,错误;D.当加入氨水的体积为10mL时,醋酸和一水合氨的物质的量相等,由于二者的电离常数相等,所以溶液显示中性,c(H+)=c(OH-),根据电荷守恒可知:c(NH4+)=c(CH3COO-),正确;故答案为D。
24.(2011·四川高考真题)25℃时,在等体积的①pH=0的H2SO4溶液、②0.05ml/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1:10:1010:109B.1:5:5×109:5×10
C.1:20:1010:109D.1:10:104:109
【答案】A
【解析】
①中pH=0的H2SO4中c(H+)=1.0 ml·L-1,c(OH-)=1.0×10-14ml·L-1,水电离程度为1.0×10-14ml·L-1;
②中c(OH-)=0.1 ml·L-1,c(H+)=1.0×10-13ml·L-1,水电离程度为1.0×10-13ml·L-1;
③中c(OH-)=1.0×10-4ml·L-1,水的电离程度为1.0×10-4ml·L-1;
④中c(H+)=1.0×10-5ml·L-1,水的电离程度为1.0×10-5ml·L-1;
故①②③④中水的电离程度之比为:1.0×10-14ml·L-1:1.0×10-13ml·L-1:1.0×10-4ml·L-1:1.0×10-5ml·L-1=1:10:1010:109,正确。
答案选A。
25.(2013·上海高考真题)374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
A.显中性,pH等于7B.表现出非极性溶剂的特性
C.显酸性,pH小于7D.表现出极性溶剂的特性
【答案】B
【解析】A.25℃时,水的pH=7,水的电离是吸热过程,升高温度促进水的电离,在374℃时,超临界水显中性,pH<7,A错误;B.超临界水具有很强的溶解有机物的能力,根据相似相溶原理,说明超临界水表现出非极性溶剂的特性,B正确;C.25℃时,水的pH=7,水的电离是吸热过程,升高温度促进水的电离,在374℃时,超临界水中H+与OH-浓度相等,显中性,pH<7,C错误;D.超临界水具有很强的溶解有机物的能力,根据相似相溶原理,说明超临界水表现出非极性溶剂的特性,D错误;答案选B。
26.(2013·全国高考真题)室温时,M(OH)2(S)M2+(aq)+2OH-(aq) Ksp=a,c(M2+)="b" ml·L-1时,溶液的pH等于( )
A.12lg(ba) B.12lg(12)
C.14+12lg(12) D.14+12lg(ba)
【答案】C
【解析】根据Ksp=a= c(M2+)·c(OH-)2,c(M2+)=b ml·L-1,解得c(OH-)2=(ab)。本题是碱性环境,先求出c(OH-),根据水的离子积,在求出c(H+),在求出溶液的pH=14+12lg(ab)。
27.(2011·上海高考真题)常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
A.b不可能显碱性B.a可能显酸性或碱性
C.a不可能显酸性D.b可能显碱性或酸性
【答案】AB
【解析】根据pH都为11的氨水、氢氧化钠溶液,氢氧化钠的浓度小,再讨论pH为3的某酸溶液,利用等体积混合反应后溶液中的溶质来分析溶液的酸碱性。A.pH为3的某酸溶液,为强酸时与等体积pH为11的氢氧化钠恰好完全反应,生成强酸强碱盐,则溶液为中性;酸为弱酸时酸过量,则溶液一般为酸性,即b不可能显碱性,正确;B.某酸溶液为强酸时与等体积pH为11的氨水反应时氨水过量,则a可能显碱性;若为弱酸时恰好完全反应,生成弱酸弱碱盐,当弱酸酸根离子的水解小于弱碱中离子的水解,则a可能显酸性,正确;C.若为pH=3弱酸与等体积pH为11的氨水恰好完全反应时,生成弱酸弱碱盐,当弱酸酸根离子的水解小于弱碱中离子的水解,则a可能显酸性,错误;D.若酸为pH=3弱酸与等体积pH为11的氢氧化钠溶液反应时酸过量,则溶液一般为酸性,即b不可能显碱性,错误。答案选AB。
28.(2012·广东高考真题)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl﹣)+c(OH﹣)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10﹣12ml•L﹣1
D.与等体积0.01 ml•L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣)
【答案】AC
【解析】A、常温下PH为2的盐酸溶液中电荷守恒可知,c(H+)=c(Cl﹣)+c(OH﹣),正确;B、一水合氨是弱电解质存在电离平衡,与等体积PH=12的氨水混合后,一水合氨会继续电离出氢氧根离子,氨水过量,显碱性,错误;C、常温下PH为2的盐酸溶液中c(H+)=0.01ml/L;c(H+)水=c(OH﹣)水=KW/c(H+)=1.0×10﹣12ml•L﹣1;正确;D,反应后生成乙酸和氯化钠,水溶液为酸性,醋酸是弱电解质存在电离平衡,c(Cl﹣)>c(CH3COO﹣),错误;故选AC.
十年(23-22)高考化学真题分项汇编专题45 水的电离与溶液的pH(2份打包,原卷版+教师版): 这是一份十年(23-22)高考化学真题分项汇编专题45 水的电离与溶液的pH(2份打包,原卷版+教师版),文件包含十年23-22高考化学真题分项汇编专题45水的电离与溶液的pH原卷版doc、十年23-22高考化学真题分项汇编专题45水的电离与溶液的pH教师版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
考点27 水的电离和溶液的pH 真题过关 2023年高考化学一轮复习: 这是一份考点27 水的电离和溶液的pH 真题过关 2023年高考化学一轮复习,文件包含考点27水的电离和溶液的pH真题过关教师版2023年高考化学一轮复习docx、考点27水的电离和溶液的pH真题过关学生版2023年高考化学一轮复习docx等2份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
高考化学(2011~2020)真题专项练习 专题24 电解原理(教师版): 这是一份高考化学(2011~2020)真题专项练习 专题24 电解原理(教师版),共15页。试卷主要包含了铅蓄电池的工作原理为,某兴趣小组设计如下微型实验装置等内容,欢迎下载使用。












