

2021届高考化学一轮复习 第七章 专题讲座七 用数形结合的思想探究化学平衡图像教案(含解析)
展开专题讲座七 用数形结合的思想探究化学平衡图像
1.图像类型
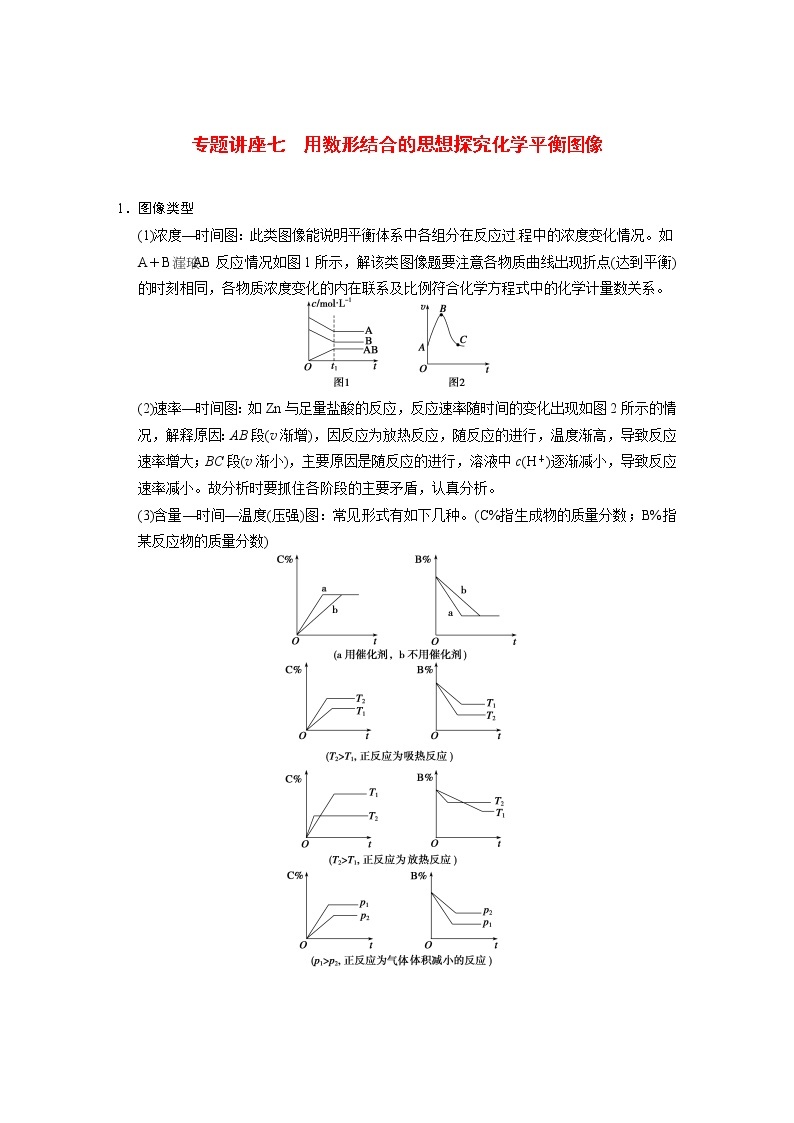
(1)浓度—时间图:此类图像能说明平衡体系中各组分在反应过程中的浓度变化情况。如A+BAB反应情况如图1所示,解该类图像题要注意各物质曲线出现折点(达到平衡)的时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系。
(2)速率—时间图:如Zn与足量盐酸的反应,反应速率随时间的变化出现如图2所示的情况,解释原因:AB段(v渐增),因反应为放热反应,随反应的进行,温度渐高,导致反应速率增大;BC段(v渐小),主要原因是随反应的进行,溶液中c(H+)逐渐减小,导致反应速率减小。故分析时要抓住各阶段的主要矛盾,认真分析。
(3)含量—时间—温度(压强)图:常见形式有如下几种。(C%指生成物的质量分数;B%指某反应物的质量分数)
(4)恒压(温)线(如图3所示):该类图的纵坐标为物质的平衡浓度(c)或反应物的转化率(α),横坐标为温度(T)或压强(p),常见类型如下所示:
(5)其他:如图4所示曲线是其他条件不变时,某反应物的最大转化率(α)与温度(T)的关系曲线,图中标出的1、2、3、4四个点,表示v正>v逆的点是3,表示v正<v逆的点是1,而2、4点表示v正=v逆。
2.解题步骤
3.解题技巧
(1)先拐先平
在含量(转化率)—时间曲线中,先出现拐点的先达到平衡,说明该曲线反应速率快,表示温度较高、有催化剂、压强较大等。
(2)定一议二
当图像中有三个量时,先确定一个量不变,再讨论另外两个量的关系,有时还需要作辅助线。
(3)三步分析法
一看反应速率是增大还是减小;二看v正、v逆的相对大小;三看化学平衡移动的方向。
题组一 浓度—时间图像
1.已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应)。现将一定量NO2和N2O4的混合气体通入一体积为1 L的恒温密闭容器中,反应物浓度随时间变化关系如图所示,回答下列问题:
(1)图中共有两条曲线X和Y,其中曲线______表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是________。
(2)前10 min内用NO2表示的化学反应速率v(NO2)=__________mol·L-1·min-1;反应进行至25 min时,曲线发生变化的原因是
________________________________________________________________________。
(3)若要达到与最后相同的化学平衡状态,在25 min时还可以采取的措施是________。
A.加入催化剂 B.缩小容器体积
C.升高温度 D.加入一定量的N2O4
答案 (1)X bd (2)0.04 加入了0.4 mol NO2(或加入了NO2) (3)BD
解析 (1)曲线X在0~10 min达到平衡时浓度变化了0.4 mol·L-1,而曲线Y在0~10 min达到平衡时变化了0.2 mol·L-1,所以可得X曲线为NO2的浓度变化曲线;达到平衡时浓度不再随时间而发生变化,所以b、d点均表示反应已达到平衡状态。
(2)NO2在0~10 min达到平衡时浓度变化了0.4 mol·L-1,所以用NO2表示的反应速率为0.04 mol·L-1·min-1;而在25 min 时,NO2的浓度由0.6 mol·L-1突变为1.0 mol·L-1,而N2O4的浓度在25 min时没有发生改变,所以可得此时改变的条件是向容器中加入了0.4 mol NO2。
(3)加入NO2后平衡正向移动,所以若要达到与最后相同的化学平衡状态,还可通过增大压强(缩小容器体积),使平衡也同样正向移动;或者采取降低温度的方法,使平衡正向移动;也可以向容器中充入一定量N2O4,因为这样相当于增大容器中气体的压强,使得NO2的转化率提高,即达到与最后的平衡相同的平衡状态。
题组二 含量(转化率)—时间—温度(压强)图像
2.密闭容器中进行的可逆反应:aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)
下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是
( )
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
答案 B
解析 当图像中有三个变量时,先确定一个量不变,再讨论另外两个量的关系,这叫做“定一议二”。解答该题要综合运用“定一议二”和“先拐先平”的原则。由(T1,p1)和(T1,p2)两条曲线可以看出:①温度相同(T1),但压强为p2时达到平衡所需的时间短,即反应速率大,所以p2>p1;②压强较大(即压强为p2)时对应的w(B)较大,说明增大压强平衡逆向移动,则a+b<c。由(T1,p2)和(T2、p2)两条曲线可以看出:①压强相同(p2),但温度为T1时达到平衡所需的时间短,即反应速率大,所以T1>T2;②温度较高(即温度为T1)时对应的w(B)较小,说明升高温度平衡正向移动,故正反应为吸热反应。
题组三 恒温线(或恒压线)图像
3. 有一化学平衡mA(g)+nB(g)pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系。下列叙述正确的是 ( )
A.正反应是放热反应;m+n>p+q
B.正反应是吸热反应;m+n<p+q
C.正反应是放热反应;m+n<p+q
D.正反应是吸热反应;m+n>p+q
答案 D
解析 图像中有三个量,应定一个量来分别讨论另外两个量之间的关系。定压强,讨论T与A的转化率的关系:同一压强下,温度越高,A的转化率越高,说明正反应是吸热反应;定温度,讨论压强与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是体积缩小的反应,即m+n>p+q。
题组四 速率、平衡综合图像
4.下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是 ( )
A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
答案 C
解析 根据图像①,升高温度,平衡正向移动,正反应ΔH>0,A错;②反应实质是Fe3++3SCN-Fe(SCN)3,K+和Cl-不参加化学反应,KCl浓度增大不影响化学平衡,B错;③使用催化剂,反应速率加快,先达到平衡,C正确;④此反应为反应前后气体物质的量不变的化学反应,改变压强不影响平衡状态,即不影响A的转化率,且由于不断加入B,A的转化率增大,D错。
5.某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
下列说法中正确的是 ( )
A.30~40 min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低温度,40 min时升高温度
D.8 min前A的反应速率为0.08 mol·L-1·min-1
答案 D
解析 A项,若使用催化剂,则化学反应速率加快,A不正确;由物质的量浓度—时间图像可知,A、B的浓度变化相同,故A、B的计量数相同,都为1,由反应速率—时间图像可知,30 min时改变的条件为降压,40 min时改变的条件为升温,且升高温度平衡向逆反应方向移动,则正反应为放热反应;8 min 前A的反应速率为(2.0 mol·L-1-1.36 mol·L-1)/8 min=0.08 mol·L-1·min-1。
题组五 其他类图像
6.将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)I(aq)。该平衡体系中,I的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态)。下列说法正确的是 ( )
A.反应速率:vM>vP
B.平衡常数:KN<KP
C.M、N两点相比,M点的c(I-)大
D.Q点时,v正>v逆
答案 D
解析 A中,温度越高,反应速率越大,vM<vP;B中,由题图可知,升温,c(I)减小,所以平衡常数:KN>KP;C中,M、N两点相比,M点温度低于N点温度,升温,平衡左移,所以M点的c(I-)小。
7.在容积相同的密闭容器内,分别充入同量的N2和H2,在不同温
度下,任其发生反应N2(g)+3H2(g)2NH3(g),并分别在t秒时测定其中NH3的体积分数,绘图如右:
(1)A、B、C、D、E五点中,尚未达到化学平衡状态的点是______。
(2)此可逆反应的正反应是______反应(填“放热”或“吸热”)。
(3)AC段的曲线是增函数,CE段曲线是减函数,试从反应速率和平衡角度说明理由:________________________________________________________________________。
答案 (1)AB (2)放热 (3)AC段:反应开始v正>v逆,反应向右进行生成NH3;CE段:已达平衡,升温使平衡左移,NH3的体积分数变小
高考化学二轮复习教案专题突破(七) 化学反应速率和化学平衡图像的分析(含解析): 这是一份高考化学二轮复习教案专题突破(七) 化学反应速率和化学平衡图像的分析(含解析),共19页。
2022届高考统考化学人教版一轮复习教师用书:第1部分 高考专题讲座 4 化学平衡图像的分类突破教案: 这是一份2022届高考统考化学人教版一轮复习教师用书:第1部分 高考专题讲座 4 化学平衡图像的分类突破教案,共12页。
高考化学一轮复习 第七章 专题讲座七 用数形结合的思想探究化学平衡图像教案(含解析): 这是一份高考化学一轮复习 第七章 专题讲座七 用数形结合的思想探究化学平衡图像教案(含解析),共6页。












