

人教版 (新课标)必修2第一节 元素周期表导学案及答案
展开课时2 元素的性质与原子结构
1.了解碱金属、卤素原子在周期表中的位置。
2.了解碱金属、卤素原子结构特点,了解原子结构与元素性质的关系。
3.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。重难点
碱金属元素 |
[基础·初探]
教材整理 碱金属元素的原子结构与性质
1.碱金属元素的原子结构
碱金属元素包括:Li、Na、K、Rb、Cs、Fr(写元素符号)。
原子结构特点如下:
(1)相似性:最外层电子数都是__1__。
(2)递变性:Li―→Cs,核电荷数增大,电子层数增多,原子半径增大。
2.碱金属的化学性质(写出化学方程式)
(1)与O2反应
①锂与氧气反应:4Li+O22Li2O。
②钠与氧气反应:4Na+O2===2Na2O;2Na+O2Na2O2。
(2)与H2O反应
①钠与水反应:2Na+2H2O===2NaOH+H2↑。
②钾与水反应:2K+2H2O===2KOH+H2↑。
3.碱金属单质的物理性质
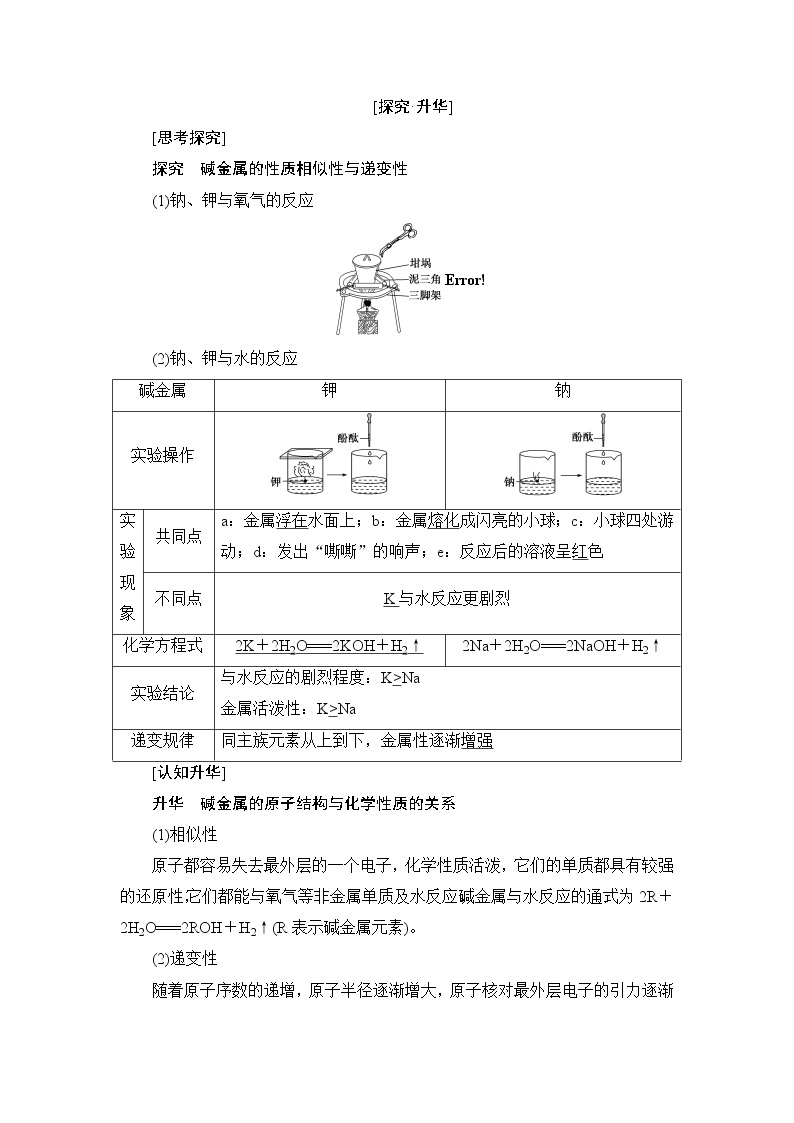
[探究·升华]
[思考探究]
探究 碱金属的性质相似性与递变性
(1)钠、钾与氧气的反应
(2)钠、钾与水的反应
碱金属 | 钾 | 钠 | |
实验操作 | |||
实 验 现 象 | 共同点 | a:金属浮在水面上;b:金属熔化成闪亮的小球;c:小球四处游动;d:发出“嘶嘶”的响声;e:反应后的溶液呈红色 | |
不同点 | K与水反应更剧烈 | ||
化学方程式 | 2K+2H2O===2KOH+H2↑ | 2Na+2H2O===2NaOH+H2↑ | |
实验结论 | 与水反应的剧烈程度:K>Na 金属活泼性:K>Na | ||
递变规律 | 同主族元素从上到下,金属性逐渐增强 | ||
[认知升华]
升华 碱金属的原子结构与化学性质的关系
(1)相似性
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑(R表示碱金属元素)。
(2)递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
①
②与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成Na2O2,而K与O2反应能够生成KO2等。
③与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
④最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
[题组·冲关]
题组 碱金属的结构与性质
1.下列各组比较不正确的是( )
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
【解析】 A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性:K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH。
【答案】 B
2.下列对碱金属元素性质的叙述中,正确的是( )
【导学号:30032007】
A.都是银白色的柔软金属(除铯外),密度都比较大
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水剧烈反应生成碱和氢气
D.单质的熔、沸点随着原子序数的增加而升高
【解析】 A项,密度较小;B项,Li生成Li2O;D项,熔、沸点降低。
【答案】 C
3.下列有关金属钠和金属钾的比较,正确的是( )
A.金属性:Na>K
B.氢氧化物的碱性:Na<K
C.还原性:Na>K
D.密度:Na<K
【解析】 A项,金属性:Na<K;B项,碱性:KOH>NaOH;C项,还原性:Na<K;D项,密度:Na>K。
【答案】 B
【题后归纳】 碱金属元素性质的特殊性
1碱金属单质还原性最强的是Cs放射性元素除外,最弱的是Li。
2碱金属元素只有Li与O2反应的产物为Li2O一种,其他与O2反应的产物至少有两种。
3碱金属元素的最高价氧化物对应水化物中只有LiOH微溶,其他均为易溶于水的强碱。
4碱金属单质从Li→Cs,密度逐渐增大,但K的密度小于Na。
5Na、K通常保存在煤油中,但Li通常用石蜡密封。
卤族元素 |
[基础·初探]
教材整理1 卤族元素的结构与性质
1.卤族元素的原子结构
卤族元素包括:F、Cl、Br、I、At(写元素符号)。
原子结构特点如下:
(1)相似性:最外层电子数都是____7____;
(2)递变性:F→I,核电荷数增多,电子层数增多,原子半径增大。
2.卤素单质的物理性质
| F2 | Cl2 | Br2 | I2 |
颜色、状态 | 淡黄绿色气体 | 黄绿色气体 | 深红棕色液体 | 紫黑色固体 |
密度 | 逐渐增大 | |||
熔、沸点 | 逐渐升高 | |||
3.卤素单质的化学性质
(1)卤素单质与氢气的反应。
从F2到I2(用“>”或“<”填写):
反应的剧烈程度:F2>Cl2>Br2>I2;
氢化物的稳定性:HF>HCl>HBr>HI。
(2)卤素单质间置换反应(写出化学反应方程式)。
将氯水加入NaBr溶液中:Cl2+2NaBr===2NaCl+Br2;
将氯水加入KI溶液中:Cl2+2KI===2KCl+I2;
将溴水加入KI溶液中:Br2+2KI===2KBr+I2。
(3)结论:随着核电荷数的增加,卤素单质的氧化性逐渐减弱,卤族元素的非金属性逐渐减弱。
教材整理2 同主族元素的结构与性质的关系
1.元素性质的影响因素
元素的性质主要与原子核外电子的排布,特别是与最外层电子数有关。
2.同主族元素性质的递变规律
[探究·升华]
[思考探究]
探究 卤素单质间的置换反应的实验分析
实验操作 | 实验现象 | 离子方程式 | 结论 |
静置后,液体分层,上层接近无色,下层橙红色 | Cl2+2Br-===2Cl-+Br2 | Cl2、Br2、I2的氧化性逐渐减弱;Cl、Br、I的非金属性逐渐减弱。 | |
静置后,液体分层,上层接近无色,下层紫红色 | Cl2+2I-===2Cl-+I2 | ||
静置后,液体分层,上层接近无色,下层紫红色 | Br2+2I-===2Br-+I2 |
规律:同主族元素从上到下,非金属性逐渐减弱。
[认知升华]
升华 卤素单质的相似性和递变性
(1)相似性
①与H2反应:X2+H22HX
②与活泼金属(如Na)反应:2Na+X22NaX
③与H2O反应
(2)递变性
①氧化性与还原性
②与H2反应的难易及氢化物的稳定性(由F2―→I2)
a.与H2反应越来越难,生成的氢化物的稳定性逐渐减弱,还原性逐渐增强。
b.氢化物中HCl、HBr、HI的熔、沸点依次升高。
③卤素单质与变价金属(如Fe)反应
[题组·冲关]
题组1 卤素的结构与性质分析
1.卤素是最活泼的一族非金属,下列关于卤族元素的说法正确的是( )
A.卤素单质的最外层电子数都是7
B.从上到下,卤素原子的电子层数依次增多,半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D.卤素单质与H2化合的难易程度为F2<Cl2<Br2<I2
【解析】 卤素原子最外层有7个电子,而不是单质最外层有7个电子,A项错误;卤素原子从F到I,电子层数依次增多,原子半径依次增大,原子核对最外层电子吸引能力依次减弱,原子得电子能力依次减弱,故B项错误,C项正确;单质与H2化合的难易程度为:F2>Cl2>Br2>I2,D项错误。
【答案】 C
2.下列对卤素的说法不符合递变规律的是( )
A.F2、Cl2、Br2、I2的氧化性逐渐减弱
B.HF、HCl、HBr、HI的热稳定性逐渐减弱
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大
【解析】 从F→I原子半径依次增大,单质氧化性逐渐减弱,则阴离子的还原性逐渐增强,氢化物的稳定性逐渐减弱,卤素单质按F2、Cl2、Br2、I2的顺序颜色逐渐变深,密度也逐渐增大。
【答案】 D
【规律总结】 卤素单质的特殊性
1氟无正价,无含氧酸。而Cl、Br、I都有正化合价和含氧酸。
2Cl2易液化,Br2易挥发,I2易升华。
3常温下呈液态的非金属单质是Br2,I2遇淀粉变蓝色。
4活泼的卤素单质能置换较不活泼的卤素单质,但F2不能从NaCl溶液中置换出Cl2,原因是2F2+2H2O===4HF+O2。
题组2 元素金属性与非金属性强弱的判断
3.下列事实不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B.1 mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水(或酸)反应置换出氢气的难易程度
【解析】 金属性强弱与失电子多少没有直接关系。
【答案】 B
4.下列有关物质性质的比较正确的是( )
【导学号:30032008】
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2-
⑥酸性:HNO3>H3PO4
A.①③ B.②④ C.③⑥ D.⑤⑥
【解析】 同主族元素的单质从上到下:熔点不一定逐渐升高,如碱金属,从上到下熔点逐渐降低,①不正确;元素的非金属性越强,气态氢化物稳定性越强,②不正确;卤素非金属性:F>Cl>Br>I,单质与水反应的剧烈程度:F2>Cl2>Br2>I2,③正确;非金属气态氢化物水溶液的酸性与其非金属性的强弱不呈规律性递变,④不正确;还原性:Se2->S2-,⑤不正确;非金属性:N>P,酸性:HNO3>H3PO4,⑥正确,故选C。
【答案】 C
【题后归纳】 元素的金属性与非金属性强弱的判断依据
金属性的比较 | ①在金属活动性顺序表中位置越靠前,金属性越强 ②单质与水或非氧化性酸反应越剧烈,金属性越强 ③单质还原性越强或阳离子氧化性越弱,金属性越强 ④最高价氧化物的水化物的碱性越强,金属性越强 ⑤若Xn++Y―→X+Ym+,则Y的金属性比X的金属性强 |
非金属性的比较 | ①与H2越易化合或气态氢化物越稳定,非金属性越强 ②单质氧化性越强或阴离子还原性越弱,非金属性越强 ③最高价氧化物的水化物的酸性越强,非金属性越强 ④若An-+B―→Bm-+A,则B的非金属性比A的非金属性强 |
人教版 (2019)选择性必修2第二节 原子结构与元素的性质第2课时学案: 这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质第2课时学案,共12页。学案主要包含了原子半径,电离能,电负性等内容,欢迎下载使用。
高中人教版 (新课标)第三节 生活中两种常见的有机物学案: 这是一份高中人教版 (新课标)第三节 生活中两种常见的有机物学案,共7页。
化学必修2第二节 来自石油和煤的两种基本化工原料学案: 这是一份化学必修2第二节 来自石油和煤的两种基本化工原料学案,共7页。













