高考化学知识点复习教案17
展开1、常见物质的检验和除杂;
2、用过滤、蒸发、蒸馏、萃取等方法对混合物进行分离和提纯;
教学难点、重点:
常见物质的检验和除杂
教学过程:
知识点1、常见混合物分离提纯的方法与装置
(一)、分离和提纯的原则:
首先应分析各组分的物理和化学性质,然后再选择适宜的方法,且一般要遵循
①提纯过程中不引入新的杂质;
②不减少被提纯的物质;
③被提纯物质要复原;
④除杂试剂应过量且过量试剂必须除尽;
⑤被提纯物质与杂质容易分离;
⑥分离与提纯方法简便易行等原则。
(二)、分离提纯常用到方法
常见物质分离提纯的方法:
①固——固混合分离型:灼烧、热分解、升华、结晶(重结晶)
②固——液混合物分离型:过滤、盐析、蒸发
③液——液混合物分离型:萃取、分液、蒸馏、渗析
④气——气混合分离型:洗气
(1).固体灼烧:除去固体物质中含有的易升华、易分解物质或除去结晶水合物的结晶水等。如除去Na2CO3溶液中的NaHCO3。
(2).过滤:分离固体与液体互不相溶的混合物,如除去NaCl溶液中的BaCO3。
注意事项:“一贴二低三靠” 滤纸紧贴漏斗内壁,滤纸低于漏斗边缘,液面低于滤纸边缘,上烧杯口紧靠玻棒,玻棒末端紧靠三层滤纸处,漏斗末端紧靠下烧杯内壁
例:a粗盐的提纯的步骤:溶解→加试剂产生沉淀→过滤→蒸发
b.每个步骤操作的方法:
c提纯后的精盐中还有哪些杂质(怎样去检验出这些杂质):
d如何除去粗盐中含有的可溶性的杂质CaCl2、MgCl2和一些硫酸盐,加入的试剂与顺序是:
(3).蒸发结晶:加热使溶质从溶液中结晶分离出来,如从NaCl溶液中分离出NaCl。
注意事项:加热过程不断搅拌 ,以免局部过热 ;较多晶体析出时停止加热,利用余热把剩余水蒸干。
(4).降温结晶:降低饱和溶液温度,适用于分离随温度变化溶解度有很大变化的物质,如KNO3的结晶提纯。
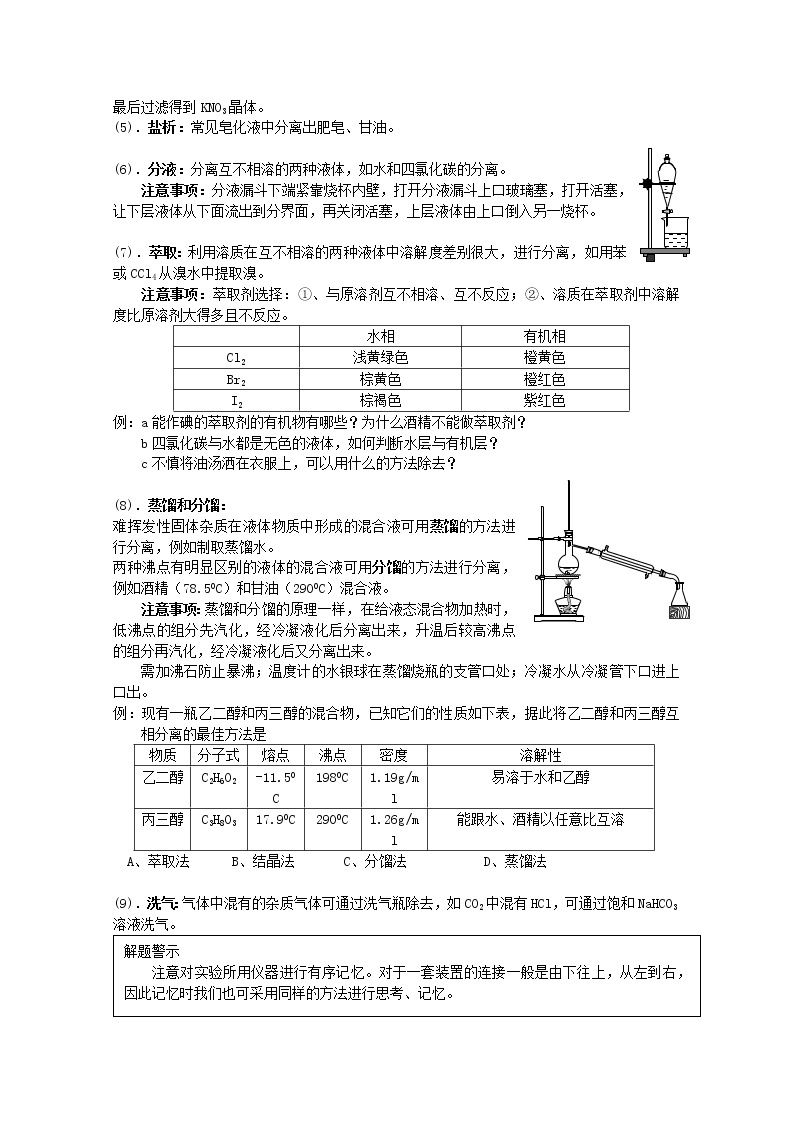
注意事项:先用热水配置浓溶液,形成较高温度下的饱和溶液,再冷却,即有结晶析出,最后过滤得到KNO3晶体。
(5).盐析:常见皂化液中分离出肥皂、甘油。
(6).分液:分离互不相溶的两种液体,如水和四氯化碳的分离。
注意事项:分液漏斗下端紧靠烧杯内壁,打开分液漏斗上口玻璃塞,打开活塞,让下层液体从下面流出到分界面,再关闭活塞,上层液体由上口倒入另一烧杯。
(7).萃取:利用溶质在互不相溶的两种液体中溶解度差别很大,进行分离,如用苯或CCl4从溴水中提取溴。
注意事项:萃取剂选择:①、与原溶剂互不相溶、互不反应;②、溶质在萃取剂中溶解度比原溶剂大得多且不反应。
例:a能作碘的萃取剂的有机物有哪些?为什么酒精不能做萃取剂?
b四氯化碳与水都是无色的液体,如何判断水层与有机层?
c不慎将油汤洒在衣服上,可以用什么的方法除去?
(8).蒸馏和分馏:
难挥发性固体杂质在液体物质中形成的混合液可用蒸馏的方法进行分离,例如制取蒸馏水。
两种沸点有明显区别的液体的混合液可用分馏的方法进行分离,例如酒精(78.50C)和甘油(2900C)混合液。
注意事项:蒸馏和分馏的原理一样,在给液态混合物加热时,低沸点的组分先汽化,经冷凝液化后分离出来,升温后较高沸点的组分再汽化,经冷凝液化后又分离出来。
需加沸石防止暴沸;温度计的水银球在蒸馏烧瓶的支管口处;冷凝水从冷凝管下口进上口出。
例:现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此将乙二醇和丙三醇互相分离的最佳方法是
A、萃取法 B、结晶法 C、分馏法 D、蒸馏法
(9).洗气:气体中混有的杂质气体可通过洗气瓶除去,如CO2中混有HCl,可通过饱和NaHCO3溶液洗气。
解题警示
注意对实验所用仪器进行有序记忆。对于一套装置的连接一般是由下往上,从左到右,因此记忆时我们也可采用同样的方法进行思考、记忆。
知识点2、常见离子的检验方法
1.阳离子的检验:
2.阴离子的检验:
例:对于某些离子的检验结论一定正确的是( )
加入稀盐酸产生无色气体,将气体通入澄清的石灰水中,溶液变浑浊,一定有CO32-
加入BaCl2溶液有白色沉淀产生,在加入稀盐酸,沉淀不消失,一定有SO42-
加入NaOH溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH4+
加入Na2 CO3溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+
例:某物质中可能含有可溶性的硫酸盐、碳酸盐、硝酸盐,若加入氯化钡溶液产生白色沉淀能证明其中有硫酸盐吗?如果不能应如何证明?
知识点3、常见物质的检验:
(1)H2:灼热的CuO和CuSO4,黑色的CuO变红,白色CuSO4粉末变蓝色。
(2)O2:带火星的木条,木条复燃。
(3) CO2:气体通入石灰水,石灰水变浑浊。
(4) Cl2:湿润的淀粉KI试纸,变蓝。
(5) HCl:通入硝酸银和稀硝酸,产生白色沉淀。
(6) SO2:品红溶液,品红溶液红色退去,再加热。又出现红色。
(7) NH3:湿润的红色石蕊试纸,变蓝。
(8) NO:打开瓶口与空气接触,立即变为红棕色气体。
水相
有机相
Cl2
浅黄绿色
橙黄色
Br2
棕黄色
橙红色
I2
棕褐色
紫红色
物质
分子式
熔点
沸点
密度
溶解性
乙二醇
C2H6O2
-11.50C
1980C
1.19g/ml
易溶于水和乙醇
丙三醇
C3H8O3
17.90C
2900C
1.26g/ml
能跟水、酒精以任意比互溶
离子
检验试剂
实验现象
离子方程式
H+
石蕊试液
溶液变红
Na+
K+
焰色反应
火焰呈黄色
火焰呈紫色
Fe3+
= 1 \* GB3 ①NaOH溶液
= 2 \* GB3 ②KSCN溶液
= 1 \* GB3 ①出现红褐色沉淀
= 2 \* GB3 ②溶液呈血红色
= 1 \* GB3 ①Fe3++3OH-=Fe(OH)3↓
= 2 \* GB3 ② Fe3++SCN-=[Fe(SCN)]2+
NH4+
与NaOH溶液混合加热,产生使湿润的红色石蕊试纸变蓝的气体
无色有刺激性气味的气体,试纸变蓝
NH4++OH- △ NH3↑+H2O
Al3+
NaOH溶液,氨水
生成的白色沉淀,继续加NaOH溶液,沉淀溶解;继续加氨水沉淀不溶解
Al3++3OH-=Al(OH)3↓
Al(OH)3+OH-=AlO2-+2H2O
离子
检验试剂
实验现象
OH-
= 1 \* GB3 ①酚酞试液
= 2 \* GB3 ②石蕊试液
= 1 \* GB3 ①呈红色
= 2 \* GB3 ②呈蓝色
Cl-
AgNO3,稀HNO3
白色沉淀
Ag++Cl-=AgCl↓
Br-
AgNO3,稀HNO3
淡黄色沉淀
Ag++Br-=AgBr↓
I-
AgNO3,稀HNO3
黄色沉淀
Ag++I-=AgI↓
SO42-
HCl,BaCl2溶液
加HCl无沉淀,再加BaCl2有白色沉淀
Ba2++SO42-=BaSO4↓
CO32-
HCl,澄清石灰水
白色沉淀
CO32-+2H+=CO2↑+H2O
CO2+Ca(OH)2=CaCO3+2H2O
高考化学知识点复习教案20: 这是一份高考化学知识点复习教案20,共9页。
高考化学知识点复习教案18: 这是一份高考化学知识点复习教案18,共3页。教案主要包含了氯气的性质,卤族元素等内容,欢迎下载使用。
高考化学知识点复习教案9: 这是一份高考化学知识点复习教案9,共4页。教案主要包含了领悟·整合,联想·发散,知识·链接,启发·引申,专题放送等内容,欢迎下载使用。