

人教版 (新课标)必修2第二节 元素周期律精品第2课时课堂检测
展开第2课时 元素周期律
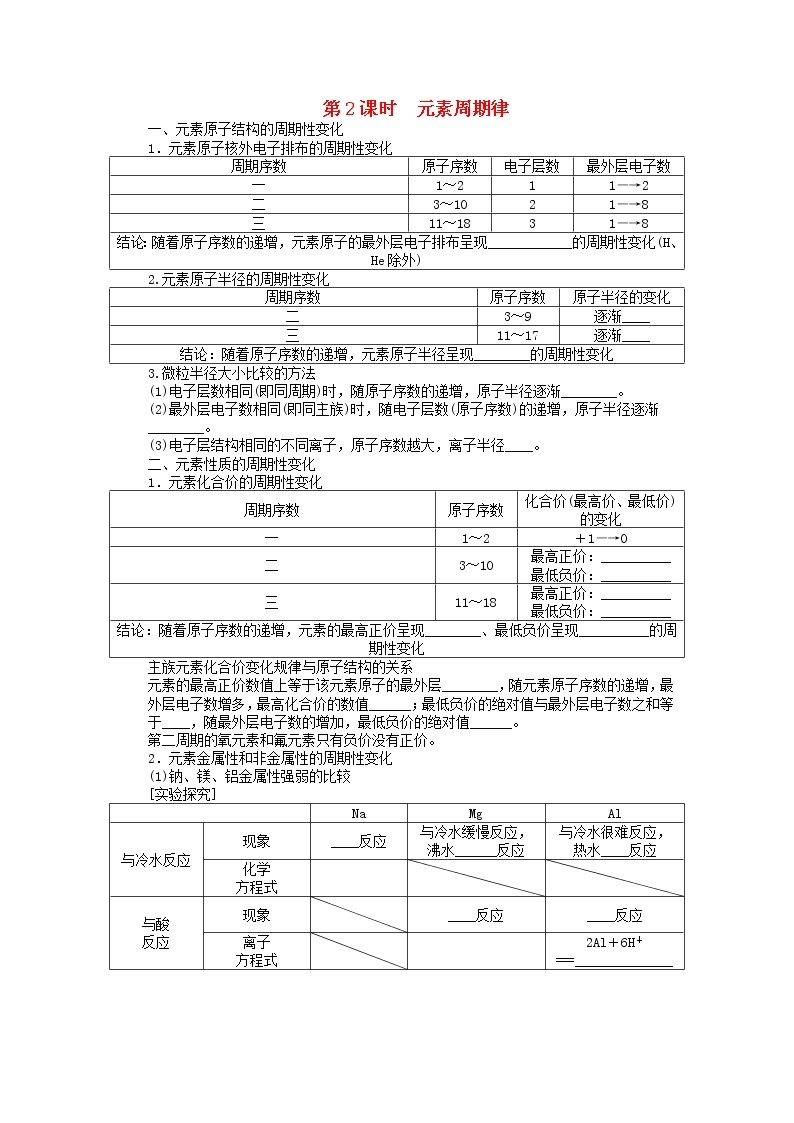
一、元素原子结构的周期性变化
1.元素原子核外电子排布的周期性变化
周期序数 | 原子序数 | 电子层数 | 最外层电子数 |
一 | 1~2 | 1 | 1―→2 |
二 | 3~10 | 2 | 1―→8 |
三 | 11~18 | 3 | 1―→8 |
结论:随着原子序数的递增,元素原子的最外层电子排布呈现____________的周期性变化(H、He除外) | |||
2.元素原子半径的周期性变化
周期序数 | 原子序数 | 原子半径的变化 |
二 | 3~9 | 逐渐____ |
三 | 11~17 | 逐渐____ |
结论:随着原子序数的递增,元素原子半径呈现________的周期性变化 | ||
3.微粒半径大小比较的方法
(1)电子层数相同(即同周期)时,随原子序数的递增,原子半径逐渐________。
(2)最外层电子数相同(即同主族)时,随电子层数(原子序数)的递增,原子半径逐渐
________。
(3)电子层结构相同的不同离子,原子序数越大,离子半径____。
二、元素性质的周期性变化
1.元素化合价的周期性变化
周期序数 | 原子序数 | 化合价(最高价、最低价)的变化 |
一 | 1~2 | +1―→0 |
二 | 3~10 | 最高正价:__________ 最低负价:__________ |
三 | 11~18 | 最高正价:__________ 最低负价:__________ |
结论:随着原子序数的递增,元素的最高正价呈现________、最低负价呈现__________的周期性变化 | ||
主族元素化合价变化规律与原子结构的关系
元素的最高正价数值上等于该元素原子的最外层________,随元素原子序数的递增,最
外层电子数增多,最高化合价的数值______;最低负价的绝对值与最外层电子数之和等
于____,随最外层电子数的增加,最低负价的绝对值______。
第二周期的氧元素和氟元素只有负价没有正价。
2.元素金属性和非金属性的周期性变化
(1)钠、镁、铝金属性强弱的比较
[实验探究]
| Na | Mg | Al | |
与冷水反应 | 现象 | ____反应 | 与冷水缓慢反应, 沸水______反应 | 与冷水很难反应, 热水____反应 |
化学 方程式 |
|
|
| |
与酸 反应 | 现象 |
| ____反应 | ____反应 |
离子 方程式 |
|
| 2Al+6H+===______________ | |
最高价氧化物 对应水化物 的碱性强弱 | NaOH____ | Mg(OH)2 ____碱 | Al(OH)3 两性氢氧化物 | |
结论 | 金属性____ | |||
变化规律:钠、镁、铝与水(或酸)反应的剧烈程度逐渐____,置换出氢越来越____;最
高价氧化物对应水化物的碱性逐渐________,因此元素的金属性逐渐________。
(2)Si、P、S、Cl 4种非金属元素的性质比较:
非金属元素 | 硅 | 磷 | 硫 | 氯 |
单质与氢气反应的条件 | 高温 | 磷蒸气与氢气能发生反应 | 加热 | 光照或点燃时发生爆炸 |
最高价氧化物对应水化物(含氧酸)的酸性强弱 | H2SiO3弱酸 | H3PO4中强酸 | H2SO4强酸 | HClO4强酸(比H2SO4酸性强) |
通过上表可以看出:硅、磷、硫、氯的单质与氢气化合的能力越来越____;最高价氧化
物对应水化物的酸性逐渐______,因此元素的非金属性逐渐________。
(3)同周期元素金属性、非金属性强弱的变化规律
同周期元素从左到右,元素的金属性逐渐________,非金属性逐渐________。对其他周
期元素的性质进行研究,也可以得到类似结论,所以元素的金属性和非金属性随着原子
序数的递增呈现__________________。
(4)元素的金属性、非金属性与元素在周期表中位置的关系
①同一周期,从左向右,原子半径逐渐________,最外层电子数逐渐________,元素的
原子失电子能力逐渐________,得电子能力逐渐________;元素金属性逐渐________,
非金属性逐渐________;
②同一主族,从上到下,原子半径逐渐________,元素的原子失电子能力逐渐________,
得电子能力逐渐________;元素金属性逐渐________,非金属性逐渐________。
三、元素周期律
1.内容:元素的__________随着元素__________________而呈________的变化。
2.实质:元素性质的周期性变化是元素原子的______________的周期性变化的必然结果。
知识点一 化合价的应用
1.有三种元素分别为X、Y和Z,其质子数均在1~18之间,已知X元素的原子最外
层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一
半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2,则这几种元素
组成的化合物的化学式不可能是( )
A.X2YZ4 B.XYZ3
C.X3YZ4 D.X4Y2Z7
知识点二 元素金属性、非金属性强弱的判断
2.下列叙述中,能肯定A金属比B金属活泼性强的是( )
A.A原子的最外层电子数比B原子的最外层电子数少
B.A原子的电子层数比B原子电子层数多
C.1 mol A从酸中置换出的H2比1 mol B从酸中置换出的H2多
D.常温时,A能从冷水中置换出H2,而B不能
3.根据元素的单质和化合物的性质,判断元素非金属性强弱的依据一般是( )
A.元素最高价氧化物对应水化物的碱性强弱
B.元素最高价氧化物对应水化物的酸性强弱
C.元素的单质跟酸反应置换出氢的难易
D.元素的单质跟氢气生成气态氢化物的沸点高低
知识点三 元素性质的递变规律
4.结合元素周期律的知识分析下列说法,其中错误的是( )
A.Al的氧化物的水化物可能具有两性
B.At2为有色固体,HAt不稳定,AgAt感光性很强,既不溶于水也不溶于稀酸
C.HClO的酸性一定比H2SO4强
D.H2Se是无色、有毒、不如H2S稳定的气体
5.下列各组元素性质递变情况错误的是( )
A.Li、Be、B原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.N、P、F原子半径依次增大
D.Na、K、Rb的金属性依次增强
练基础落实
1.下列关于元素周期律的叙述正确的是( )
A.随元素原子序数的递增,原子最外层电子数总是从1到8重复出现
B.元素的性质随着原子序数的递增而呈周期性变化
C.随元素原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现
D.元素性质的周期性变化的根本原因是:原子半径的周期性变化及元素主要化合价的
周期性变化
2.下列说法正确的是( )
A.ⅠA族元素的金属性比ⅡA族元素的金属性强
B.ⅣA族元素的氢化物中,稳定性最好的是CH4
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.第三周期元素的离子半径从左到右逐渐减小
3.下列各组元素中,按最高正化合价递增顺序排列的是( )
A.C、N、F B.Na、Mg、Al
C.F、Cl、Br D.Cl、S、P
4.X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为( )
A.HX B.H2X C.XH4 D.XH3
5.运用元素周期律分析,下列说法错误的是( )
A.Ra是第七周期第ⅡA族的元素,Ra(OH)2的碱性比Mg(OH)2的碱性强
B.As是第四周期第ⅤA族的元素,AsH3的还原性比NH3的还原性弱
C.Cs的原子半径比Na的原子半径大,Cs与水反应比Na与水反应更剧烈
D.Cl的核电荷数比Al的核电荷数大,Cl的原子半径比Al的原子半径小
6.原子电子层数相同的X、Y、Z三种元素,若最高价氧化物的水化物酸性强弱为H3XO4
<H2YO4<HZO4,则下列判断正确的是( )
A.非金属性强弱为X>Y>Z
B.原子半径为X<Y<Z
C.阴离子的还原性为X3->Y2->Z-
D.气态氢化物的稳定性为H3X>H2Y>HZ
题号 | 1 | 2 | 3 | 4 | 5 | 6 |
答案 |
|
|
|
|
|
|
练方法技巧——由元素周期表判断元素性质的方法
7.下表是元素周期表的一部分,回答下列有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 |
|
|
|
| ① |
| ② |
|
三 | ③ | ④ | ⑤ | ⑥ |
| ⑦ | ⑧ | ⑨ |
四 | ⑩ | ⑪ |
|
|
|
| ⑫ |
|
(1)写出下列元素符号:①________,⑥________,⑦________,⑪________。
(2)在这些元素中,最活泼的金属元素是__________(填元素符号,下同),最活泼的非金
属元素是______,最不活泼的元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是
________,呈两性的氢氧化物是________,写出三者之间相互反应的化学方程式:
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
(4)在这些元素中,原子半径最小的是________,原子半径最大的是________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明?
________________________________________________________________________
________________________________________________________________________。
在⑧与⑫中,化学性质较活泼的是________,怎样用化学实验证明?
________________________________________________________________________
________________________________________________________________________。
练综合拓展
8.在水溶液中,YO和S2-发生反应的离子方程式如下:YO+3S2-+6H+===Y-+3S↓
+3H2O
(1)YO中Y元素的化合价是________。
(2)Y元素原子的最外层电子数是________。
(3)比较S2-和Y-的还原性强弱________________。
9.1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的粒子,互称为等
电子体。等电子体的结构相似,物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的共价分子中,互为等电子体的是________和
________;________和________。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,
各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在
短周期元素组成的物质中,与NO互为等电子体的分子有________、________。
10.有A、B、C、D、E五种短周期元素,A、E同周期,A元素的阳离子所带电荷数等
于其所在周期数减1,常温常压下,B、C、D、E的单质都为双原子分子,它们之间有
如下关系:
(1)2A+C2===2AC (2)3A+D2===A3D2 (3)A+E2===AE2 (4)3B2+D2===2DB3
(5)2B2+C2===2B2C
回答:
(1)A、B、C、D、E五种元素符号是
A:__________,B:__________,C:__________,D:__________,E:__________。
(2)写出A3D2与B2C反应的化学方程式:
_______________________________________________________________________
________________________________________________________________________。
第2课时 元素周期律
基础落实
一、
1.从1递增到8
2.从上到下:减小 减小 由大到小
3.(1)减小 (2)增大 (3)越小
二、
1.从上到下:+1―→+5 -4―→-1 +1―→+7 -4―→-1 +1―→+7 -4―→-1 电子数 增大 8 减小
2.(1)从左到右,从上到下:剧烈 迅速 缓慢 2Na+2H2O===2NaOH+H2↑ 剧烈 迅速 Mg+2H+===Mg2++H2↑
2Al3++3H2↑ 强碱 中强 减弱 减弱 难 减弱 减弱 (2)强 增强 增强 (3)减弱 增强 周期性变化 (4)①变小 增多 减弱 增强
减弱 增强 ②增大 增强 减弱 增强 减弱
三、
1.性质 原子序数的递增 周期性
2.核外电子排布
对点训练
1.A [X可以是H、Li、Na,Y为,是磷元素,Z的L层有6个电子,该元素是氧,再分析各化合物的化学式,计算Y的化合价,其化合价分别为+6,+5,+5,+5,而磷无+6价。]
2.D [选项A中只指出A、B两种元素原子的最外层电子数的多少,不能确定A、B的金属性强弱;选项B中指出了A、B原子的电子层数的多少,但电子层数少的原子的金属性不一定比电子层数多的金属性弱;选项C中说明了等物质的量的金属A、B与酸反应生成氢气的多少,而没有说明反应的剧烈程度,与酸反应生成氢气多的金属活泼性不一定强,如1 mol Al比1 mol Na与足量稀盐酸反应时,Al生成的氢气多,但Al不如Na活泼;选项D正确,只有很活泼的金属在常温下能与冷水反应。]
3.B
4.C [对于不熟悉的元素及其化合物的性质,要以熟悉的元素及其化合物的知识为参照,然后利用元素周期律的有关知识进行推断。在比较元素非金属性或金属性强弱的时候,如果用酸性或碱性强弱来比较,都用元素最高价氧化物对应的水化物的酸碱性强弱来比较。]
5.C [熟练掌握元素周期律的具体内容是解答本题的关键。根据元素周期律可知:元素性质随原子序数的递增,原子结构、原子半径、元素的化合价、元素的金属性或非金属性呈现周期性变化,不难确定答案。]
课后作业
1.B [A项错误,随着元素原子序数的递增,原子最外层电子数在第一周期从1到2,而不是从1到8;B项正确,是元素周期律的内容;C项错误,负价一般是从-4到-1,而不是从-7到-1;D项错误,核外电子排布的周期性变化是元素性质周期性变化的根本原因。]
2.B [A项应为同周期的ⅠA族元素的金属性比ⅡA族元素的金属性强,但并不是所有ⅠA族元素的金属性都比ⅡA族元素的金属性强;同主族元素自上而下非金属性减弱,气态氢化物的稳定性减弱,而碳是第ⅣA族的第一种元素,故同主族的氢化物中最稳定的是CH4,B项正确;C项中应是最高价氧化物的水化物的酸性从左到右依次增强;D项第三周期中的阳离子半径自左到右逐渐减小,阴离子半径自左到右逐渐减小,但阴离子半径大于阳离子半径,D项错误。]
3.B [由于F无正化合价,而Cl、Br最高正化合价相同,故A、C项错误;B项中Na、Mg、Al的最高正化合价分别为+1、+2、+3,D项Cl、S、P的最高正化合价分别为+7、+6、+5,故B项正确,D项不正确。]
4.D [H3XO4中X的最高正化合价为+5,则其最低负价为-3,故其氢化物的化学式为XH3。]
5.B [同主族元素随原子序数的增大,自上而下元素的金属性增强,非金属性减弱,第ⅡA族元素Mg和Ra,原子序数Mg<Ra,则碱性Ra(OH)2>Mg(OH)2,A项正确;第ⅤA族元素N和As,原子序数N<As,则单质的氧化性N2>As,其对应阴离子的还原性N3-<As3-,B项错误;C项中Cs比Na更易失电子,其与水反应比钠更剧烈,C项正确;Al和Cl同周期,且原子序数Al<Cl,则原子半径Al>Cl,D项正确。]
6.C [由于元素最高价氧化物的水化物酸性:H3XO4<H2YO4<HZO4,且X、Y、Z同周期,故原子序数大小顺序为X<Y<Z,根据元素周期律可知原子半径X>Y>Z,B项错误;非金属性应为X<Y<Z,则气态氢化物的稳定性H3X<H2Y<HZ,A、D均错误;元素的非金属性越强,该元素对应阴离子的还原性越弱,即还原性X3->Y2->Z-,C项正确。]
7.(1)N Si S Ca (2)K F Ar (3)HClO4 KOH Al(OH)3 3HClO4+Al(OH)3===Al(ClO4)3+3H2O HClO4+KOH===KClO4+H2O KOH+Al(OH)3===KAlO2+2H2O (4)F K (5)Na 可以用它们跟水反应的实验证明:钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2 Cl 可用氯气通入溴化钠溶液的实验证明:溶液呈橙红色,发生的反应为Cl2+2NaBr===2NaCl+Br2
解析 根据元素在元素周期表中的位置,可知①~⑫的具体元素,再结合元素周期律:可知最活泼的金属是K,最活泼的非金属是F,最不活泼的是稀有气体元素Ar。在它们的最高价氧化物的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的是Al(OH)3。在比较Na与Mg、Cl2与Br2活泼性差异时,可根据元素金属性、非金属性强弱比较依据设计实验。
8.(1)+5 (2)7 (3)S2->Y-
解析 由离子方程式:YOn-3+3S2-+6H+===Y-+3S↓+3H2O,离子方程式遵守电荷守恒:可知n=1,故YO中Y的化合价为+5,由还原产物Y-可知Y元素原子的最外层电子数是7,结合氧化还原反应中还原剂的还原性大于还原产物的还原性,故可确定S2-与Y-还原性的相对强弱。
9.(1)N2O CO2 N2 CO (2)SO2 O3
解析 (1)仅由第二周期元素组成的共价分子中,即C、N、O、F组成的共价分子,如:N2与CO均为14个电子,N2O与CO2均为22个电子。
(2)依题意,只要原子数相同,各原子最外层电子数之和也相同,可互称等电子体,NO为三原子,各原子最外层电子数之和为(5+6×2+1)。SO2、O3也为三个原子,各原子的最外层电子数之和为6×3=18。
10.(1)Mg H O N Cl (2)Mg3N2+6H2O===3Mg(OH)2+2NH3↑或Mg3N2+8H2O===3Mg(OH)2+2NH3·H2O
化学必修2第二节 元素周期律第4课时课时作业: 这是一份化学必修2第二节 元素周期律第4课时课时作业,共5页。试卷主要包含了原子,元素,元素周期表的结构,元素周,现有下列短周期元素性质的数据等内容,欢迎下载使用。
化学必修2第二节 来自石油和煤的两种基本化工原料第4课时课后测评: 这是一份化学必修2第二节 来自石油和煤的两种基本化工原料第4课时课后测评,共5页。试卷主要包含了原子,元素,元素周期表的结构,元素周,现有下列短周期元素性质的数据等内容,欢迎下载使用。
化学必修2第二节 元素周期律第3课时当堂检测题: 这是一份化学必修2第二节 元素周期律第3课时当堂检测题,共6页。试卷主要包含了元素的金属性和非金属性,元素周期表和元素周期律的应用等内容,欢迎下载使用。