

2021版高考化学鲁科版一轮教师用书:第5章第2节 元素周期律和元素周期表
展开第2节 元素周期律和元素周期表
考纲定位 | 要点网络 |
1.掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 2.以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 3.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。 5.熟悉常见元素的化合价,能根据化合价书写化学式,或根据化学式判断元素化合价。 |
元素周期律及其应用
1.元素周期律
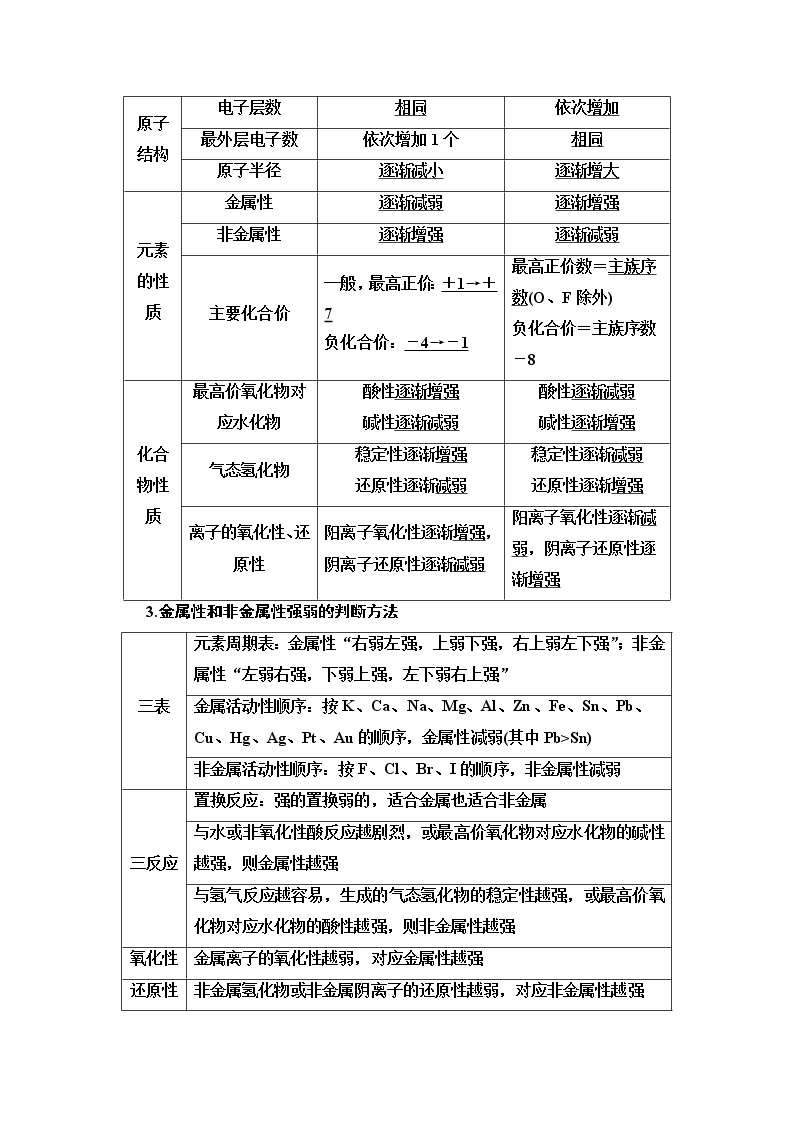
2.主族元素的周期性变化规律
内容 | 同周期(从左到右) | 同主族(从上到下) | |
原子结构 | 电子层数 | 相同 | 依次增加 |
最外层电子数 | 依次增加1个 | 相同 | |
原子半径 | 逐渐减小 | 逐渐增大 | |
元素的性质 | 金属性 | 逐渐减弱 | 逐渐增强 |
非金属性 | 逐渐增强 | 逐渐减弱 | |
主要化合价 | 一般,最高正价:+1→+7 负化合价:-4→-1 | 最高正价数=主族序数(O、F除外) 负化合价=主族序数-8 | |
化合物性质 | 最高价氧化物对应水化物 | 酸性逐渐增强 碱性逐渐减弱 | 酸性逐渐减弱 碱性逐渐增强 |
气态氢化物 | 稳定性逐渐增强 还原性逐渐减弱 | 稳定性逐渐减弱 还原性逐渐增强 | |
离子的氧化性、还原性 | 阳离子氧化性逐渐增强,阴离子还原性逐渐减弱 | 阳离子氧化性逐渐减弱,阴离子还原性逐渐增强 | |
3.金属性和非金属性强弱的判断方法
三表 | 元素周期表:金属性“右弱左强,上弱下强,右上弱左下强”;非金属性“左弱右强,下弱上强,左下弱右上强” |
金属活动性顺序:按K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au的顺序,金属性减弱(其中Pb>Sn) | |
非金属活动性顺序:按F、Cl、Br、I的顺序,非金属性减弱 | |
三反应 | 置换反应:强的置换弱的,适合金属也适合非金属 |
与水或非氧化性酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强 | |
与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越强 | |
氧化性 | 金属离子的氧化性越弱,对应金属性越强 |
还原性 | 非金属氢化物或非金属阴离子的还原性越弱,对应非金属性越强 |
[补短板]
(1)对于主族元素而言,元素的最高正化合价和主族序数相同,但是氧无最高正价,氟无正价,一般为零价或负价。
(2)判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子的多少,如金属性:Na>Al。
(3)根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物对应的水化物,如HClO4>H2SO4。
(4)不能利用氢化物水溶液的酸性确定非金属性强弱。
(5)第2周期的最高价是由+1到+5价,无+6、+7价。
[知识应用]
1.根据元素周期律比较下列各组性质(填“>”或“<”)。
(1)碱性:Mg(OH)2____Ca(OH)2____KOH。
(2)酸性:HClO4____H2SO4____HClO。
(3)热稳定性:CH4____NH3____H2O。
(4)还原性:HBr____HCl____H2S;I-____S2-。
(5)氧化性:Na+____Mg2+____Al3+。
[答案] (1)< < (2)> > (3)< < (4)> < < (5)< <
2.写出氯比硫非金属性强的实验事实有哪些?
[答案] ①Fe与Cl2生成+3价Fe,Fe与S生成+2价Fe。
②Cl2与H2S反应,可生成S。
③稳定性:HCl>H2S。
④还原性:HCl<H2S。
⑤酸性:HClO4>H2SO4等。
◎命题点1 元素周期律及其应用
1.(2019·唐山模拟)部分短周期元素原子半径、最高正化合价或最低负化合价随原子序数的变化关系如图所示,下列说法正确的是( )
A.离子半径的大小顺序:d<e<f
B.与x形成的最简单化合物的沸点:y>z>d
C.除去实验后试管中残留的g的单质,可用热的氢氧化钠溶液
D.g、h的氧化物对应的水化物的酸性:h>g
C [根据题图中元素化合价、原子半径和原子序数的关系可确定x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。核外电子排布相同的离子,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,A项错误;常温下,水为液体,甲烷、氨气均为气体,三者中水的沸点最高,又氨气分子间存在氢键,其沸点高于甲烷,故B项错误;除去实验后试管中残留的单质硫,可用热的NaOH溶液洗涤,反应的化学方程式为3S+6NaOH2Na2S+Na2SO3+3H2O,C项正确;Cl的氧化物对应的水化物的酸性不一定大于S的氧化物对应的水化物的酸性,D项错误。]
2.(2019·昆明模拟)短周期主族元素a、b、c、d原子序数依次增大,a是短周期主族元素中原子半径最小的元素,b是地壳中含量最多的元素,c元素的单质常用作半导体材料,d元素的最高正价与最低负价的代数和为6。下列说法不正确的是( )
A.d单质在常温下是气体
B.原子半径:r(c)>r(d)>r(b)
C.简单氢化物的沸点:d>b
D.最高价氧化物对应水化物的酸性:d>c
C [根据a是短周期主族元素中原子半径最小的元素,可确定a为H;地壳中含量最多的元素为O,则b为O;由c元素的单质常用作半导体材料,可知c为Si;再由d元素的最高正价与最低负价的代数和为6,可确定d为Cl。Cl2在常温下呈气态,A项正确; 原子半径:Si>Cl>O,B项正确;常温下H2O呈液态,HCl呈气态,故氢化物的沸点:H2O>HCl,C项错误;非金属性:Cl>Si,则最高价氧化物对应水化物的酸性:HClO4>H2SiO3,D项正确。]
◎命题点2 元素的金属性和非金属性强弱的实验探究
3.下列实验不能达到实验目的的是( )
选项 | 实验操作 | 实验目的 |
A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
B | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
C | 测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH | 比较碳、硫的非金属性强弱 |
D | Fe、Cu分别与稀盐酸反应 | 比较铁、铜的金属性强弱 |
B [越易与氢气反应,元素非金属性越强,故A正确;MgCl2、AlCl3溶液中分别通入NH3,都生成白色沉淀,故B错误;碳酸钠溶液水解呈碱性说明碳酸是弱酸,硫酸钠溶液呈中性,说明硫酸是强酸,故C正确;铁与稀盐酸反应放出氢气,铜与稀盐酸不反应,故D正确。]
4.某同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强。他设计了如图装置以验证硫、碳、硅元素的非金属性强弱。该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,B是粉末固体,打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出该实验可选用物质的化学式:
A:________;B:________;C:________。
(2)根据所选物质写出烧杯中发生反应的离子方程式:
_____________________________________________________。
[解析] 该同学设计的实验是利用强酸制弱酸的原理。非金属性越强,其最高价氧化物对应水化物的酸性越强。由题意可推测,A为H2SO4,B可以为Na2CO3,C可以为Na2SiO3。
[答案] (1)H2SO4 Na2CO3 Na2SiO3(其他合理答案也可)
(2)CO2+SiO+H2O===H2SiO3↓+CO(或2CO2+SiO+2H2O===H2SiO3↓+2HCO)
◎命题点3 微粒半径比较
5.X、Y、Z是3种主族元素,如果Xn+阳离子与Yn-阴离子具有相同的电子层结构,Zn-阴离子半径大于Yn-阴离子半径,则3种元素的原子序数由大到小的顺序是 ( )
A.Z>X>Y B.X>Y>Z
C.Z>Y>X D.X>Z>Y
A [根据题意知X、Y、Z相对位置可能为。]
6.比较下列微粒半径的大小,用“>”或“<”填空。
(1)Na________Mg________Cl。
(2)H+________H________H-________Li+。
(3)O2-________F-________Mg2+________Al3+。
(4)Fe________Fe2+________Fe3+。
(5)Cl-________O2-________S2-。
(6)P________O________F。
[答案] (1)> > (2)< < > (3)> > > (4)> > (5)> < (6)> >
微粒半径大小比较的一般思维流程
(1)①同周期原子半径或同性离子半径从左到右均减小
如:r(S)>r(Cl)、r(S2-)>r(Cl-)。
②同主族原子半径或离子半径从上到下均增大
如:r(Na)<r(K)、r(Na+)<r(K+)。
(2)同元素微粒:核外电子数越多,半径越大,如:r(Fe)>r(Fe2+)>r(Fe3+)、r(Cl)<r(Cl-)。
(3)同电子数微粒:核电荷数越大,半径越小,如:r(Na+)>r(Mg2+)>r(Al3+)、r(H-)>r(Li+)。
(4)核电荷数、电子层数、电子数均不同的微粒:可用参照法。如:r(K+)与r(Mg2+)比较时可参照r(K+)>r(Na+)>r(Mg2+)来确定r(K+)>r(Mg2+)。
元素周期表的结构及其应用
1.原子序数:按照元素在周期表中的顺序给元素所编的序号。原子序数=核电荷数=核外电子数=质子数。
2.元素周期表的编排原则
—
—
3.元素周期表的结构
注意:熟记每周期的元素种类,各族的相对位置、金属与非金属的区域。
(1)元素周期表中的特殊元素位置
①过渡元素:元素周期表中从ⅢB族到ⅡB族10个纵列共60多种元素,这些元素都是金属元素。
②镧系:元素周期表第6周期中,57号元素镧到71号元素镥共15种元素。
③锕系:元素周期表第7周期中,89号元素锕到103号元素铹共15种元素。
④超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
⑤碱金属元素[ⅠA(氢除外)],卤族元素(ⅦA),氧族元素(ⅥA),氮族元素(ⅤA),碳族元素(ⅣA)。
(2)分区
①分界线:沿着元素周期表中硼、硅、砷、碲、砹与铝、锗、锑、钋的交界处画一条虚线,即为非金属元素区和金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
4.元素周期表的三大应用
(1)科学预测:为新元素的发现及预测他们的原子结构和性质提供了线索。
(2)寻找新材料
(3)用于工农业生产
探矿(地球化学元素的分布与它们在元素周期表中的位置关系对其有指导意义)、研制农药材料等。
[基础判断]
(1)原子的电子层数一定等于周期数,原子的最外层电子数一定等于族序数。 ( )
(2)ⅠA族全是碱金属,ⅦA族全是非金属。 ( )
(3)元素周期表中的每一格均表示一种元素。 ( )
(4)原子的最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族元素或0族元素氦。 ( )
(5)同一周期,ⅡA族与ⅢA族的原子序数差一定1。 ( )
(6)原子及离子的核外电子层数等于该元素所在的周期数。 ( )
(7) 均表示了元素在元素周期表中的相应位置。 ( )
[答案] (1)× (2)× (3)× (4)√ (5)× (6)× (7)×
[知识应用]
如图为元素周期表中五种元素的相对位置:若B的原子序数为a,则这5种元素的核电荷数之和可能为________。
[答案] 5a或5a+10或5a+14
◎命题点1 元素周期表的结构与位置推导
1.国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv。下列有关这两种元素的说法错误的是( )
A.两种元素位于同一周期
B.116号元素位于第ⅥA族
C.两种元素都是活泼的非金属元素
D.114号元素的原子半径比116号元素的原子半径大
C [第114号元素和第116号元素分别处于第7周期ⅣA族和ⅥA族,均为金属元素,A、B正确,C错误;依据同周期原子半径递变规律判断114号元素的原子半径比116号元素的原子半径大,D正确。]
2.根据中学化学教材中所附元素周期表判断,下列叙述不正确的是( )
A.两短周期元素原子序数相差8,则周期数一定相差1
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.所有主族元素的最高化合价与它的族序数数值相等
D.某元素原子的核电荷数为53,则该元素位于第5周期第ⅦA族
[答案] C
3.结合如图所示元素周期表,回答下列问题:
(1)表中所列元素,属于长周期元素的有________(填字母,下同),属于主族元素的有________;g元素位于第________周期________族;i元素位于第________周期________族。
(2)f元素位于第________周期________族。
[答案] (1)h、i abcdef 3 零 4 ⅡB (2)3 ⅥA
元素位置的确定方法
(1)“0族”法确定元素位置
①熟记0族元素的相应周期数和原子序数
元素符号 | He | Ne | Ar | Kr | Xe | Rn |
原子序数 | 2 | 10 | 18 | 36 | 54 | 86 |
周期数 | 1 | 2 | 3 | 4 | 5 | 6 |
②确定主族元素在周期表中位置的方法:原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
(2)奇偶关系
①原子序数是奇数的主族元素,其所在主族序数必为奇数。
②原子序数是偶数的主族元素,其所在主族序数必为偶数。
◎命题点2 元素周期表原子序数的定量关系
4.下列各图为元素周期表的一部分,表中的数字为原子序数,其中M为37的是( )
A B C D
[答案] C
5.元素周期表中的前4周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a。下列说法正确的是( )
A.B、D的原子序数之差可能为2
B.E、B的原子序数之差可能是8、18或32
C.D、E的原子序数之和为2a+10
D.A、E的原子序数之差可能是7
C [由题中所给5种元素的位置关系可以看出D一定不是第1周期元素(因为如果D是第1周期元素,则D一定属于元素周期表最左边的第ⅠA族元素或最右边的0族元素),所以A选项错误;由题意可知5种元素在前4周期,所以D、B、E分别为第2、3、4周期的元素,由元素周期表的结构可知5种元素一定在过渡元素右边,所以D、E的原子序数分别为a-8、a+18,C项正确。]
6.X、Y为短周期元素,可形成化合物XY3,则X、Y的原子序数之差可能为______________________。
[解析] XY3化合物可能为BF3(4),BCl3(12),AlF3(4),AlCl3(4),SO3(8),NH3(6),PH3(14),NCl3(10),PCl3(2),NF3(2),PF3(6)等。
[答案] 2、4、6、8、10、12、14
元素周期表中原子序数的定量关系
(1)同主族、邻周期元素的原子序数之差
①元素周期表中左侧元素(ⅠA、ⅡA族):
同主族相邻两元素中,R(下)=R(上)+上一周期元素所在周期的元素种类数目;
②元素周期表中右侧元素(ⅢA~ⅦA族):
同主族相邻两元素中,R(下)=R(上)+下一周期元素所在周期的元素种类数目。
(2)同周期的ⅡA和ⅢA的原子序数差可能为1、11、25。
“位—构—性”的关系应用
——证据推理与微观探析
分析近三年高考试题,“位—构—性”的关系考查是每年命题的热点,题型以选择题呈现。命题的角度主要涉及以元素推断为前提的原子结构、分子结构、化学键、性质比较等。充分体现了化学的“结构决定性质,性质反映结构”的“证据推理与微观探析”的核心素养。
1.元素的“位—构—性”三者关系
2.“位”“构”“性”关系的应用
(1)结构与位置互推
①若一种阳离子与一种阴离子电子层数相同,则“阴前阳后”,阴离子在前一周期,阳离子在后一周期,阳离子的原子序数大。
②同周期元素的简单阳离子与阴离子相比,阴离子原子序数大。
③在短周期元素中,元素的原子序数与其主要化合价的数值在奇偶性上一般一致,“价奇序奇,价偶序偶”。
(2)性质与位置互推
熟悉元素周期表中同周期、同主族元素性质的递变规律,根据元素性质可以推知元素在周期表中的位置,根据元素在周期表中的位置可以推知元素性质。
(3)结构与性质互推
①最外层电子数是决定元素原子的氧化性和还原性的主要原因。
②原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
③同主族元素最外层电子数相同,化学性质相似。
[典例导航]
(2019·全国卷Ⅱ)今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
[思路点拨]
第一步:审信息——定元素
第二步:析选项——定答题
A项,同周期:r(X)>r(Z),同主族:r(Z)>r(W),故r(X)>r(W),正确;B项,Y为Si,为固态,正确;C项,非金属性Z<W,氢化物稳定性:Z<W,正确;D项,Al(OH)3是弱碱,错误。
[答案] D
1.(2019·菏泽一模)Q、X、Y、Z是原子序数依次增大的短周期主族元素,Q原子的最外层电子数是内层电子数的2倍,X、Y、Z在周期表中的位置关系如图所示。下列说法正确的是( )
A.Q和Z可能形成化合物QZ2
B.Y的最高价氧化物的水化物一定是强酸
C.X、Z和氢三种元素不可能组成离子化合物
D.最简单气态氢化物的沸点:Q>X
A [Q原子的最外层电子数是内层电子数的2倍,则Q为C;再根据Q、X、Y、Z是原子序数依次增大的短周期主族元素,以及X、Y、Z在周期表中的位置关系可推知X可能为N或O,Y可能为P或S,Z可能为S或Cl。]
2.(2019·茂名一模)短周期元素W、X、Y、Z的原子序数依次递增,其原子最外层电子数之和为18。W和X位于相邻周期,Y的最外层电子数是电子层数的2倍,W的一种同位素广泛应用于考古测定文物年代,Y的一种氧化物和Z的单质在水溶液中均具有漂白性,下列叙述正确的是( )
A.最高正价:W<X
B.Z和W、Z和X均能形成离子化合物
C.原子半径的大小顺序:r(Z)>r(X)>r(Y)
D.最高价氧化物对应水化物的酸性:Z>Y
D [W的一种同位素广泛应用于考古测定文物年代,W为碳元素;Y的一种氧化物和Z的单质在水溶液中均具有漂白性,Y为硫元素,Z为氯元素;短周期元素W、X、Y、Z的原子序数依次递增,其原子最外层电子数之和为18,X最外层电子数为18-4-6-7=1,X为钠元素。]
3.(2019·开封一模)X、Y、Z、M、W为5种短周期主族元素且原子序数依次增大。X有三种核素,质量数之比为1∶2∶3,Y是植物生长所需的三大营养元素之一,Z和M同主族。下列说法正确的是( )
A.单质沸点:Y>W>M
B.原子半径:X<Y<Z<M
C.X、Y、Z三种元素形成的一种化合物乙可能含有离子键
D.X与Y、M、W形成的最简单化合物中,等物质的量浓度水溶液的pH:W>M>Y
C [X、Y、Z、M、W为5种短周期主族元素且原子序数依次增大。X有三种核素,质量数之比为1∶2∶3,则X为氢元素;Y是植物生长所需的三大营养元素之一,则Y为氮元素;Z和M同主族,Z只能为第2周期元素,若Z为氧元素,则M为硫元素,W为氯元素;若Z为氟元素,则M为氯元素,W只能为氩元素,但Ar不是主族元素,所以Z为氧元素,则M为硫元素,W为氯元素。]
1.(2019·全国卷Ⅰ)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列叙述正确的是( )
A.WZ的水溶液呈碱性
B.元素非金属性的顺序为X>Y>Z
C.Y的最高价氧化物的水化物是中强酸
D.该新化合物中Y不满足8电子稳定结构
C [W、X、Y、Z为同一短周期元素,可能同处于第2或第3周期,观察新化合物的结构示意图可知,X为四价,X可能为C或Si。若X为C,则Z核外最外层电子数为C原子核外电子数的一半,即为3,对应B元素,不符合成键要求,不符合题意,故X为Si,W能形成+1价阳离子,可推出W为Na元素,Z核外最外层电子数为Si原子核外电子数的一半,即为7,可推出Z为Cl元素。Y能与2个Si原子形成共价键,另外得到1个电子达到8电子稳定结构,说明Y原子最外层有5个电子,进一步推出Y为P元素,即W、X、Y、Z分别为Na、Si、P、Cl元素。A项,WZ为NaCl,其水溶液呈中性,错误;B项,元素非金属性:Cl>P>Si,错误;C项,P的最高价氧化物的水化物为H3PO4,是中强酸,正确;D项,P原子最外层有5个电子,与2个Si原子形成共价键,另外得到1个电子,在该化合物中P元素满足8电子稳定结构,错误。]
2.(2019·全国卷Ⅲ)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.熔点:X的氧化物比Y的氧化物高
B.热稳定性:X的氢化物大于Z的氢化物
C.X与Z可形成离子化合物ZX
D.Y的单质与Z的单质均能溶于浓硝酸
B [X、Y、Z均为短周期主族元素,X与Z同族,Y最外层电子数等于X次外层电子数,Y的最外层电子数不可能是8,只能为2,且Y原子半径大于Z,所以Y为Mg,X、Y、Z原子的最外层电子数之和为10,故X为C,Z为Si。
A项,MgO的熔点高于CO2、CO的熔点,错误;B项,元素的非金属性越强,则其气态氢化物的热稳定性越强,C的非金属性强于Si,故CH4的热稳定性大于SiH4,正确;C项,X与Z形成的SiC是共价化合物,错误;D项,Mg能溶于浓硝酸,但是Si单质不能溶于浓硝酸,错误。]
3.(2018·全国卷Ⅰ)主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是( )
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
B [可腐蚀玻璃的物质是HF。根据题意可推知,W是氟、X是钠、Y是氯、Z是钙。常温常压下Na是固态,A项错误;CaH2是离子化合物,B项正确;CaCl2是强酸强碱盐,水溶液呈中性,C项错误;氯有最高化合价为+7,氟无正价,D项错误。]
4.(2017·全国卷Ⅱ)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A.原子半径:d>c>b>a
B.4种元素中b的金属性最强
C.c的氧化物的水化物是强碱
D.d单质的氧化性比a单质的氧化性强
B [a原子核外电子总数与b原子次外层的电子数相同,b原子次外层的电子数为2或8,若b原子次外层的电子数为2,则a为He,不是主族元素,不符合题意;若b原子次外层的电子数为8,则b为第3周期元素,a为O;d与a同族,则d为S; c所在周期数与族数相同,则c为Al,b为Na或Mg。
A错:原子半径:a<d<c<b。
C错:c的氧化物的水化物是Al(OH)3,属于两性氢氧化物,不是强碱。
D错:a、d同主族,同主族元素从上到下原子半径逐渐增大,失电子能力逐渐增强,氧化性逐渐减弱。]
5.(2017·全国卷Ⅰ)短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是( )
A.X的简单氢化物的热稳定性比W的强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
C [四种主族元素都在短周期,W的简单氢化物可用作制冷剂,则W为N元素。Y的原子半径是所有短周期主族元素中最大的,则Y为Na元素。一种盐与稀盐酸反应既有黄色沉淀生成也有刺激性气体产生,则该盐为硫代硫酸钠,X为O元素,Z为S元素。
A对:非金属性O强于N,所以水的热稳定性强于氨气。
B对:Y的简单离子为Na+,X的简单离子为O2-,Na+与O2-具有相同的电子层结构。
C错:硫化钠溶液水解显碱性,不能使蓝色石蕊试纸变红。
D对:O元素与S元素属于同一主族(第ⅥA族),S元素与Na元素都在第3周期。]








