

高中人教版 (新课标)第二节 几种重要的金属化合物教案
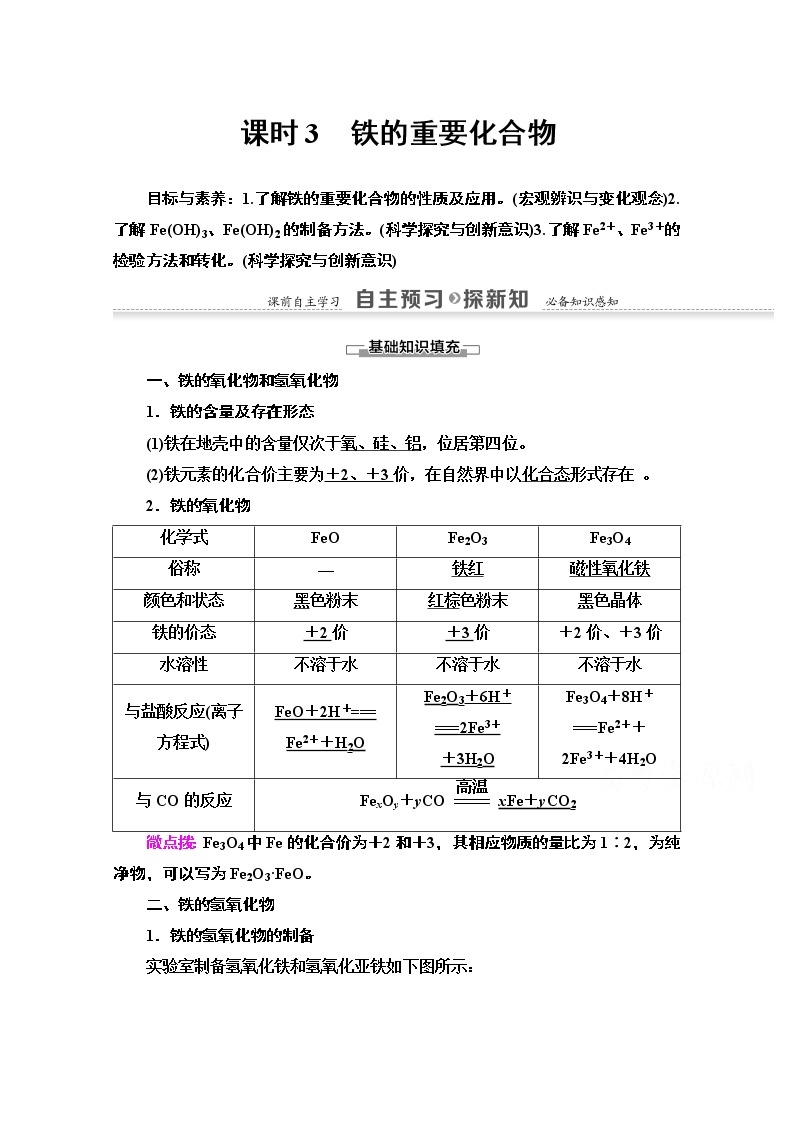
展开课时3 铁的重要化合物
目标与素养:1.了解铁的重要化合物的性质及应用。(宏观辨识与变化观念)2.了解Fe(OH)3、Fe(OH)2的制备方法。(科学探究与创新意识)3.了解Fe2+、Fe3+的检验方法和转化。(科学探究与创新意识)
一、铁的氧化物和氢氧化物
1.铁的含量及存在形态
(1)铁在地壳中的含量仅次于氧、硅、铝,位居第四位。
(2)铁元素的化合价主要为+2、+3价,在自然界中以化合态形式存在 。
2.铁的氧化物
化学式 | FeO | Fe2O3 | Fe3O4 |
俗称 | — | 铁红 | 磁性氧化铁 |
颜色和状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
铁的价态 | +2价 | +3价 | +2价、+3价 |
水溶性 | 不溶于水 | 不溶于水 | 不溶于水 |
与盐酸反应(离子方程式) | FeO+2H+=== Fe2++H2O | Fe2O3+6H+ ===2Fe3+ +3H2O | Fe3O4+8H+ ===Fe2++ 2Fe3++4H2O |
与CO的反应 | FexOy+yCOxFe+yCO2 | ||
微点拨:Fe3O4中Fe的化合价为+2和+3,其相应物质的量比为1∶2,为纯净物,可以写为Fe2O3·FeO。
二、铁的氢氧化物
1.铁的氢氧化物的制备
实验室制备氢氧化铁和氢氧化亚铁如下图所示:
图甲 图乙
(1)图甲实验中观察到的现象是生成红褐色沉淀。反应的离子方程式是Fe3++3OH-===Fe(OH)3↓。
(2)图乙实验中先观察到有白色沉淀生成,迅速变成灰绿色,最后变成红褐色,反应的方程式是
①Fe2++2OH-===Fe(OH)2↓;
②4Fe(OH)2+O2+2H2O===4Fe(OH)3。
2.铁的氢氧化物的性质
(1)氢氧化铁和氢氧化亚铁都是不溶性碱,都能与酸反应生成盐和水。写出它们分别与盐酸反应的离子方程式:
①Fe(OH)3+3H+===Fe3++3H2O;
②Fe(OH)2+2H+===Fe2++2H2O。
(2)不稳定,受热易分解,其化学方程式分别为
①Fe(OH)3:2Fe(OH)3Fe2O3+3H2O;
②Fe(OH)2(隔绝空气):Fe(OH)2FeO+H2O。
三、铁盐与亚铁盐
1.Fe2+、Fe3+的检验方法
(1)观察法:浅绿色溶液中含有Fe2+;棕黄色溶液中含有Fe3+。
(2)加碱法:产生的白色沉淀迅速变为灰绿色,最后变为红褐色的为Fe2+;直接产生红褐色沉淀的为Fe3+。
(3)加KSCN:无明显现象,再加新制氯水溶液变红色的为Fe2+;溶液直接变红色的为Fe3+。
2.Fe2+与Fe3+的转化
(1)在盛有氯化铁溶液的试管中加适量铁粉振荡后,溶液变成浅绿色,再加KSCN溶液,溶液不变色,再加入氯水后,溶液变成红色。
(2)Fe3+与Cu反应生成Fe2+的离子方程式为2Fe3++Cu===2Fe2++Cu2+。
3.铁盐的净水作用
铁盐在天然水中可生成Fe(OH)3胶体,和水中的悬浮物形成絮状不溶物沉降下来。
铜盐
(1)物理性质
硫酸铜、氯化铜、硝酸铜等铜盐易溶于水;铜绿的主要成分是Cu2(OH)2CO3,是铜锈的主要成分,其难溶于水。
(2)化学性质
①铜的化学性质稳定,使用铜器皿比较安全。
②铜盐属于重金属盐,都有毒,原因是铜离子能与蛋白质作用,使蛋白质变性而失去生理活性。
③铜及其化合物的颜色
a.Cu:紫红色;b.CuO:黑色;c.Cu(OH)2:蓝色;d.CuSO4:白色;e.CuSO4·5H2O:蓝色。
注:Cu不能与一般酸反应生成H2;CuSO4粉末遇水变蓝,可用于检验水的存在。
1.判断正误(正确的打“√”,错误的打“×”)
(1)Fe3O4中的Fe的化合价有+2和+3价,故Fe3O4为混合物。
( )
(2)Fe(OH)2在空气中易转化为Fe(OH)3,说明Fe(OH)2易被还原。
( )
(3)Cu与Fe3+的反应为置换反应。 ( )
(4)FeCl3与Fe的反应体现了Fe3+的氧化性。 ( )
[答案] (1)× (2)× (3)× (4)√
2.下列关于Fe2+和Fe3+的叙述中,错误的是( )
A.Fe2+的水溶液为浅绿色
B.Fe3+的水溶液为棕黄色
C.Fe2+具有还原性和氧化性
D.向含Fe3+溶液中滴入含SCN-的溶液,立即出现红色沉淀
[答案] D
3.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为 、 、 ,检验溶液中Fe3+存在的试剂是 。
(2)写出FeCl3溶液与金属铜发生反应的化学方程式 ,
当转移电子数为6.02×1024时,被氧化的物质的质量为 。
[答案] (1)FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O 2Fe2++Cl2===2Fe3++2Cl- KSCN溶液 (2)2FeCl3+Cu===2FeCl2+CuCl2 320 g
Fe(OH)2的制备实验探究 |
1.试剂:FeSO4与NaOH溶液。
2.原理:Fe2++2OH-===Fe(OH)2↓。
3.实验注意事项
Fe(OH)2具有较强还原性,在空气中易被O2氧化,故制备Fe(OH)2时注意避免与O2的接触。
4.制备Fe(OH)2的注意事项
(1)Fe2+必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。
(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。
(3)长胶头滴管末端插入试管内的液面以下。
(4)在FeSO4溶液液面上加植物油或苯进行液封。
(5)在容器内充满H2等气体,保证无O2环境。如图。
1.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是( )
A.①② B.①③
C.②③ D.①②③
B [因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③中液面上加苯阻止了空气进入;②由于能接触到空气中的O2,故不能较长时间观察到白色沉淀。]
Fe2+、Fe3+的检验与转化关系 |
1.Fe2+与Fe3+的检验方法
(1)Fe3+的检验方法
(2)Fe2+的检验方法
2.“铁三角”转化关系
(1)
(2)
(3)
3.含铁物质的分离与除杂
主要物质 | 杂质 | 除杂方法 |
Fe2+ | Fe3+ | 加过量铁粉后过滤 |
FeCl3 | FeCl2 | 加氯水或通入Cl2 |
Fe2+ | Cu2+ | 加过量铁粉后过滤 |
Fe | Al | 加NaOH溶液后过滤 |
Fe2O3 | Al2O3 | 加NaOH溶液后过滤 |
2.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,只用一种试剂就可以把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液
C.氨水 D.KSCN溶液
B [NaOH与上述五种溶液混合时,其中NaCl无明显现象,在FeCl2中先出现白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;而FeCl3中只出现红褐色沉淀现象;在MgCl2中只出现白色沉淀现象,而AlCl3中先出现白色沉淀,后沉淀消失。]
3.将单质Fe、Cu与FeCl3、FeCl2、CuCl2溶液一起放进某容器内,根据下述不同情况,填写金属或金属离子。
(1)充分反应后,如果Fe有剩余,则容器内不可能有 。
(2)充分反应后,如果容器内还有大量Fe3+,则还含有 ,一定没有 。
(3)充分反应后,如果容器内有较多Cu2+和相当量的Cu,则容器内不可能有 。
[答案] (1)Fe3+、Cu2+ (2)Cu2+、Fe2+ Fe、Cu
(3)Fe、Fe3+
1金属阳离子被还原不一定得到金属单质,如Fe3+被还原时可能得到的是Fe2+。
2虽然Fe2+既有氧化性又有还原性,但以还原性为主。
3不同价态铁元素间的转化属于氧化还原反应,在选择氧化剂时可以根据如下规律判断:需要失去2个电子,而只需失去1个电子,但前者比后者要容易得多,因此需弱的氧化剂即可,而则需要强氧化剂才能实现。
4检验Fe3+溶液中是否含Fe2+时不能选用KSCN溶液和氯水。
1.下列有关说法不正确的是( )
A.Fe3O4为磁性氧化铁,不属于碱性氧化物
B.FeO、Fe2O3均为碱性氧化物,均与盐酸反应
C.Fe(OH)2不稳定,具有较强的氧化性
D.Fe(OH)3比Fe(OH)2稳定
C [Fe(OH)2具有较强的还原性,易被氧化。]
2.某溶液中可能存在Mg2+、Fe2+、Fe3+,加入NaOH溶液,开始时有白色絮状沉淀生成,白色沉淀迅速变成灰绿色,最后变成红褐色,下列结论正确的是( )
A.一定有Fe2+,一定没有Fe3+、Mg2+
B.一定有Fe3+,一定没有Fe2+、Mg2+
C.一定有Fe3+,可能有Fe2+,一定没有Mg2+
D.一定有Fe2+,可能有Mg2+,一定没有Fe3+
[答案] D
3.向某晶体的水溶液中加入含有Fe2+的溶液后,无明显变化,当滴入几滴新制的氯水后,溶液显红色,由此得出的下列结论,错误的是 ( )
A.该晶体中一定含有SCN-
B.Fe3+的氧化性比Cl2的氧化性强
C.Fe2+被Cl2氧化为Fe3+
D.Fe2+与SCN-不能形成红色物质
B [Fe2+与氯水中的Cl2发生反应:2Fe2++Cl2===2Fe3++2Cl-,氧化性:Cl2>Fe3+。因SCN-与Fe3+反应生成红色物质,故原溶液中一定含有SCN-。]
4.欲除去FeSO4溶液中含有的CuSO4和Fe2(SO4)3等少量杂质,应选用的试剂是( )
A.氨水 B.铝粉
C.铁粉 D.NaOH溶液
C [加入铁粉后,Cu2++Fe===Cu+Fe2+,2Fe3++Fe===3Fe2+,然后将过量的铁粉及Cu过滤即可。]
5.已知有以下物质的相互转化:
试回答:
(1)B的化学式为 ;D的化学式为 。
(2)写出由E转变成F的化学方程式: 。
(3)常用 (填试剂名称)检验G中的阳离子,其现象为 。
(4)向G溶液中加入A的有关反应的离子方程式为
。
[答案] (1)FeCl2 KCl (2)4Fe(OH)2+2H2O+O2===4Fe(OH)3 (3)KSCN溶液 棕黄色溶液变为红色溶液 (4)2Fe3++Fe===3Fe2+
高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试教学设计: 这是一份高中化学人教版 (新课标)必修1第三章 金属及其化合物综合与测试教学设计,共4页。
高中化学人教版 (新课标)必修1第三章 金属及其化合物第二节 几种重要的金属化合物教案及反思: 这是一份高中化学人教版 (新课标)必修1第三章 金属及其化合物第二节 几种重要的金属化合物教案及反思,共11页。
人教版 (新课标)必修1第二节 几种重要的金属化合物教学设计及反思: 这是一份人教版 (新课标)必修1第二节 几种重要的金属化合物教学设计及反思,共11页。