
高中化学鲁科版选修4 化学反应原理第1节 水溶液第2课时教案设计
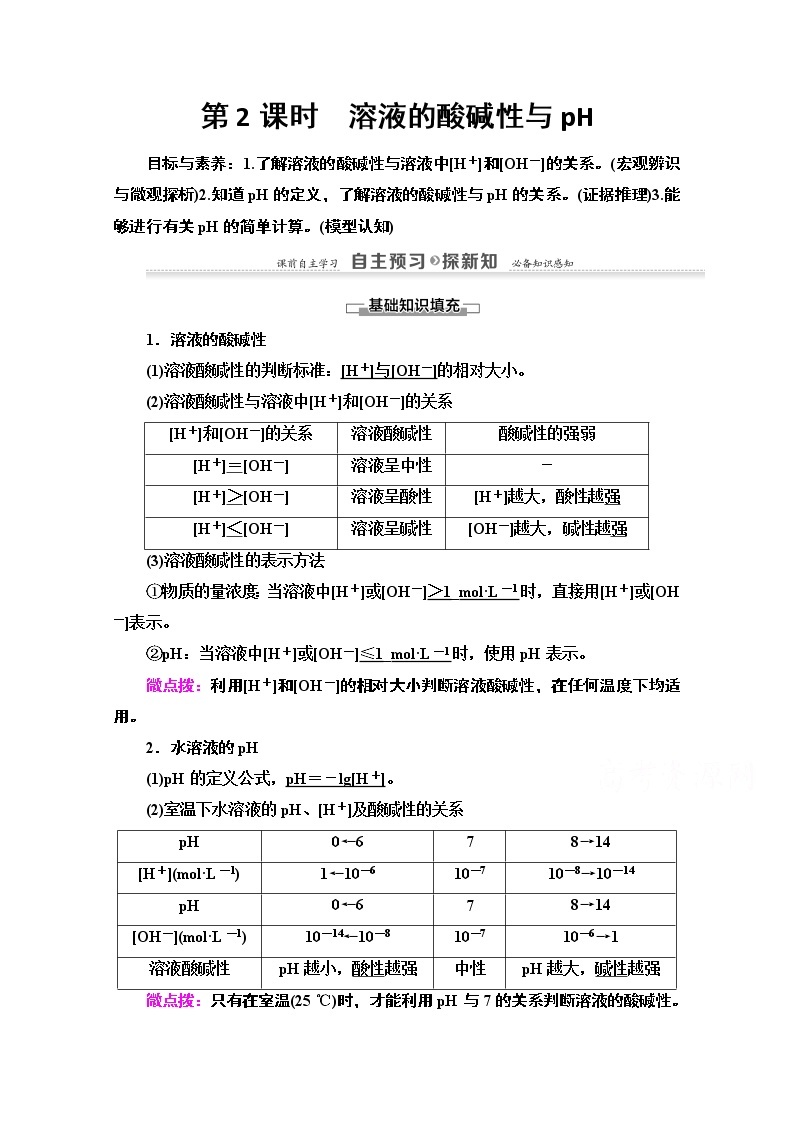
展开第2课时 溶液的酸碱性与pH
目标与素养:1.了解溶液的酸碱性与溶液中[H+]和[OH-]的关系。(宏观辨识与微观探析)2.知道pH的定义,了解溶液的酸碱性与pH的关系。(证据推理)3.能够进行有关pH的简单计算。(模型认知)
1.溶液的酸碱性
(1)溶液酸碱性的判断标准:[H+]与[OH-]的相对大小。
(2)溶液酸碱性与溶液中[H+]和[OH-]的关系
[H+]和[OH-]的关系 | 溶液酸碱性 | 酸碱性的强弱 |
[H+]=[OH-] | 溶液呈中性 | - |
[H+]>[OH-] | 溶液呈酸性 | [H+]越大,酸性越强 |
[H+]<[OH-] | 溶液呈碱性 | [OH-]越大,碱性越强 |
(3)溶液酸碱性的表示方法
①物质的量浓度:当溶液中[H+]或[OH-]>1_mol·L-1时,直接用[H+]或[OH-]表示。
②pH:当溶液中[H+]或[OH-]≤1_mol·L-1时,使用pH表示。
微点拨:利用[H+]和[OH-]的相对大小判断溶液酸碱性,在任何温度下均适用。
2.水溶液的pH
(1)pH的定义公式,pH=-lg[H+]。
(2)室温下水溶液的pH、[H+]及酸碱性的关系
pH | 0←6 | 7 | 8→14 |
[H+](mol·L-1) | 1←10-6 | 10-7 | 10-8→10-14 |
pH | 0←6 | 7 | 8→14 |
[OH-](mol·L-1) | 10-14←10-8 | 10-7 | 10-6→1 |
溶液酸碱性 | pH越小,酸性越强 | 中性 | pH越大,碱性越强 |
微点拨:只有在室温(25 ℃)时,才能利用pH与7的关系判断溶液的酸碱性。
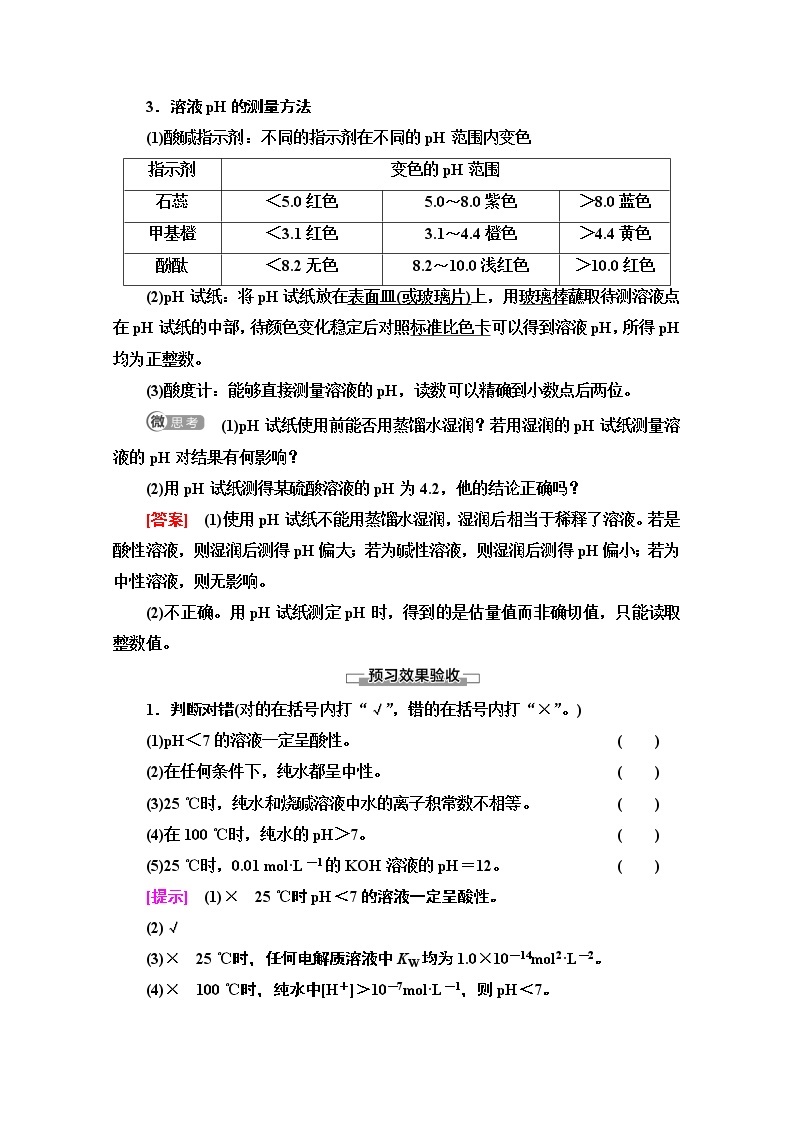
3.溶液pH的测量方法
(1)酸碱指示剂:不同的指示剂在不同的pH范围内变色
指示剂 | 变色的pH范围 | ||
石蕊 | <5.0红色 | 5.0~8.0紫色 | >8.0蓝色 |
甲基橙 | <3.1红色 | 3.1~4.4橙色 | >4.4黄色 |
酚酞 | <8.2无色 | 8.2~10.0浅红色 | >10.0红色 |
(2)pH试纸:将pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取待测溶液点在pH试纸的中部,待颜色变化稳定后对照标准比色卡可以得到溶液pH,所得pH均为正整数。
(3)酸度计:能够直接测量溶液的pH,读数可以精确到小数点后两位。
(1)pH试纸使用前能否用蒸馏水湿润?若用湿润的pH试纸测量溶液的pH对结果有何影响?
(2)用pH试纸测得某硫酸溶液的pH为4.2,他的结论正确吗?
[答案] (1)使用pH试纸不能用蒸馏水湿润,湿润后相当于稀释了溶液。若是酸性溶液,则湿润后测得pH偏大;若为碱性溶液,则湿润后测得pH偏小;若为中性溶液,则无影响。
(2)不正确。用pH试纸测定pH时,得到的是估量值而非确切值,只能读取整数值。
1.判断对错(对的在括号内打“√”,错的在括号内打“×”。)
(1)pH<7的溶液一定呈酸性。 ( )
(2)在任何条件下,纯水都呈中性。 ( )
(3)25 ℃时,纯水和烧碱溶液中水的离子积常数不相等。 ( )
(4)在100 ℃时,纯水的pH>7。 ( )
(5)25 ℃时,0.01 mol·L-1的KOH溶液的pH=12。 ( )
[提示] (1)× 25 ℃时pH<7的溶液一定呈酸性。
(2)√
(3)× 25 ℃时,任何电解质溶液中KW均为1.0×10-14mol2·L-2。
(4)× 100 ℃时,纯水中[H+]>10-7mol·L-1,则pH<7。
(5)√
2.将25 ℃时下列对应内容用短线连接。
[提示]
3.常温下,柠檬水溶液的pH是3,其中的[OH-]是( )
A.0.1 mol·L-1 B.1×10-3 mol·L-1
C.1×10-7 mol·L-1 D.1×10-11 mol·L-1
D [pH=-lg[H+] [H+]=10-pH,pH=3[H+]=10-3 mol·L-1,[OH-]==1×10-11 mol·L-1。]
溶液酸碱性的判断依据 |
相关说明:溶液中[H+]越小,[OH-]越大,溶液的碱性越强,pH越大;溶液中[H+]越大,[OH-]越小,溶液的酸性越强,pH越小。
宏观辨识与微观探析:溶液的酸碱性与离子浓度的关系
(1)pH=7的溶液不一定是中性溶液,在室温下,pH=7的溶液是中性溶液,在其他温度下不是中性溶液。
(2)纯水中[H+]=[OH-],在水溶液中[H+]和[OH-]不一定相等,但[H+][OH-]一定等于KW。
(3)pH每增大1个单位,[H+]减小到原来的,[OH-]增大为原来的10倍。
(4)一定温度下溶液中[H+][OH-]为定值,若一种离子浓度增大(或减小),另一种离子浓度定会减小(或增大)。
【例1】 某温度时水的离子积为1×10-12 mol2·L-2,若该温度下某溶液中[H+]=1×10-7 mol·L-1,则该溶液( )
A.呈碱性 B.呈酸性
C.呈中性 D.[OH-]=10[H+]
A [溶液中[OH-]==1×10-5 mol·L-1,[OH-]>[H+],溶液呈碱性。]
1.下列溶液肯定是酸性的是( )
A.含H+的溶液 B.能使酚酞显无色的溶液
C.pH<7的溶液 D.[OH-]<[H+]的溶液
D [溶液中[H+]>[OH-]时,溶液呈酸性。]
2.25 ℃的下列溶液中碱性最强的是( )
A.pH=11的溶液
B.[OH-]=0.12 mol·L-1的溶液
C.1 L中含有4 g NaOH的溶液
D.[H+]=1×10-10 mol·L-1的溶液
B [溶液的碱性最强,则该溶液中[OH-]最大。A项,[OH-]=10-3 mol·L-1;C项,[OH-]==0.1 mol·L-1;D项,[OH-]==10-4 mol·L-1。]
三种类型溶液pH计算的思维模式 |
1.单一溶液
(1)强酸:[H+]―→pH=-lg[H+]。
(2)强碱:[OH-]―→[H+]()―→pH。
2.强酸、强碱的稀释
(1)强酸pH=a,加水稀释10n倍,则pH=a+n,无限稀释,pH约等于7。
(2)强碱pH=b,加水稀释10n倍,则pH=b-n,无限稀释,pH约等于7。
3.溶液的混合
(1)混合液呈酸性:[H+]―→pH。
(2)混合液呈碱性:[OH-]―→[H+]―→pH。
【例2】 已知某温度下纯水的pH=6。
(1)pH=7的溶液呈________(填“酸性”“中性”或“碱性”)。
(2)该温度下0.1 mol·L-1的盐酸溶液的pH=________。
(3)该温度下0.05 mol·L-1的Ba(OH)2溶液的pH=________。
(4)该温度下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。
[解析] 该温度下,KW=[H+][OH-]=10-12 mol2·L-2。(1)pH=7时,[H+]=10-7 mol·L-1,[OH-]=10-5 mol·L-1,[H+]<[OH-]溶液呈碱性。(2)pH=-lg[H+]=-lg0.1=1。(3)[H+]==10-11 mol·L-1,pH=11。(4)反应后酸剩余,则[H+]==10-2 mol·L-1,V1∶V2=9∶11。
[答案] (1)碱性 (2)1 (3)11 (4)9∶11
计算溶液pH时注意的几个问题
(1)外界条件是否为25 ℃。
(2)水电离出来的[H+]何时忽略不计,何时不能忽略。
(3)两种pH不同的碱溶液混合时,由于两碱溶液中水的电离程度不同,所以混合后溶液中水的电离平衡必发生移动,因此不可将两溶液中的H+的物质的量相加得混合溶液中的H+的物质的量。
1.常温下,将0.1 mol·L-1NaOH溶液与0.04 mol·L-1 H2SO4溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0
C.12 D.12.4
C [NaOH过量,过量的[OH-]=
=0.01 mol·L-1,故pH=12。]
2. (1)常温下0.01 mol·L-1HCl溶液:
①由水电离出的[H+]=________;
②pH=________;
③加水稀释100倍,pH=________。
(2)常温下0.01 mol·L-1NaOH溶液:
①pH=________;
②加水稀释100倍,pH=________。
[解析] (1)①0.01 mol·L-1HCl溶液中的OH-只来源于水的电离,且[OH-]水=[H+]水,H+来源于水和HCl的电离,由于水的电离程度很小,计算时水电离的H+可忽略,[H+]=0.01 mol·L-1,[OH-]=[OH-]水=[H+]水==1.0×10-12mol·L-1。
②pH=-lg 0.01=2。
③加水稀释100倍,[H+]变为原来的,即[H+]=1.0×10-4mol·L-1,pH=4。
(2)①0.01 mol·L-1的NaOH溶液中的OH-来源于水和NaOH的电离,由于水的电离程度很小,计算时可忽略,即[OH-]=0.01 mol·L-1,所以[H+]==1.0×10-12mol·L-1,pH=12。
②加水稀释100倍,[OH-]=1.0×10-4mol·L-1,所以[H+]==1.0×10-10mol·L-1,pH=10。
[答案] (1)①1.0×10-12mol·L-1 ②2 ③4
(2)①12 ②10
1.下列溶液的pH一定等于2的是( )
A.0.01 mol·L-1硫酸500 mL
B.0.01 mol·L-1盐酸500 mL
C.0.01 mol·L-1醋酸1 L
D.pH=1的酸溶液稀释10倍
B [A中[H+]=2[H2SO4]=0.02 mol·L-1,pH=2-lg 2<2;B中[H+]=0.01 mol·L-1,则pH=2;C中CH3COOH部分电离,[H+]<0.01 mol·L-1,则pH>2;D中若为强酸,稀释10倍pH增大1则pH=2,但若为弱酸,每稀释10倍,pH增大不足1个单位,即其pH不一定为2。]
2.下列关于溶液的酸碱性,说法正确的是( )
A.pH=7的溶液呈中性
B.中性溶液中一定有[H+]=1.0×10-7 mol·L-1
C.在100 ℃时,纯水的pH<7,因此显酸性
D.[OH-]=[H+]的溶液呈中性
D [当溶液中[H+]=[OH-]时呈中性;[H+]>[OH-]时呈酸性;[H+]<[OH-]时呈碱性。]
3.下列关于用pH试纸测定溶液酸碱性的说法正确的是( )
A.使用pH试纸测定溶液的pH时一定要润湿
B.使用pH试纸测定某NaOH溶液pH为8.2
C.使用pH试纸测定氯水的pH为5
D.使用pH试纸测定溶液的酸碱性不如酸度计准确
D [使用pH试纸时一定不能润湿,A错;使用pH试纸测定溶液的pH只能为整数,B错;使用pH试纸不能测定氯水的pH,因为氯水中的HClO具有漂白性,pH试纸不能准确显示变色后的颜色,C错;pH试纸只能粗测溶液pH,酸度计能准确测定溶液pH,D对。]
4.常温下,关于溶液的稀释下列说法正确的是( )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=12
D.pH=8的NaOH溶液稀释100倍,其pH=6
B [A项,pH=3的醋酸溶液在稀释过程中电离平衡正向移动,稀释100倍时,3<pH<5;B项,pH=7,则1×10-3 L×0.1 mol·L-1=0.1 L×[OH-],[OH-]=1×10-3 mol·L-1,pH=14-3=11;C项,0.1 mol·L-1Ba(OH)2溶液稀释到2 L时,[OH-]= mol·L-1=0.1 mol·L-1,[H+]=1×10-13 mol·L-1,pH=13;D项,NaOH溶液是碱溶液,无论怎么稀释,pH在常温下不可能成为6,只能无限接近于7。]
5.常温下,有pH=12的NaOH溶液100 mL,要使它的pH降为11。
(1)若加入蒸馏水,应加________mL。
(2)若加入pH为10的NaOH溶液,应加________mL。
(3)若加入0.01 mol·L-1的盐酸,应加________mL。
[解析] (1)加水稀释pH=12的NaOH溶液至pH=11,体积增大到原体积的10倍,所以需加水900 mL。
(2)设需pH=10的NaOH溶液体积为V,那么:
=10-3mol·L-1,V=1 L=1 000 mL。
(3)设需0.01 mol·L-1盐酸体积为V′,那么:
=10-3mol·L-1,V′≈81.8 mL。
[答案] (1)900 (2)1 000 (3)81.8
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性第1课时教案设计: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性第1课时教案设计,共16页。
鲁科版选修4 化学反应原理第4节 离子反应第2课时教学设计: 这是一份鲁科版选修4 化学反应原理第4节 离子反应第2课时教学设计,共10页。
化学选修4 化学反应原理第2节 弱电解质的电离、盐类的水解第2课时教学设计: 这是一份化学选修4 化学反应原理第2节 弱电解质的电离、盐类的水解第2课时教学设计,共9页。













