
高中化学苏教版 (2019)必修 第一册专题1 物质的分类及计量第二单元 物质的化学计量课堂检测
展开1.铝及其化合物之间的转化关系
上述序号代表转化的化学方程式或离子方程式:
①化学方程式:2Al2O3(熔融)eq \(=====,\s\up8(通电),\s\d10(冰晶石))4Al+3O2↑ ;
②化学方程式:4Al+3O2eq \(=====,\s\up8(△))2Al2O3;
③离子方程式:Al2O3+6H+===2Al3++3H2O;
④离子方程式:Al2O3+2OH-===2AlOeq \\al(-,2)+H2O;
⑤离子方程式:2Al+6H+===2Al3++3H2↑;
⑥离子方程式:2Al+2OH-+2H2O===2AlOeq \\al(-,2)+3H2↑;
⑦化学方程式:2Al(OH)3eq \(=====,\s\up8(△))Al2O3+3H2O;
⑧离子方程式:Al(OH)3+3H+===Al3++3H2O;
⑨离子方程式:Al3++3NH3·H2O===Al(OH)3↓+3NHeq \\al(+,4);
⑩离子方程式:Al(OH)3+OH-===AlOeq \\al(-,2)+2H2O;
⑪离子方程式:AlOeq \\al(-,2)+CO2+2H2O===Al(OH)3↓+HCOeq \\al(-,3)。
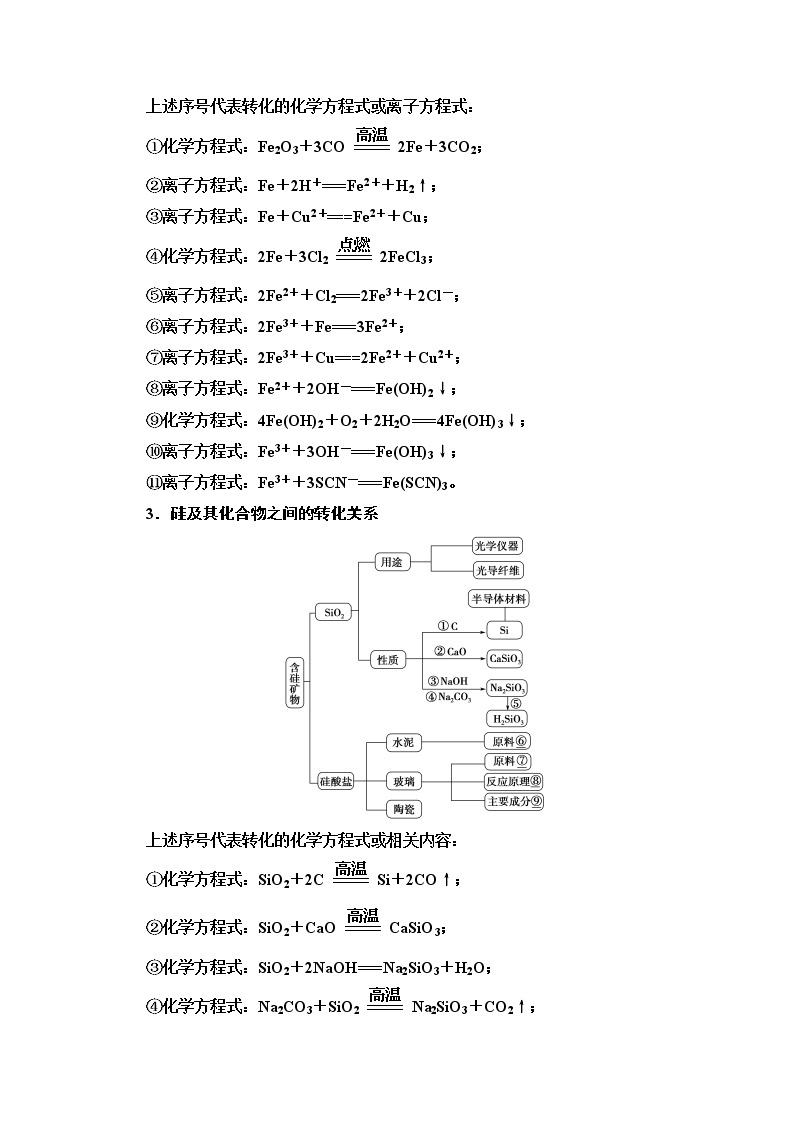
2.铁及其化合物之间的转化关系
上述序号代表转化的化学方程式或离子方程式:
①化学方程式:Fe2O3+3COeq \(=====,\s\up8(高温))2Fe+3CO2;
②离子方程式:Fe+2H+===Fe2++H2↑;
③离子方程式:Fe+Cu2+===Fe2++Cu;
④化学方程式:2Fe+3Cl2eq \(=====,\s\up8(点燃))2FeCl3;
⑤离子方程式:2Fe2++Cl2===2Fe3++2Cl-;
⑥离子方程式:2Fe3++Fe===3Fe2+;
⑦离子方程式:2Fe3++Cu===2Fe2++Cu2+;
⑧离子方程式:Fe2++2OH-===Fe(OH)2↓;
⑨化学方程式:4Fe(OH)2+O2+2H2O===4Fe(OH)3↓;
⑩离子方程式:Fe3++3OH-===Fe(OH)3↓;
⑪离子方程式:Fe3++3SCN-===Fe(SCN)3。
3.硅及其化合物之间的转化关系
上述序号代表转化的化学方程式或相关内容:
①化学方程式:SiO2+2Ceq \(=====,\s\up8(高温))Si+2CO↑;
②化学方程式:SiO2+CaOeq \(=====,\s\up8(高温))CaSiO3;
③化学方程式:SiO2+2NaOH===Na2SiO3+H2O;
④化学方程式:Na2CO3+SiO2eq \(=====,\s\up8(高温))Na2SiO3+CO2↑;
⑤化学方程式:Na2SiO3+2HCl===H2SiO3↓+2NaCl;
⑥黏土、石灰石;
⑦石灰石、石英和纯碱;
⑧Na2CO3+SiO2eq \(=====,\s\up8(高温))Na2SiO3+CO2↑,
CaCO3+SiO2eq \(=====,\s\up8(高温))CaSiO3+CO2↑
⑨Na2SiO3、CaSiO3和SiO2。
1.金属与非金属的反应规律
O2、Cl2、S等活泼非金属均可把金属氧化,得到金属氧化物、氯化物、硫化物等。其中对于变价元素Fe、Cu,当氧化剂为Cl2时,生成相应的高价化合物;当氧化剂为S时,生成相应的低价化合物。如2Fe+3Cl2eq \(=====,\s\up8(点燃))2FeCl3,Cu+Cl2eq \(=====,\s\up8(点燃))CuCl2,Fe+Seq \(=====,\s\up8(△))FeS,2Cu+Seq \(=====,\s\up8(△))Cu2S。
2.金属与氧气反应的多样性
活泼金属(如Na)在常温下即可反应,加热或点燃所得的产物一般更复杂。如4Na+O2===2Na2O(常温),2Na+O2eq \(=====,\s\up8(△))Na2O2。
3.金属的置换反应规律
(1)金属与水反应
在金属活动性顺序表中,钠及钠之前的金属能与冷水剧烈反应,生成强碱和氢气;镁、铝能与沸水反应;而铝之后、氢之前的金属在高温下能与水蒸气反应,生成不溶性氧化物和氢气。
(2)金属与酸的反应
在金属活动性顺序表中,排在H之前的金属能够与酸反应置换出H2,排在H之后的金属与酸不反应。金属的位置越靠前,其活动性越强,与酸反应越容易,反应越剧烈。如与等浓度的盐酸反应且金属颗粒大小相同时,剧烈程度Mg>Al>Fe。
(3)金属与盐的反应
在金属活动性顺序表中,位于前面的金属能够把位于后面的金属从它们的盐溶液中置换出来,如Fe+CuSO4===FeSO4+Cu。
但是能与水发生反应的金属(如Na)在与盐溶液反应时,不能置换出相应的金属单质,应先考虑与水的反应,再考虑生成的NaOH能否与盐发生反应。
1.对下列实验现象及其解释不正确的是( )
A.金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B.把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C.单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D.镁带在空气中点燃发出耀眼光芒,并发生三个反应:
2Mg+O2eq \(=====,\s\up8(点燃))2MgO、3Mg+N2eq \(=====,\s\up8(点燃))Mg3N2、2Mg+CO2eq \(=====,\s\up8(点燃))2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
C [NaCl为白色固体,固体小颗粒分散到空气中就形成烟,所以A项正确;Mg或Al与O2反应,不论加热与否,都是只有一种产物MgO或Al2O3,所以C项错误;D项中,Mg与O2反应放出大量热,火焰明亮,所以军事上常用它制照明弹,在这三个反应中,Mg的化合价都是从0价升高到+2价,所以Mg都是作还原剂,D项正确。]
2.A、B、C是单质,其中A是常见金属,各种物质间的转化关系如下所示:
根据图示转化关系回答:
(1)写出下列物质的化学式:
A________________,B________________,
乙________________,丁________________。
(2)写出下列反应的化学方程式或离子方程式:
①A与NaOH溶液反应的化学方程式:____________________
____________________________________________________。
②甲与NaOH溶液反应的离子方程式:_____________________
________________________________________________________________。
(3)将一定量的A加入NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗A的物质的量为_________________________,
转移电子的物质的量为________。
[解析] 常见金属单质中能与NaOH溶液反应的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可与NaOH溶液反应产生NaAlO2,甲是Al2O3,则丙是H2O,B即是O2。根据NaAlO2+CO2+2H2O===NaHCO3+Al(OH)3↓得丁是Al(OH)3。由2Al+2NaOH+2H2O===2NaAlO2+3H2↑知,n(Al)=eq \f(2,3)n(H2)=eq \f(2,3)×eq \f(3.36 L,22.4 L·ml-1)=0.1 ml,1 ml Al在反应过程中转移3 ml电子,则0.1 ml Al在反应过程中转移0.3 ml电子。
[答案] (1)Al O2 NaAlO2 Al(OH)3
(2)①2Al+2NaOH+2H2O===2NaAlO2+3H2↑
②Al2O3+2OH-===2AlOeq \\al(-,2)+H2O (3)0.1 ml
0.3 ml
3.下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂。其中所加试剂正确的一组是( )
C [A项中Cl2能把FeCl2氧化,B项中Fe能把FeCl3还原,D项除去了COeq \\al(2-,3)和SOeq \\al(2-,4)又引入了Cl-,均不合要求。A中应加适量铁粉,B中可加足量铁粉过滤后,向滤液中通足量Cl2,D中应加适量稀H2SO4。]
4.现有金属单质A、B 、I和气体甲、乙、丙及物质C、D、E、F、G、H。其中B是地壳中含量第二位的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:B________;乙________。
(2)写出反应①的离子方程式:_______________________。
写出反应⑥的化学方程式_________________________。
[解析] 根据框图转化,可以推断,A为Na,气体甲为H2,C为NaOH,气体丙为HCl,D为盐酸,B为Fe,E为FeCl2,F为FeCl3,I为Cu,G为Fe(OH)3,H为Fe(OH)2。
[答案] (1)Fe Cl2 (2)2Na+2H2O===2Na++2OH-+H2↑ 4Fe(OH)2+O2+2H2O===4Fe(OH)3金属的重要反应规律
重要金属化合物的性质及其应用
选项
A
B
C
D
X
FeCl2溶液
FeCl3溶液
Fe
Na2SO4溶液
Y
FeCl3
CuCl2
Al
Na2CO3
Z
Cl2
Fe
NaOH溶液
BaCl2溶液
高中化学苏教版选修1 化学与生活专题三综合复习与测试课后作业题: 这是一份高中化学苏教版选修1 化学与生活专题三综合复习与测试课后作业题,共5页。
苏教版 (2019)必修 第一册专题1 物质的分类及计量第二单元 物质的化学计量练习题: 这是一份苏教版 (2019)必修 第一册专题1 物质的分类及计量第二单元 物质的化学计量练习题,共5页。试卷主要包含了硫及其化合物的转化关系,氮及其化合物的转化关系等内容,欢迎下载使用。
化学必修 第一册第二单元 物质的化学计量课后复习题: 这是一份化学必修 第一册第二单元 物质的化学计量课后复习题,共7页。