

人教版 (2019)必修 第一册第二节 离子反应第二课时教案
展开学习目标:1.通过BaCl2溶液与Na2SO4溶液的反应现象,认识离子反应的本质。2.通过实验事实认识离子反应发生的条件。3.会书写离子方程式并能进行正误判断。4.理解离子方程式的意义。5.掌握一些常见离子能否共存的判断方法。
1.离子反应
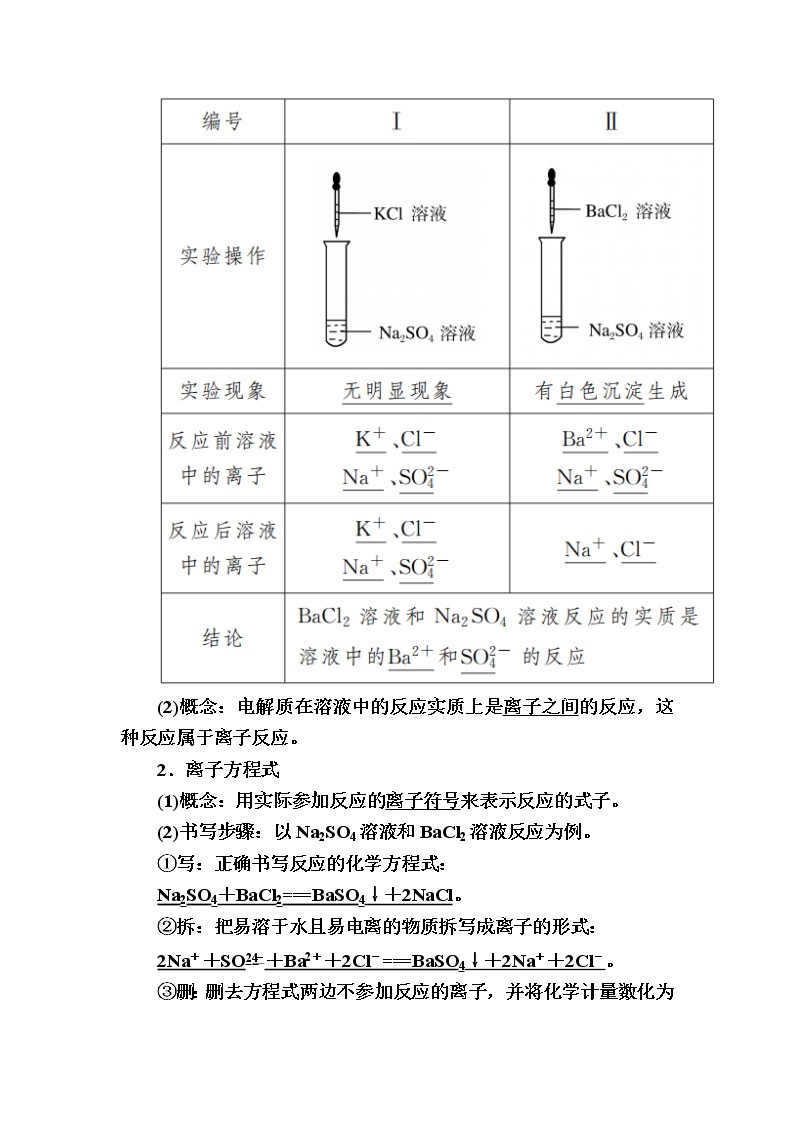
(1)按下图所示完成实验,并回答问题:
(2)概念:电解质在溶液中的反应实质上是离子之间的反应,这种反应属于离子反应。
2.离子方程式
(1)概念:用实际参加反应的离子符号来表示反应的式子。
(2)书写步骤:以Na2SO4溶液和BaCl2溶液反应为例。
①写:正确书写反应的化学方程式:
Na2SO4+BaCl2===BaSO4↓+2NaCl。
②拆:把易溶于水且易电离的物质拆写成离子的形式:
2Na++SOeq \\al(2-,4)+Ba2++2Cl-===BaSO4↓+2Na++2Cl-。
③删:删去方程式两边不参加反应的离子,并将化学计量数化为最简整数比:Ba2++SOeq \\al(2-,4)===BaSO4↓。
④查:检查方程式两边各元素的原子个数和电荷总数是否相等。
(3)意义
①写出表中几种不同的酸与不同的碱发生反应的离子方程式。
②结论
离子反应方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应。
1.判断正误(正确的打“√”,错误的打“×”)
(1)硫酸铜溶液与氯化钡溶液反应的实质是SOeq \\al(2-,4)与Ba2+生成了BaSO4沉淀( )
(2)碳酸钙与盐酸反应的离子方程式为COeq \\al(2-,3)+2H+===H2O+CO2↑( )
(3)浓盐酸与铁屑反应的离子方程式为2Fe+3H+===2Fe3++3H2↑( )
(4)Ag++Cl-===AgCl↓只能表示硝酸银溶液与氯化钠溶液的反应( )
(5)稀H2SO4与Ba(OH)2溶液反应的离子方程式为:Ba2++SOeq \\al(2-,4)===BaSO4↓( )
[答案] (1)√ (2)× (3)× (4)× (5)×
2.能正确表示下列化学反应离子方程式的是( )
A.澄清的石灰水与盐酸的反应:OH-+H+===H2O
B.氧化镁与稀硝酸反应:O2-+2H+===H2O
C.硫酸镁溶液与氢氧化钡溶液混合:
Ba2++SOeq \\al(2-,4)===BaSO4↓
D.碳酸钙溶于稀盐酸中:COeq \\al(2-,3)+2H+===H2O+CO2↑
[解析] B项中MgO应保留化学式,错误;C项中丢了Mg2+与OH-的离子反应,错误;D项中CaCO3应保留化学式,错误。
[答案] A
知识点一 离子反应与离子方程式
1.强电解质与弱电解质
(1)强电解质:在水溶液能够完全电离的电解质。包括:强酸、强碱和绝大多数盐。电离方程式中用“===”连接。
(2)弱电解质:在水溶液中不能完全电离的电解质。包括:弱酸、弱碱和水。电离方程式中用“”连接。
2.离子反应
(1)概念:电解质在溶液中的反应实质上是离子之间的反应。
(2)实质:溶液中某些离子浓度减小。
3.离子方程式
(1)概念:用实际参加反应的离子来表示反应的式子。
(2)离子方程式的书写步骤(以CaCO3与盐酸的反应为例)
(3)离子方程式的意义
离子方程式不仅可以表示某一个具体的化学反应,还可以表示同一类型的离子反应,如氢氧化钠溶液和盐酸反应、氢氧化钙溶液和硝酸反应的离子方程式,都可用H++OH-===H2O来表示。
(4)书写离子方程式的拆分原则
①拆成离子的物质:易溶且易电离的物质,如强酸、强碱、可溶性盐。
②书写化学式:单质、气体、氧化物、难溶物、难电离的物质、非电解质、浓硫酸。
③多元弱酸的酸式酸根:不能拆写成离子形式,如NaHCO3不能拆写成“Na++H++COeq \\al(2-,3)”,应写作“Na++HCOeq \\al(-,3)”。
④微溶物[如Ca(OH)2]:当作反应物时澄清溶液写成离子,悬浊液写成化学式;当作生成物时写成化学式。
⑤氨水:作反应物:写成NH3·H2O;作生成物:稀溶液写成NH3·H2O,浓溶液或加热写成NH3↑。
(5)离子方程式正误判断“六看”
①看是否符合反应的客观事实
如铁与稀硫酸反应:
②看反应是否符合拆写原则
如氢氧化铜与盐酸反应:
4.离子反应发生的条件
【典例1】 下列离子方程式书写正确的是( )
A.碳酸钙与盐酸反应:COeq \\al(2-,3)+2H+===CO2↑+H2O
B.硫酸钠和氯化钡溶液反应:Ba2++SOeq \\al(2-,4)===BaSO4↓
C.澄清石灰水中通入足量CO2:2OH-+CO2===COeq \\al(2-,3)+H2O
D.铁钉放入硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu
[思路启迪] 解答离子方程式正误的题型,关键在“查”:查“化学式”拆分是否正确,查元素、电荷是否守恒,查是否符合反应事实,查是否漏写离子反应,查化学计量数是否化为最简。
[解析] 碳酸钙与盐酸反应,碳酸钙难溶于水,应写化学式,A错误;硫酸钠和氯化钡溶液反应的离子方程式为Ba2++SOeq \\al(2-,4)===BaSO4↓,B正确;澄清石灰水中通入足量CO2无沉淀,产物是可溶的碳酸氢钙,C错误;铁钉放入硫酸铜溶液中,铁的氧化产物是Fe2+,D错误。
[答案] B
判断离子方程式正误的方法
[针对训练1] 下列各组反应,前者与后者均可用同一离子方程式表示的是( )
A.HCl+Na2CO3,HCl+NaHCO3
B.HCl+Na2CO3,HNO3 +K2CO3
C.H2SO4+Ba(OH)2,H2SO4+KOH
D.BaCl2+Na2SO4,BaCO3+HCl
[解析] A项,前者:2H++COeq \\al(2-,3)===H2O+CO2↑或H++COeq \\al(2-,3)===HCOeq \\al(-,3);后者:H++HCOeq \\al(-,3)===H2O+CO2↑。B项,前者:2H++COeq \\al(2-,3)===H2O+CO2↑;后者:2H++COeq \\al(2-,3)===H2O+CO2↑。C项,前者:2H++SOeq \\al(2-,4)+Ba2++2OH-===BaSO4↓+2H2O;后者:H++OH-===H2O。D项,前者:Ba2++SOeq \\al(2-,4)===BaSO4↓;后者:
BaCO3+2H+===Ba2++CO2↑+H2O。
[答案] B
知识点二 离子共存
1.离子共存
所谓几种离子在同一溶液中能大量共存,就是指离子之间不能发生离子反应;若离子之间能发生离子反应,则不能大量共存。
2.常见的离子不共存归纳
(1)若阴、阳离子能相互结合生成难溶物或微溶性盐,则不能大量共存。如Ba2+、Ca2+与COeq \\al(2-,3)、SOeq \\al(2-,4)、SOeq \\al(2-,3)等;Ag+与Cl-、Br-、I-、COeq \\al(2-,3)等。
(2)弱碱的阳离子不能与OH-大量共存。如Fe3+、Cu2+、NHeq \\al(+,4)、Ag+、Mg2+、Al3+、Fe2+、Zn2+与OH-不能大量共存。
(3)弱酸根阴离子不能与H+大量共存。如F-、COeq \\al(2-,3)、SOeq \\al(2-,3)、S2-、POeq \\al(3-,4)、CH3COO-等与H+不能大量共存。
(4)弱酸的酸式酸根阴离子与H+和OH-均不能大量共存。如HCOeq \\al(-,3)、HSOeq \\al(-,3)、HS-、H2POeq \\al(-,4)、HPOeq \\al(2-,4)既不能与H+大量共存,又不能与OH-大量共存。
(5)还需注意隐含条件
①“无色透明”溶液不存在有色离子,如:
②酸性溶液中不能大量存在与H+反应的离子:
“酸性”溶液的不同描述:
a.酸性溶液。
b.pH<7的溶液。
c.使石蕊溶液变红的溶液。
③碱性溶液中不能大量存在与OH-反应的离子:
“碱性”溶液的不同描述:
a.碱性溶液。
b.pH>7的溶液。
c.使石蕊溶液变蓝的溶液。
3.离子共存问题审题技巧
(1)注意判断离子共存的情况:“能、不能”,“一定、可能、一定不能”。
(2)注意题干中提示的溶液酸碱性:酸性溶液应考虑H+的存在,碱性溶液应考虑OH-的存在。
(3)注意题干中提示的溶液颜色:溶液无色时,有色离子不能存在。
(4)注意正确理解“透明溶液”,如:NaCl溶液、KOH溶液为无色透明溶液,CuSO4溶液、FeCl3溶液是有色透明溶液,不能认为“有色”就不透明。
【典例2】 在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A.Ba2+、Na+、NOeq \\al(-,3)、SOeq \\al(2-,4)
B.Mg2+、Cl-、Al3+、SOeq \\al(2-,4)
C.K+、Cl-、COeq \\al(2-,3)、NOeq \\al(-,3)
D.Ca2+、Na+、Fe3+、NOeq \\al(-,3)
[思路启迪] 解答离子共存问题时,一定要认真审查题干信息,尤其审清是否有隐含限制条件,如碱性、酸性、无色等。这些问题较易忽视,故放在第一步。其次准确把握复分解反应发生的条件,逐一分析,尤其要注意一些无现象的复分解反应,如:H++CH3COO-===CH3COOH。
[解析] A项Ba2+与SOeq \\al(2-,4)生成BaSO4沉淀;C项H+与COeq \\al(2-,3)反应产生CO2气体;D项Fe3+的水溶液呈棕黄色。
[答案] B
解答离子共存问题的方法
(1)看是否有隐含限制条件,如碱性、酸性、无色等。这些问题较易忽视,故放在第一步。
(2)看能否发生复分解反应。可分三步进行:
①查H+,主要看是否有弱酸根离子和酸式酸根离子等;
②查OH-,主要看是否有NHeq \\al(+,4)、酸式酸根离子和金属离子;
③查金属离子,主要看是否与酸根产生难溶性盐(包括微溶性盐)。
[针对训练2] 某溶液中存在大量的H+、SOeq \\al(2-,4)、Cl-,该溶液中还可能大量存在的离子是( )
A.OH- B.NOeq \\al(-,3) C.Ag+ D.Ba2+
[解析] H+与OH-反应生成H2O,Ag+与Cl-反应生成AgCl沉淀,SOeq \\al(2-,4)与Ba2+反应生成BaSO4沉淀,故溶液中可能大量存在的离子是NOeq \\al(-,3)。
[答案] B
课堂归纳小结
[知识脉络]
[核心要点]
1.两易、两等、两查判断书写离子方程式
(1)两易:易溶且易电离的物质以实际参加反应的离子符
号表示,非电解质、难电离的物质、难溶物、气体等物质用化学式表示。
(2)两等:离子方程式两边的同种元素的原子个数、电荷总数均应相等。
(3)两查:检查各项是否有公约数,若有必须约去,是否漏写必要的反应条件。
2.一色、二性、三反应
(1)记住几种溶液颜色,如Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnOeq \\al(-,4)(紫红色)等。
(2)溶液酸性(如石蕊显红色、0.1 ml·L-1 H+、pH=2等)、碱性(如石蕊显蓝色、pH=12等)。
(3)能生成沉淀、气体、H2O(难电离的物质)等符合离子反应发生条件的离子不能共存。
1.下列叙述中正确的是( )
A.凡是盐,在离子方程式中都要以离子形式表示
B.离子互换反应总是向着溶液中反应物离子浓度减小的方向进行
C.酸碱中和反应的实质是H+与OH-结合生成水,故所有的酸碱中和反应的离子方程式都可写成H++OH-===H2O的形式
D.复分解反应必须同时具备离子反应发生的三个条件才能进行
[解析] 只有可溶性盐在离子方程式中才可以写为离子形式;离子反应的实质是离子的浓度或数目减小;H++OH-===H2O表示的是可溶性强酸与可溶性强碱之间的反应;复分解反应只要满足三个条件之一即可发生。
[答案] B
2.下列反应中,属于离子反应的是( )
A.H2和O2反应生成水
B.锌片投入稀硫酸中
C.木炭在高温下与CO2反应生成CO
D.2KClO3eq \(=====,\s\up17(MnO2),\s\d15(△))2KCl+3O2↑
[解析] 离子反应是指在水溶液中有离子参加或生成的反应,只有锌与硫酸的反应符合,故B正确。
[答案] B
3.下列反应的离子方程式书写正确的是( )
A.稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:SOeq \\al(2-,4)+Ba2+===BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
[解析] A项不符合反应事实,Cu与稀H2SO4不反应,错误;B项漏写了H+与OH-的反应,错误;C项中H2CO3应拆写为H2O和CO2,错误。
[答案] D
4.下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液中:Cl-、K+、SOeq \\al(2-,4)、COeq \\al(2-,3)
B.含有大量H+的溶液中:Mg2+、Na+、HCOeq \\al(-,3)、SOeq \\al(2-,4)
C.含有大量OH-的溶液中:Mg2+、NOeq \\al(-,3)、SOeq \\al(2-,4)、COeq \\al(2-,3)
D.含有大量Na+的溶液中:H+、K+、SOeq \\al(2-,4)、NOeq \\al(-,3)
[解析] 选项A中Ba2+可与SOeq \\al(2-,4)、COeq \\al(2-,3)反应生成BaSO4、BaCO3沉淀;选项B中H+可与HCOeq \\al(-,3)反应生成CO2和H2O;选项C中OH-、COeq \\al(2-,3)可与Mg2+分别生成Mg(OH)2、MgCO3沉淀。
[答案] D
5.书写下列反应的离子方程式。
(1)NaOH溶液和H2SO4溶液:______________________________ __________________________________________;
(2)NaCl溶液和AgNO3溶液:______________________________ ______________________________________;
(3)Ba(OH)2溶液和H2SO4溶液:_____________________________ _______________________________________;
(4)Fe与CuSO4溶液反应:_________________________________ ______________________________________;
(5)Na2CO3溶液与澄清石灰水反应:_________________________ _____________________________________________;
(6)Fe与稀盐酸反应:_________________________________ _______________________________________;
(7)Na2CO3溶液与稀硫酸反应:_____________________________ _________________________________________。
[答案] (1)H++OH-===H2O
(2)Cl-+Ag+===AgCl↓
(3)Ba2++2OH-+SOeq \\al(2-,4)+2H+===BaSO4↓+2H2O
(4)Fe+Cu2+===Fe2++Cu
(5)Ca2++COeq \\al(2-,3)===CaCO3↓
(6)Fe+2H+===Fe2++H2↑
(7)COeq \\al(2-,3)+2H+===H2O+CO2↑
课后作业(四)
[基础巩固]
一、离子反应与离子方程式
1.下列物质混合后,不会发生离子反应的是( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.澄清的石灰水和盐酸
[解析] 根据离子反应发生的条件,分析判断A中有沉淀生成;B中有气体和水生成;D中有水生成;只有C中没有发生反应。
[答案] C
2.下列说法正确的是( )
A.Fe与稀硫酸反应的离子方程式:2Fe+6H+===2Fe3++3H2↑
B.向HCl溶液中加入少量的NaOH固体,溶液的导电能力增强
C.BaCO3与硫酸反应的离子方程式:Ba2++SOeq \\al(2-,4)===BaSO4↓
D.将CO2通入BaCl2溶液中无沉淀产生
[解析] Fe与稀硫酸反应生成Fe2+,离子方程式为:Fe+2H+===Fe2++H2↑,A错;HCl+NaOH===NaCl+H2O,反应前后离子浓度几乎不变,溶液导电能力不变,B错;BaCO3不溶于水,应用化学式表示,C错;酸性:H2CO3
[答案] D
3.离子方程式BaCO3+2H+===CO2↑+H2O+Ba2+中的H+不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4
⑤CH3COOH
A.①③ B.①④⑤ C.②④⑤ D.①⑤
[解析] 离子方程式中的H+、Ba2+分别代表强酸、可溶性的钡盐,故H+不能代表CH3COOH、H2SO4、NaHSO4;若H+代表H2SO4、NaHSO4,生成难溶性的钡盐BaSO4,不符合离子方程式,故HCl、HNO3可用H+代表。
[答案] C
4.用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出离子方程式。
(1)BaCl2(HCl):试剂________,离子方程式为________________________________________________________________________________________________________________________________________________。
(2)O2(CO2):试剂______________,离子方程式为________________________________________________________________________________________________________________________________________________。
(3)SOeq \\al(2-,4)(COeq \\al(2-,3)):试剂__________,离子方程式为________________________________________________________________________________________________________________________________________________。
[答案] (1)BaCO3 BaCO3+2H+===Ba2++H2O+CO2↑
(2)足量NaOH溶液 CO2+2OH-===COeq \\al(2-,3)+H2O
(3)适量稀硫酸 COeq \\al(2-,3)+2H+===H2O+CO2↑
二、离子共存
5.在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A.K+、MnOeq \\al(-,4)、Na+、Cl-
B.K+、Na+、NOeq \\al(-,3)、COeq \\al(2-,3)
C.Na+、H+、NOeq \\al(-,3)、SOeq \\al(2-,4)
D.Fe3+、Na+、Cl-、SOeq \\al(2-,4)
[解析] 题设要求为碱性条件,故还有OH-的存在。同时,溶液为无色,排除A、D,因MnOeq \\al(-,4)呈紫色,Fe3+呈黄色。C中H++OH-===H2O,不共存。
[答案] B
6.在水溶液中能大量共存,且加入过量稀硫酸时,有气体生成的是( )
A.Na+、Ag+、COeq \\al(2-,3)、Cl-
B.K+、Ba2+、SOeq \\al(2-,4)、Cl-
C.Na+、K+、COeq \\al(2-,3)、Cl-
D.Na+、K+、Cl-、SOeq \\al(2-,4)
[解析] A项,Ag+与Cl-、COeq \\al(2-,3)能发生反应,生成AgCl、Ag2CO3白色沉淀,不能大量共存;B项,Ba2+与SOeq \\al(2-,4)能发生反应,生成BaSO4白色沉淀,不能大量共存;C、D项中的离子在水溶液中能大量共存,加入稀硫酸后,C项中的COeq \\al(2-,3)与H+可发生反应,生成CO2气体,D项中的离子与H+不能发生反应,故C项符合题意。
[答案] C
7.甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下:
甲:K2SO4、BaCl2、NaCl 乙:NaCl、Ba(OH)2、K2CO3
丙:HCl、K2CO3、NaCl 丁:K2SO4、Na2CO3、KCl
其中记录结果合理的是( )
A.甲 B.乙 C.丙 D.丁
[解析] 甲会形成BaSO4沉淀而不能共存;乙会形成BaCO3沉淀而不能共存;丙会产生CO2气体而不能共存。
[答案] D
8.重金属离子有毒性。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要有毒离子为Ba2+,若将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A.Cu2+和SOeq \\al(2-,4) B.Cu2+和Cl-
C.K+和SOeq \\al(2-,4) D.Ag+和NOeq \\al(-,3)
[解析] 甲废液中主要毒性物质可看作是Ba(OH)2,乙废液有一定毒性且与甲废液按一定比例混合后毒性明显降低,可推知乙废液中的重金属离子可与甲废液中的OH-结合形成沉淀,同时乙废液中含有能沉淀甲废液中Ba2+的SOeq \\al(2-,4)或COeq \\al(2-,3),A正确。
[答案] A
[能力提升]
9.下列各组离子,能在溶液中大量共存的是( )
A.K+、H+、SOeq \\al(2-,4)、OH-
B.Na+、Ca2+、NOeq \\al(-,3)、COeq \\al(2-,3)
C.Na+、H+、Cl-、COeq \\al(2-,3)
D.Na+、Cu2+、Cl-、SOeq \\al(2-,4)
[解析] H+、OH-结合生成水,不能大量共存,故A错误;Ca2+、COeq \\al(2-,3)结合生成沉淀,不能大量共存,故C错误;H+、COeq \\al(2-,3)结合生成水和气体,不能大量共存,故C错误;D项离子之间不反应,可大量共存,正确;故选D。
[答案] D
10.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐在溶液中反应,符合离子方程式2H++SOeq \\al(2-,3)===H2O+SO2↑的化学方程式个数有( )
A.3 B.5
C.8 D.12
[解析] 亚硫酸的钾盐、钠盐、钡盐中,BaSO3不溶于水,离子方程式中不能用SOeq \\al(2-,3)表示,其余在溶液中均可用SOeq \\al(2-,3)表示;四种酸中,醋酸是弱酸,离子方程式中不能用H+表示,另外硝酸有强氧化性,能氧化SOeq \\al(2-,3),不能使用硝酸;则符合离子方程式2H++SOeq \\al(2-,3)===SO2↑+H2O,存在两种盐(钾盐、钠盐)与两种酸(盐酸、硫酸)可组合出4个反应,且离子方程式相同;此外硫酸氢钠、硫酸氢钾为强酸的酸式盐,完全电离,与亚硫酸钠、亚硫酸钾,可组合出4个反应,且离子方程式相同;所以共有8个离子方程式相同的反应;故选C。
[答案] C
11.能正确表示下列化学反应的离子方程式的是( )
A.小苏打溶液中加入少量NaOH溶液:H++OH-===H2O
B.铁跟稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-===Cu(OH)2↓
D.氧化铁与稀硫酸反应:Fe2O3+6H+===2Fe3++3H2O
[解析] A项,小苏打为NaHCO3,与NaOH溶液反应的离子方程式为:HCOeq \\al(-,3)+OH-===COeq \\al(2-,3)+H2O;B项,不符合事实,应为Fe+2H+===Fe2++H2↑;C项,漏掉Ba2++SOeq \\al(2-,4)===BaSO4↓的反应。
[答案] D
12.离子方程式COeq \\al(2-,3)+2H+===CO2↑+H2O表示( )
A.碳酸盐与盐酸之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与强酸之间的反应
D.可溶性碳酸盐与一切酸之间的反应
[解析] COeq \\al(2-,3)只代表可溶性的碳酸盐,故选项A和选项B都是不正确的;H+只代表强酸而不是一切酸(如弱酸H2S、HF、CH3COOH等均不能用H+表示),故选项C正确,选项D不正确。
[答案] C
13.某混合溶液中所含离子的浓度如表所示,则M可能为( )
A.Cl- B.Ba2+ C.Na+ D.Mg2+
[解析] 设M所带电荷数为x,根据溶液呈电中性可得2×1+1×2=2×1+x×1,得x=2,因此M应该带2个单位的正电荷。由于SOeq \\al(2-,4)与Ba2+能够反应生成沉淀,即不能大量共存,所以M可能为Mg2+。
[答案] D
14.下列反应的离子方程式错误的是__________________。
A.锌与稀硫酸:Zn+2H+===Zn2++H2↑
B.氢氧化钾与氯化镁两溶液混合:
2OH-+Mg2+===Mg(OH)2↓
C.CaCl2溶液中通入CO2:
Ca2++CO2+H2O===CaCO3↓+2H+
D.大理石与稀硝酸:
CaCO3+2H+===Ca2++CO2↑+H2O
E.在硫酸铜溶液中加入过量氢氧化钡溶液:
Ba2++SOeq \\al(2-,4)===BaSO4↓
F.澄清石灰水跟稀硝酸反应:
Ca(OH)2+2H+===Ca2++2H2O
G.石灰乳与稀盐酸反应:
Ca(OH)2+2H+===Ca2++2H2O
H.向稀氨水中加入稀盐酸:
NH3·H2O+H+===NHeq \\al(+,4)+H2O
I.氢氧化铝与足量盐酸反应:
Al(OH)3+3H+===Al3++3H2O
[解析] 锌与稀硫酸反应生成硫酸锌和氢气,反应实质为氢离子与锌反应,A项正确;镁离子与氢氧根离子生成氢氧化镁沉淀,B项正确;碳酸为弱酸,盐酸为强酸,二氧化碳通入氯化钙溶液不会发生反应,C项错误;碳酸钙与稀硝酸反应,实质为氢离子与碳酸钙反应,D项正确;铜离子与氢氧根离子反应生成氢氧化铜沉淀,所给的离子方程式中并没有写出,E项错误;澄清石灰水应当拆写成离子形式,F项错误;石灰乳中氢氧化钙主要以固体形式存在,而不是以离子形式存在,所以氢氧化钙不拆写,G项正确;一水合氨是弱碱不拆写,盐酸是强酸,要拆写,H项正确;氢氧化铝难溶于水而不拆,I项正确;所以答案选择C、E、F项。
[答案] CEF
15.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是__________________,可能含有的物质是________(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加__________________溶液的方法来检验。
(2)写出步骤③中的离子方程式:________________________________________________________________________。
[解析] 根据①“无色透明”知原固体混合物中无CuSO4,根据②和③知该白色沉淀是碳酸钡,故原固体混合物中一定有碳酸钠,且沉淀溶解的离子方程式是BaCO3+2H+===Ba2++CO2↑+H2O,则一定无硫酸钠和氯化钙。无法判断NaCl是否含有,若进一步确认,可向溶液中滴加硝酸酸化的硝酸银,若产生白色沉淀,则原溶液中有氯化钠。
[答案] (1)Na2CO3 Na2SO4、CuSO4、CaCl2 NaCl 硝酸酸化的硝酸银
(2)BaCO3+2H+===Ba2++CO2↑+H2O
16.现有A、B、C、D四种可溶性盐溶液,它们的阳离子分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别是NOeq \\al(-,3)、SOeq \\al(2-,4)、Cl-、COeq \\al(2-,3)中的某一种。
(1)根据已知条件分析,将同一种盐溶液中的阳离子与阴离子用短线连接。
Ba2+ Ag+ Na+ Cu2+
NOeq \\al(-,3) SOeq \\al(2-,4) Cl- COeq \\al(2-,3)
(2)四种盐溶液中,B溶液呈蓝色。则B中溶质的化学式为________。
(3)向另外三种无色溶液中分别加入盐酸,A溶液变浑浊,C溶液有气泡产生。则A中溶质的化学式为________,C溶液与D溶液混合的离子方程式为____________________________。
[解析] (1)由离子共存知识可知,COeq \\al(2-,3)只能与Na+结合成可溶性盐;而SOeq \\al(2-,4)与Ba2+、Ag+都生成沉淀,故只有与Cu2+结合形成可溶的CuSO4;而AgCl是沉淀,则Cl-只能与Ba2+结合形成可溶的BaCl2;最后NOeq \\al(-,3)与Ag+结合形成可溶的AgNO3。(2)呈蓝色的溶液中一定含有Cu2+,故B为CuSO4溶液。(3)加入盐酸变浑浊的溶液中一定含有Ag+,故A为AgNO3溶液;加入盐酸后有气泡产生,则溶液中一定含有COeq \\al(2-,3),则C为Na2CO3溶液;因D为BaCl2溶液,Na2CO3溶液与BaCl2溶液混合时的离子方程式为Ba2++COeq \\al(2-,3)===BaCO3↓。
[答案] (1)
(2)CuSO4 (3)AgNO3 Ba2++COeq \\al(2-,3)===BaCO3↓
17.Ⅰ.有A、B、C、D四种溶液,它们分别为K2CO3、K2SO4、H2SO4、Ba(NO3)2中的一种,分别取少量样品进行下列实验,现象为
在A中加C,无明显变化;
在A中加D,无明显变化;
在B中加D,生成沉淀E,并得到一种溶液;
在B中加C,生成沉淀并得到溶液F;
将少量E加入过量F中,有气体放出。
(1)写出下列物质的化学式:
B________,C________。
(2)如果将A和B混合,有关反应的离子方程式为____________________________;将E加入过量F中,有关反应的离子方程式为_________________________________________________ ______________________。
Ⅱ.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如图,则
(1)沉淀的化学式:沉淀1__________,沉淀2__________,沉淀3__________。
(2)写出混合液+A的离子方程式________________________________________________________________________________________________________________________________________________;
溶液+B的离子方程式______________________________ __________________________________________。
[解析] Ⅰ.利用题给信息寻找出交叉点确定物质,据此依次推测和进一步验证。
根据“在A中加C,无明显变化”和“在A中加D,无明显变化”,可判断A一定是K2SO4,并可初步推断C和D分别为K2CO3和H2SO4中的一种,则B可能是Ba(NO3)2。
根据“在B中加D,生成沉淀E,并得到一种溶液”和“在B中加C,生成沉淀并得到溶液F”,可验证B确实是Ba(NO3)2,C、D是K2CO3、H2SO4中的一种。
Ba(NO3)2+K2CO3===BaCO3↓+2KNO3
Ba(NO3)2+H2SO4===BaSO4↓+2HNO3
根据“将少量E加入到过量F中,有气体放出”,结合上一步分析中的两个化学方程式,可推断C是H2SO4,D是K2CO3,沉淀E是BaCO3,溶液F是HNO3,将少量E加入到过量F中发生反应的化学方程式为BaCO3+2HNO3===Ba(NO3)2+CO2↑+H2O。
Ⅱ.要使Ba2+、Cu2+、Ag+逐一沉淀分离,必须考虑除杂试剂的加入顺序。由于OH-、SOeq \\al(2-,4)均能同时与两种阳离子生成沉淀,故应先加入盐酸。除去Ag+,反应的离子方程式:Ag++Cl-===AgCl↓,然后再加NaOH(或Na2SO4),除去Cu2+(或Ba2+)。
[答案] Ⅰ.(1)Ba(NO3)2 H2SO4
(2)SOeq \\al(2-,4)+Ba2+===BaSO4↓
BaCO3+2H+===Ba2++H2O+CO2↑
Ⅱ.(1)AgCl BaSO4[或Cu(OH)2] Cu(OH)2或(BaSO4)
(2)Ag++Cl-===AgCl↓
Ba2++SOeq \\al(2-,4)===BaSO4↓
[或Cu2++2OH-===Cu(OH)2↓]
化学方程式
离子方程式
NaOH+HCl===NaCl+H2O
H++OH-===H2O
KOH+HCl===KCl+H2O
H++OH-===H2O
2NaOH+H2SO4===Na2SO4+2H2O
H++OH-===H2O
2KOH+H2SO4===K2SO4+2H2O
H++OH-===H2O
离子
NOeq \\al(-,3)
SOeq \\al(2-,4)
H+
M
浓度/ml·L-1
2
1
2
1
高中化学人教版 (2019)必修 第一册第三节 化学键第二课时教案设计: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键第二课时教案设计,共22页。
高中化学人教版 (2019)必修 第一册第一节 铁及其化合物第二课时教案设计: 这是一份高中化学人教版 (2019)必修 第一册第一节 铁及其化合物第二课时教案设计,共24页。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量第二课时教学设计: 这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量第二课时教学设计,共18页。













