
化学人教版 (新课标)第二节 几种重要的金属化合物教案及反思
展开
第二节 几种重要的金属化合物
第一课时
教学目标
1.让学生掌握几种典型金属氧化物在水中的溶解性,与酸反应以及与碱反应的性质。
2.让学生学会用比较的方法来学习几种相似物质的性质。
教学重点
运用比较法学习金属氧化物的性质
教学难点
运用比较法学习
教学方法
比较法,实验法,引导法
教学过程
【引言】多数金属的性质比较活泼,容易与其它物质发生化学反应。例如,金属单质与氧气反应,形成了一系列的金属氧化物。今节课我们用比较的方法学习几种典型金属氧化物的性质。
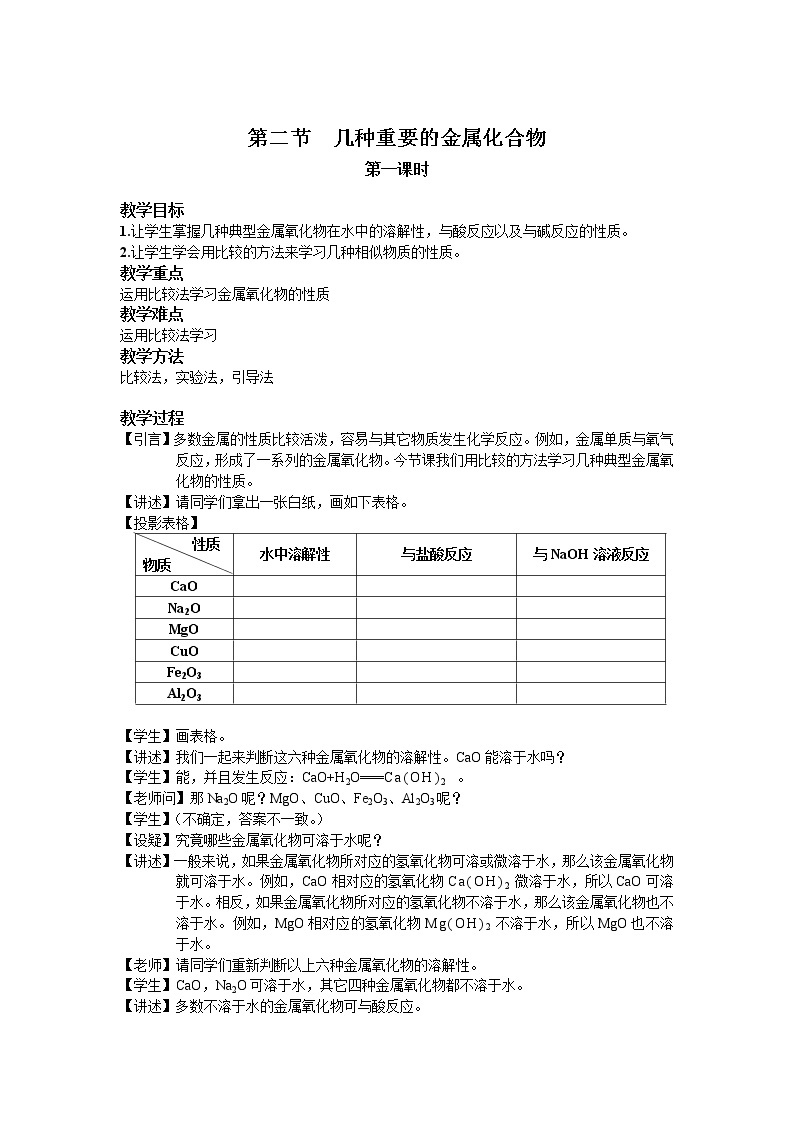
【讲述】请同学们拿出一张白纸,画如下表格。
【投影表格】
性质 物质 | 水中溶解性 | 与盐酸反应 | 与NaOH溶液反应 |
CaO |
|
|
|
Na2O |
|
|
|
MgO |
|
|
|
CuO |
|
|
|
Fe2O3 |
|
|
|
Al2O3 |
|
|
|
【学生】画表格。
【讲述】我们一起来判断这六种金属氧化物的溶解性。CaO能溶于水吗?
【学生】能,并且发生反应:CaO+H2O===Ca(OH)2 。
【老师问】那Na2O呢?MgO、CuO、Fe2O3、Al2O3呢?
【学生】(不确定,答案不一致。)
【设疑】究竟哪些金属氧化物可溶于水呢?
【讲述】一般来说,如果金属氧化物所对应的氢氧化物可溶或微溶于水,那么该金属氧化物就可溶于水。例如,CaO相对应的氢氧化物Ca(OH)2微溶于水,所以CaO可溶于水。相反,如果金属氧化物所对应的氢氧化物不溶于水,那么该金属氧化物也不溶于水。例如,MgO相对应的氢氧化物Mg(OH)2不溶于水,所以MgO也不溶于水。
【老师】请同学们重新判断以上六种金属氧化物的溶解性。
【学生】CaO,Na2O可溶于水,其它四种金属氧化物都不溶于水。
【讲述】多数不溶于水的金属氧化物可与酸反应。
【实物展示】MgO、CuO、Fe2O3粉末。
【学生】观察样品颜色。MgO:白色;CuO:黑色;Fe2O3:红棕色。
【讲述】建筑上用的红砖里因含有Fe2O3所以呈红色。
【学生实验】同桌共同完成实验3-5。观察并记录实验现象。
【学生】呈现实验结果:
反应物 | 溶液的颜色 | 化学方程式 |
MgO | 无色 | MgO+2HCl===MgCl2+H2O |
CuO | 蓝色 | CuO+2HCl===CuCl2+H2O |
Fe2O3 | 黄色 | Fe2O3+6HCl===2FeCl3+3H2O |
【设疑】Al2O3能否与盐酸反应呢?
【学生】可以。
【追问】现在没有提供Al2O3粉末,你如何解释Al2O3能与盐酸反应?能否从上一节的内容:铝片与盐酸反应的实验中得到启示?
【学生】思考
【引导】铝片表面有致密的氧化膜。该氧化膜把内层铝单质与盐酸隔开。若氧化膜不消失,内层铝单质能与盐酸接触吗?
【学生】不能。
【引导】但是,由上节课的实验我们看到,外表有氧化膜的铝片依然能溶于盐酸,跟盐酸反应,这说明了什么?
【学生】铝片表面的氧化膜跟盐酸发生了反应而溶解了。
【老师】对。请同学们写出其化学反应方程式。
【学生】Al2O3+6HCl===2AlCl3+H2O。
【问】其它两种氧化物能否于盐酸反应呢?如果可以请写出反应方程式。
【学生】CaO+2HCl===CaCl2+H2O ; Na2O+2HCl===2NaCl+H2O 。
【讲述】请同学们从这六个反应方程式归纳出金属氧化物与盐酸反应的共同点。
【学生】都有盐和水生成。
【老师】我们把与酸反应只生成盐和水的氧化物称为碱性氧化物。我们所列的六种金属氧化物都是碱性氧化物。与之对应的另一个概念是“酸性氧化物”,请大家给它下定义。
【学生】与碱反应只生成盐和水的氧化物称为酸性氧化物。
【老师】举例。CO2为酸性氧化物:CO2+2NaOH===Na2CO3+H2O。
【讲述】金属氧化物一般为碱性氧化物,只跟酸反应不跟碱反应。但也有一些特殊的例子,在我们所列的六种中就有一种既能跟酸反应又能跟碱反应。
【学生】是Al2O3 。Al2O3+2NaOH===2NaAlO2+H2O。
【老师】此实验也做不了,你又如何证明这个反应可以发生呢?
【学生】从铝片与NaOH溶液反应的实验可知,铝片表面的氧化物也能与NaOH反应。
【讲述】以上我们用比较的方法学习了这六种金属氧化物的三方面性质。下面请大家思考课本47页的“学与问”。
【学生】思考,讨论。
【提问】钠表面的氧化物和铝表面的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗?
【回答】Na2O和Al2O3都是白色固体。它们的化学性质不同:Na2O能溶于水生成NaOH,Al2O3不溶于水;Na2O能与酸反应,Al2O3既能与酸反应又能与强碱反应。Na2O疏松,对内层金属不能起保护作用,而在空气中铝表面的Al2O3是致密的薄层,对内层铝能起很好的保护作用。
【学生】简述金属氧化物的用途。
【小结】1.大部分金属氧化物不溶于水,只有少数金属氧化物能与水反应,生成可熔或微溶的碱。
2.金属氧化物一般为碱性氧化物,只与酸反应。但Al2O3既可与酸反应又可与强碱反应,为两性氧化物。
【作业】1.把0.02molAl2O3固体投入100mlNaOH溶液中,恰好完全反应,则所得溶液中溶质的物质的量浓度是多少?
2.预习“二.氢氧化物”,并仿照今节课的表格对其列出表格框架。
板书设计:
第二节 几种重要的金属氧化物
一.氧化物
1.性质比较
性质 物质 | 水中溶解性 | 与盐酸反应 | 与NaOH溶液反应 |
CaO | CaO+2HCl===CaCl2+H2O | CaO+2HCl===CaCl2+H2O |
|
Na2O | Na2O+2HCl===2NaCl+H2O | Na2O+2HCl===2NaCl+H2O |
|
MgO | 不溶 | MgO+2HCl===MgCl2+H2O |
|
CuO | 不溶 | CuO+2HCl===CuCl2+H2O |
|
Fe2O3 | 不溶 | Fe2O3+6HCl===2FeCl3+3H2O |
|
Al2O3 | 不溶 | Al2O3+6HCl===2AlCl3+H2O | Al2O3+2NaOH===2NaAlO2+H2O |
2.氧化物可分为碱性氧化物和酸性氧化物。
碱性氧化物:与酸反应只生成盐和水的氧化物。如:MgO,CaO,Fe2O3等。
酸性氧化物:与碱反应只生成盐和水的氧化物。如:CO2等。
Al2O3为两性氧化物:既可跟酸反应又可与强碱反应。
教学心得:
1.本节课开始就要求学生把表格画下来,可使学生明确今节课的主要内容和主要学习方法。表格中所列的六种金属氧化物就是众多金属氧化物中的典型例子。同时,学生从表格中还可明确地知道要学习金属氧化物的哪些性质。此表格很明显地体现了学习方法——比较法。比较法可让学生在学习时思路清晰,而且容易抓住主要问题。通过这个表格学生不但学到了知识,更重要的是学到了一种重要的学习方法。
2.在对学生的引导方面做得比较好,使学生温故而知新。利用上节课的实验:把没有经过处理的铝片放入盐酸、NaOH溶液中开始没有气泡后来才有大量的气泡产生,引出新内容:Al2O3既能与酸(盐酸)反应又能与强碱(NaOH溶液)反应。
3.充分调动学生的积极性,使学生参与到课堂学习中。表格要求每个学生制一份,并且随课堂完成,一节课下来学生对主要知识有较深的印象。金属氧化物与盐酸反应的实验是学生同桌间共同完成的,并完成简单的实验报告。在实验的过程以及完成实验报告的过程中,学生不但有充分的时间思考,也有时间与旁边的同学进行交流。这就可以锻炼学生的思考、动手、合作、交流等能力。
4.在金属氧化物与盐酸反应的实验中,Fe2O3与盐酸反应的实验现象不明显。应该减少Fe2O3粉末的用量;同时所用Fe2O3粉末为结晶化合物,反应较慢,溶液的颜色不容易观察到。
高中化学人教版 (新课标)必修1第二节 几种重要的金属化合物教学设计: 这是一份高中化学人教版 (新课标)必修1第二节 几种重要的金属化合物教学设计,共4页。教案主要包含了铝的重要化合物等内容,欢迎下载使用。
高中人教版 (新课标)第二节 几种重要的金属化合物第2课时教学设计: 这是一份高中人教版 (新课标)第二节 几种重要的金属化合物第2课时教学设计,共5页。教案主要包含了温故知新,课堂生成,课堂研讨,巩固练习,课后反思等内容,欢迎下载使用。
化学必修1第二节 几种重要的金属化合物第1课时教案设计: 这是一份化学必修1第二节 几种重要的金属化合物第1课时教案设计,共8页。













