必修一第一单元 氯、溴、碘及其化合物教学设计
展开第一单元 氯、溴、碘及其化合物单元小结
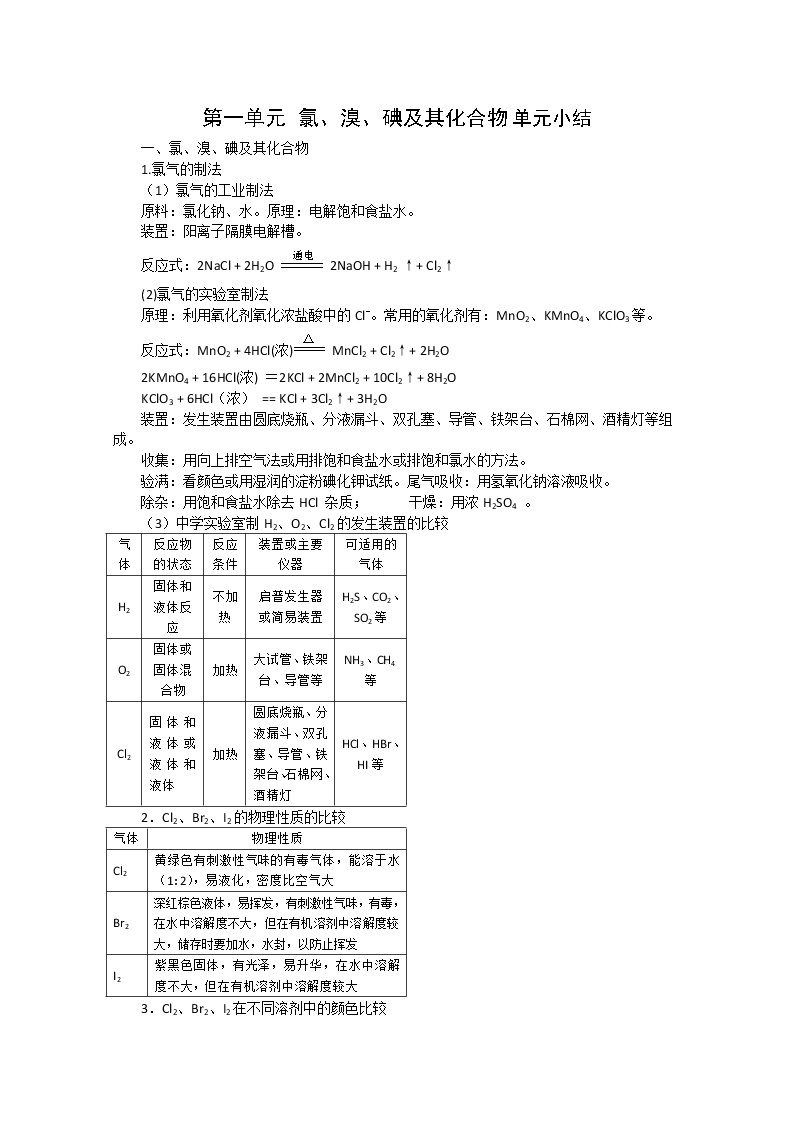
一、氯、溴、碘及其化合物
1.氯气的制法
(1)氯气的工业制法
原料:氯化钠、水。原理:电解饱和食盐水。
装置:阳离子隔膜电解槽。
反应式:2NaCl + 2H2O 2NaOH + H2 ↑+ Cl2↑
(2)氯气的实验室制法
原理:利用氧化剂氧化浓盐酸中的Cl-。常用的氧化剂有:MnO2、KMnO4、KClO3等。
反应式:MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
2KMnO4 + 16HCl(浓) =2KCl + 2MnCl2 + 10Cl2↑+ 8H2O
KClO3 + 6HCl(浓) == KCl + 3Cl2↑+ 3H2O
装置:发生装置由圆底烧瓶、分液漏斗、双孔塞、导管、铁架台、石棉网、酒精灯等组成。
收集:用向上排空气法或用排饱和食盐水或排饱和氯水的方法。
验满:看颜色或用湿润的淀粉碘化钾试纸。尾气吸收:用氢氧化钠溶液吸收。
除杂:用饱和食盐水除去HCl 杂质; 干燥:用浓H2SO4 。
(3)中学实验室制H2、O2、Cl2的发生装置的比较
气体 | 反应物的状态 | 反应条件 | 装置或主要仪器 | 可适用的气体 |
H2 | 固体和液体反应 | 不加热 | 启普发生器或简易装置 | H2S、CO2、SO2等 |
O2 | 固体或固体混合物 | 加热 | 大试管、铁架台、导管等 | NH3、CH4等 |
Cl2 | 固体和液体或液体和液体 | 加热 | 圆底烧瓶、分液漏斗、双孔塞、导管、铁架台、石棉网、酒精灯 | HCl、HBr、HI等 |
2.Cl2、Br2、I2的物理性质的比较
气体 | 物理性质 |
Cl2 | 黄绿色有刺激性气味的有毒气体,能溶于水(1:2),易液化,密度比空气大 |
Br2 | 深红棕色液体,易挥发,有刺激性气味,有毒,在水中溶解度不大,但在有机溶剂中溶解度较大,储存时要加水,水封,以防止挥发 |
I2 | 紫黑色固体,有光泽,易升华,在水中溶解度不大,但在有机溶剂中溶解度较大 |
3.Cl2、Br2、I2在不同溶剂中的颜色比较
| 水 | 酒精 | 苯 | 汽油 | 四氯化碳 |
Cl2 | 黄绿色(新制) | 黄绿色 | 黄绿色 | 黄绿色 | 黄绿色 |
Br2 | 黄―橙 | 橙―橙红 | 橙―橙红 | 橙―橙红 | 橙―橙红 |
I2 | 深黄 ―褐色 | 棕―深棕 | 浅紫 ―紫 | 紫―深紫 | 浅紫红-紫红 |
4.Cl2、Br2、I2的化学性质的比较
⑴与金属反应
2Na + Cl2 2NaCl,
Cu + Cl2 CuCl2,
2Fe + 3Cl2 2FeCl3,
2Fe + 3Br2 2FeBr3,
Fe + I2 FeI2。
⑵与氢气反应
反应物 | 反应方程式 | 反应条件 | 反应现象 |
H2与F2 | H2 + F2 == 2HF | 冷、暗 | 爆炸 |
H2与Cl2 | H2 + Cl2=2HCl | 光照 | 爆炸 |
H2与Br2 | H2 + Br2=2HBr | 加热 | 反应 |
H2与I2 | H2 + I2 2HI | 持续加热 | 可逆反应 |
⑶与水的反应
2F2 + 2H2O == 4HF + O2
X2 + H2O HX + HXO (X:Cl、Br、I)
⑷与碱反应
Cl2、Br2、I2都容易与碱液反应,常用于除尾气、除杂质等。工业上利用这反应来制漂白粉,反应式是:2Cl2 + 2Ca(OH)2 == CaCl2 + Ca(ClO)2 + 2H2O,漂白粉主要成分是CaCl2 + Ca(ClO)2 ,有效成分是Ca(ClO)2 。
⑸Cl2、Br2、I2相互置换
氧化性Cl2>Br2>I2,所以Cl2可以将Br2、I2置换出,Br2可以将I2置换出。
如:Cl2 +2NaBr == 2NaCl + Br2.
5.Cl-、Br-、I-的检验
(1)AgNO3─HNO3法
离子 | 选用试剂 | 实验现象及离子方程式 |
Cl- | AgNO3的稀HNO3溶液 | Ag+ + Cl- == AgCl↓ 白色沉淀 |
Br- | AgNO3的稀HNO3溶液 | Ag+ + Br- == AgBr↓ 浅黄色沉淀 |
I- | AgNO3的稀HNO3溶液 | Ag+ + I- == AgI↓ 黄色沉淀 |
(2)Br- 、I- 可以用氯水反应后加 CCl4 萃取的方法。
6.AgBr、AgI的感光性
它们都见光分解,AgBr用于感光底片的感光材料;AgI用于人工降雨。
二、氧化还原反应
1.氧化还原反应的实质:是电子的转移;氧化还原反应的特征表现:是元素化合价的变化。
2.两条关系式
反应物 | 反应中化合价变化 | 反应中电子的得失 | 反应物具有的性质 | 反应中反应物自身的变化 | 反应后的生成物 |
氧化剂 | 降低 | 得到 | 氧化性 | 被还原 | 还原产物 |
还原剂 | 升高 | 失去 | 还原性 | 被氧化 | 氧化产物 |
3.几条重要规律
⑴电子得失守恒规律
氧化剂得电子的总数目=还原剂失电子的总数目
⑵以强制弱规律:对于自发的氧化还原反应(除高温、电解条件外),总是强氧化性物和强还原性物质反应生成弱氧化性物质和弱还原性物质。
⑶价态归中规律:同种元素不同价态原子间发生氧化还原反应,总是从高价态与低价态反应后生成中间价态的物质。
元素的化合价变化趋势不能交叉。
⑷先强后弱规律
同一氧化剂(或是还原剂)与不同还原剂(或氧化剂)反应,当还原剂(或氧化剂)的浓度差别不大时,总是先与还原性(或氧化性)强的反应,然后再与弱的反应。
4.电子转移的表示方法
⑴双线桥法:如
得1×e-
Cl2 + H2O HCl+ HClO
失1×e-
⑵单线桥法:Zn + 2HCl == ZnCl2 + H2↑
2×e-
5.几点氧化性、还原性强弱的比较规律
⑴在同一个反应中氧化剂的氧化性强于氧化产物;还原剂的还原性强于还原产物。
⑵同种元素一般情况下高价态的物质氧化性强于低价态的物质;而低价态物质的还原性强于高价态的物质。如KMnO4 >K2MnO4> MnO2 >MnSO4
⑶与同一种氧化剂或还原剂反应,条件简单,反应剧烈的物质还原性或氧化性强。
⑷还原性的强弱还可以依据金属活动顺序表给出的顺序来判断。
6.氧化还原反应的有关计算
依据是:氧化剂得电子总数等于还原剂失电子总数。www.ks5u.comw.w.w.k.s.5.u.c.o.m www.ks5u.com
化学第一单元 氯、溴、碘及其化合物教案: 这是一份化学第一单元 氯、溴、碘及其化合物教案,共3页。
苏教版必修一第一单元 氯、溴、碘及其化合物第一课时教学设计: 这是一份苏教版必修一第一单元 氯、溴、碘及其化合物第一课时教学设计,共3页。
苏教版必修一专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物教学设计: 这是一份苏教版必修一专题2 从海水中获得的化学物质第一单元 氯、溴、碘及其化合物教学设计,共2页。













