
化学必修一第二单元 钠、镁及其化合物教学设计
展开第二单元 钠、镁及其化合物
2.2.2 碳酸钠的性质与应用
一、教学目标
(一)知识与技能目标
1. 认识碳酸钠、碳酸氢钠的性质及差异。
2. 了解侯氏制碱法的化学原理及生产流程。
(二)过程与方法目标
1. 用对比实验的方法探究碳酸钠、碳酸氢钠的性质差异。
2. 通过对侯氏制碱法生产流程的分析,了解侯氏制碱法的化学原理。
(三)情感态度与价值观目标
1.认识碳酸钠、碳酸氢钠与人类生产生活的密切关系。
2.通过对侯氏制碱法的学习,培养爱国主义思想,树立努力学习为国争光的志向。
二、重点、难点
重点:碳酸钠、碳酸氢钠的性质差异。
难点:侯氏制碱法的化学原理。
三、教学工具
仪器:8个试管、3个烧杯、 2个量筒、玻璃棒、PH试纸、两个分别装有碳酸钠、碳酸氢钠的小气球、双套管、酒精灯、铁架台、三脚架、石棉网、镊子。
药品:碳酸钠、碳酸氢钠固体和碳酸钠、碳酸氢钠溶液、氯化钙溶液、氢氧化钙溶液、盐酸溶液、蒸馏水、有油污的铜片。
四、课时安排
一课时
五、教学过程
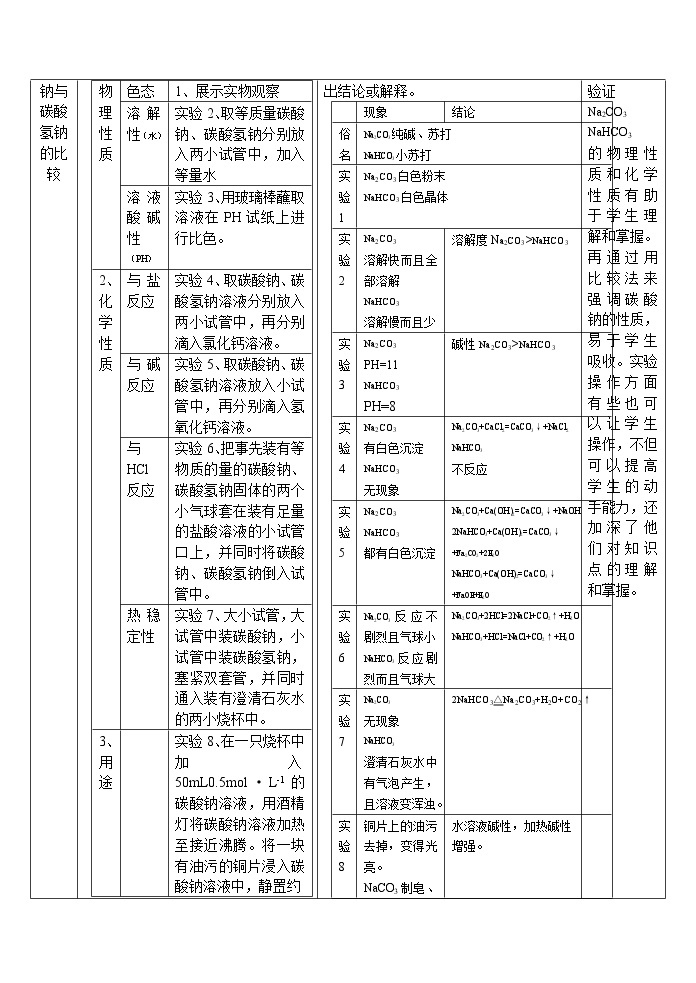
学习课题 | 教师活动 | 学生活动 | 教学设想 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
引入课题 | 在中国的近代的历史上,“宋氏三姐妹”名气很响(宋庆龄、宋美龄、宋爱龄)。在化学王国里也有三姐妹那是“苏氏三姐妹”——苏打、小苏打、大苏打,今天我们学习能过比较老二和老小的性格来重点认识老二的性格也就是碳酸钠的性质及应用。 | 细听、思考。 | 发展学生学习化学的兴趣,激发他们探求新知识的欲望。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
一、碳酸钠与碳酸氢钠的比较 |
| 实验部分由老师演示部分由学生亲身实践,学生仔细观察,并通过实验现象总结出结论或解释。
| 通过大量的实验来验证 Na2CO3 NaHCO3 的物理性质和化学性质有助于学生理解和掌握。再通过用比较法来强调碳酸钠的性质,易于学生吸收。实验操作方面有些也可以让学生操作,不但可以提高学生的动手能力,还加深了他们对知识点的理解和掌握。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
二、侯氏制碱法 | 过渡:通过作业中遇到的问题引入。 完成Na的用途作业时遇到了一个问题:用Na来工业上制取Na2CO3和NaOH可不可以? | 不可以,钠比Na2CO3贵,经济角度讲不合理。 | 通过对现实问题的讨论,增强学生对学习化学的重要性的认识。 通过自学法学习“侯氏制碱法”增强学生的自学能力,培养学生独立思考的思维模式。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
老师:那么如何来制取Na2CO3呢? 板书:二、侯氏制碱法 教材第52页的“侯氏制碱法流程图”,请带着如下问题去详读: 1. 反应原理是什么? 2. NH3和CO2两种气体,哪一种先通入饱和的NaCl溶液中?为什么? 3. NaHCO3和NH4Cl两种物质,为何是NaHCO3先从溶液中结晶析出? 4. “联合制碱法”的“联合”意义何在? 5. “联合制碱法”的还能得到什么副产品? 讨论时,教师带领学生解释流程图。 板书:反应原理 NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl 2NaHCO3△Na2CO3+H2O+CO2↑ | 看书回答:以NaCl为原料的侯氏制碱法P52带问题详读。
1.反应原理 NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl 2NaHCO3△Na2CO3+H2O+CO2↑ 2.NH3到饱和NaCl溶液中,形成氨水的NaCl饱和溶液,而后再通入CO2。这样先形成了一个弱碱性的环境以后,可以增大CO2在溶液中的溶解度,生成更多的NaHCO3。 3.因为NaHCO3的溶解度小于NH4Cl的溶解度,所以是NaHCO3先从溶液中结晶析出。 4.在制碱工业上,所用原料CO2和NH3是由合成氨厂提供的,所以工业生产上常将侯氏制碱和合成氨联合在一起,所以,称为“联合制碱法”。 5.“联合制碱法”时还能得到NaHCO3和NH4Cl等副产品。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
讨论题 | 根据所学知识,设置几个常见的易错题。 1.有关于NaCO3和NaHCO3与HCl反应的讨论。 A、等质量的NaCO3和NaHCO3与足量HCl反应,何者放出气体多?何者消耗盐酸多? B、等物质的量的NaCO3和NaHCO3与足量HCl反应,何者放出气体多?何者消耗盐酸多? 2.Na长时间露置于空气中最终生成什么? 3.如何鉴别NaCO3和NaHCO3? | 学生讨论并推荐代表发言与其他组交流思想。 1.A、NaHCO3 放出气体多,NaCO3消耗盐酸多。 B、 NaCO3和NaHCO3放出气体一样多,消耗盐酸NaCO3多。 2.Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3 3.a、加热固体 b、溶解 c、加HCl d 、加CaCl2等等 | 该讨论如何时间不够可以放在课后,待下节课再交流。 通过讨论可以加强学生的团队意识。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
小结 | 1、通过对NaCO3和NaHCO3的物理化学性质及应用的比较讨论强调NaCO3的性质。 2、学习侯氏制碱法。 |
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
六、板书设计:
碳酸钠的性质与应用
一、 碳酸钠的性质
碳酸钠与碳酸氢钠的比较 | ||||
|
|
| Na2CO3 | NaHCO3 |
1.物理性质 | 俗名 | -- | 纯碱、苏打 | 小苏打 |
色态 | 实验1 | 白色粉末 | 白色晶体 | |
溶解性(水) | 实验2 | 溶解度Na2CO3>NaHCO3 | ||
溶液酸碱性(PH) | 实验3 | 碱性Na2CO3>NaHCO3 | ||
2.化学性质 | 与盐反应 | 实验4 | Na2CO3+CaCl2=CaCO3↓+NaCl2 | 不反应 |
与碱反应 | 实验5 | Na2CO3+Ca(OH)2=CaCO3↓+NaOH
| 2NaHCO3+Ca(OH)2=CaCO3↓ +Na2CO3+2H2O NaHCO3+Ca(OH)2=CaCO3↓ +NaOH+H2O | |
与HCl反应 | 实验6 | Na2CO3+2HCl=2NaCl+CO2↑+H2O | NaHCO3+HCl=NaCl+CO2↑+H2O | |
热稳定性 | 实验7 | 2NaHCO3△Na2CO3+H2O+CO2↑ |
| |
3.用途 |
| 实验8 | 制皂、玻璃、造纸、纺织等、热纯碱除油污。 | 发酵粉、泡沫灭火器、治胃酸。 |
二、 侯氏制碱法
反应原理
NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl
2NaHCO3△Na2CO3+H2O+CO2↑
高中化学苏教版必修一第二单元 钠、镁及其化合物教案及反思: 这是一份高中化学苏教版必修一第二单元 钠、镁及其化合物教案及反思,共3页。
高中专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教学设计: 这是一份高中专题2 从海水中获得的化学物质第二单元 钠、镁及其化合物教学设计,共5页。
高中第二单元 钠、镁及其化合物教学设计: 这是一份高中第二单元 钠、镁及其化合物教学设计,共3页。













