

高中化学第一单元 原子核外电子排布与元素周期律导学案
展开课时3 元素周期表及应用
班级_______学号_______姓名______________
[学习目标]
1、知道元素周期表是元素周期律的具体表现形式,能描述元素周期表的结构,初步学会运用元素周期表;知道同周期、同主族元素性质的递变规律。理解元素在周期表中的位置与它的原子结构、元素化学性质三者之间关系;
2、运用直接观察法学习元素周期表的结构,运用逻辑推理方法研究学习同主族元素性质的递变规律;
3、了解周期表的编制过程,了解科学发现和发展的历程,认识周期表的理论对实践的指导作用。
三、元素周期表
(一)元素周期表的结构
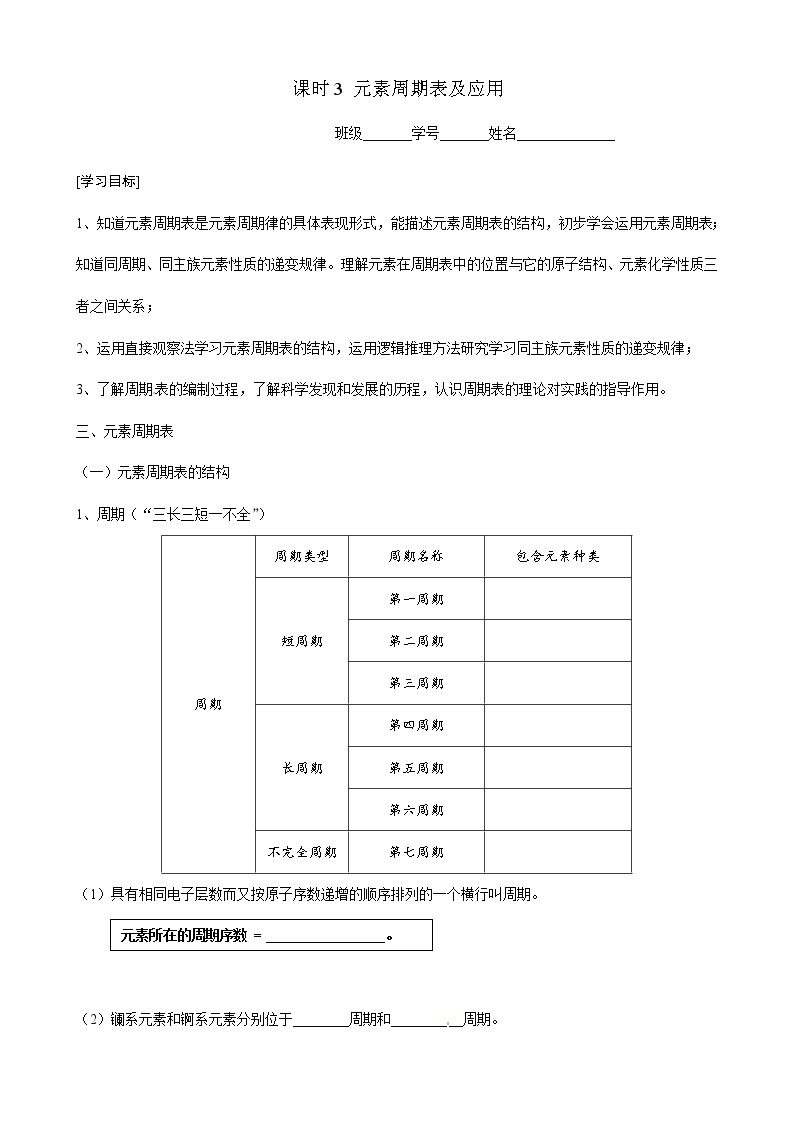
1、周期(“三长三短一不全”)
周期
周期类型
周期名称
包含元素种类
短周期
第一周期
第二周期
第三周期
长周期
第四周期
第五周期
第六周期
不完全周期
第七周期
(1)具有相同电子层数而又按原子序数递增的顺序排列的一个横行叫周期。
元素所在的周期序数 = _________________。
(2)镧系元素和锕系元素分别位于________周期和__________周期。
2、族(七主七副零八族)
(1)周期表一共有_________纵行,除第8、9、10三个纵行叫作第Ⅷ族外,其余15个纵行,每个纵行标作一族。
(2)主族:由_________和_________共同构成的族,符号是_______。
主族元素所在的族序数=______________。
(3)副族:完全由____________元素构成的族,符号是________。
族
族类型
符号
列数
7个主族
7个副族
第Ⅷ族
0族
(二)元素的性质与它在周期表中的位置关系
分析同一周期元素金属性和非金属性强弱的变化与元素原子核外电子排布的关系
1、同一周期元素的原子(稀有气体元素除外),核外电子层数相同,核电荷数越多→原子半径越_____→原子核对核外电子的吸引力越_____→失电子能力_____,得电子能力____→金属性_____,非金属性______。
项目
同周期(从左到右)
最外层电子数
由____逐渐增加到______
原子半径
逐渐________(稀有气体元素除外)
得失电子能力
失电子能力______,得电子能力______。
金属性与非金属性
金属性______,非金属性_______。
主要化合价
最高正价由___________,负价由________。
非金属的气态氢化物形成的难易与稳定性
生成由______到______,稳定性_______。
最高价氧化物对应水化物的酸碱性
碱性_________,酸性_________。
根据下表情况说明同一主族元素金属性、非金属性强弱变化的情况
2、同一主族元素的原子,最外层电子数相同,核电荷数的增大→电子层数逐渐_____→原子半径逐渐_____→失电子能力_____,得电子能力____→金属性_____,非金属性______。
课堂练习一
1.下列化学符号表示同一种元素的是 ( )
① ② ③ ④
A.①③ B.②③ C.①②③ D.全部
2.下列说法正确的是 ( )
A.非金属元素都是主族元素 B.主族元素的次外层电子数都是8
C.稀有气体元素都是非金属元素 D.主族元素都是短周期元素
3.某元素X,它的原子最外层电子数是次外层电子数的2倍,则X在周期表中位于( )
A.第二周期 B.第三周期 C.ⅣA族 D.ⅤA族
4.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 ( )
A.x+2 B.x+4 C.x+8 D.x+18
5.X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是 ( )
A.如X、Y均为金属元素,则X的金属性强于Y
B.如X、Y均为金属元素,则X的阳离子氧化性比Y形成的阳离子强
C.如X、Y均为非金属元素,则Y的气态氢化物比X的稳定
D.如X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X
6.下列有关稀有气体的描述不正确的是:①原子的最外层都有8个电子;②其原子与同周期 第ⅠA族、ⅡA族阳离子具有相同的核外电子排布;③有些稀有气体能跟某些物质反应;④原子半径比同周期ⅦA族元素原子的大 ( )
A.只有① B.①和③ C.①和② D.②和④
7.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成化合物的化学式为 ( )
A.XY B.XY2 C.XY3 D.XY4
8.右图是元素周期表的一部分,下列说法中正确的是 ( )
…
①
②
③
…
④
⑤
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
9.如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若w原子最外层电子数是其内层电子数的7/10,则下列说法中不正确的是 ( )
X
Y
Z
W
A.原子半径由大到小排列顺序Z>Y>X
B.Y元素的两种同素异形体在常温下都是气体
C.最高价氧化物对应水化物的酸性W>Z
D.阴离子半径由大到小排列顺序Z>W>X>Y
10.同一短周期的X、Y、Z三种元素的最高价氧化物对应的酸性强弱的顺序为:HZO4>H2YO4>H3XO4,则下列说法正确的是 ( )
A.三种元素的阴离子的还原性按X、Y、Z的顺序增强
B.它们单质的氧化性按X、Y、Z的顺序减弱
C.它们的原子半径按X、Y、Z的顺序减小
D.它们的气态氢化物的稳定性按X、Y、Z的顺序增强
二、填空题
11.在第三周期中,置换氢能力最强的元素的符号为 ,化学性质最稳定的元素的符号是________,最高价氧化物的水化物酸性最强的酸的化学式是 ,碱性最强的化学式是__________,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、烧碱溶液分别反应的离子方程式为 、
。
原子半径最小的金属离子结构示意图为 。
12.下表是元素周期表的一部分,回答下列有关问题:
族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
(1)写出下列元素符号:①________,⑥_______,⑦_______, ________。
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间相互反应的化学方程式___________________________________________________________________。
(4)在这些元素中,原子半径最小的是 ,原子半径最大的是 。
(5)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?
答:__________________________________________________________________。
在⑧与中,化学性质较活泼的是 ,怎样用化学实验证明?答:
______________________________________________________________________。
13.(1)在右图元素周期表中全部是金属元素的区域
为 。
A B C D
(a)A (b)B (c)C (d)D
(2)根据NaH的存在,有人提议可将氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,可将氢元素放在周期表中的 __________族。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
课堂练习二
1.元素以下性质,随着原子序数的递增不呈周期性变化的是 ( )
A.相对原子质量 B.化合价 C.原子半径 D.元素的金属性和非金属性
2.元素周期表是一座开放的“元素大厦”,元素大厦尚未客满。若发现119号元素,请你在元素大厦中安排好它的“房间” ( )
A.第7周期0族 B.第6周期ⅡA 族 C.第8周期ⅠA族 D.第7周期ⅦA族
3.下列说法正确的是 ( )
A.原子最外层电子数等于或大于3(小于8)的元素一定是非金属元素
B.最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期
4.X、Y为同主族元素,Y的原子半径大于X。下列说法正确的是(m、n均为正整数)( )
A.若X(OH)n为强碱,则Y(OH)n也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若HnY的水溶液为酸性,则HnX的酸性比HnY的酸性更强
D.若Y的最高正价为+7,则X的最高正价一定为+7
5.已知a为IIA族元素,b为IIIA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系式错误的是 ( )
A.n=m+11 B.n=m+25 C.n=m+10 D.n=m+1
6.下列说法正确的是 ( )
A.SiH4比CH4稳定 B.Na和Cs属于第ⅠA族 元素,Cs失电子能力比Na强
C.O2-半径比F-的小 D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
7.几种短周期元素的主要化合价及原子的原子半径数据见下表:
元素代号
L
M
Q
R
T
主要化合价
+2
+3
+6、-2
+7、-1
-2
原子半径/nm
0.160
0.143
0.102
0.099
0.074
据表中信息判断,下列有关叙述中,正确的是 ( )
A.L、M的单质分别与同浓度的稀盐酸反应时,M的单质反应更剧烈
B.M与T形成的化合物能和强酸、强碱反应
C.Q、T两元素的氢化物中:Q的氢化物的稳定性大于T的氢化物的稳定性
D.L与Q形成的简单离子的核外电子数相等
8.短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是 ( )
X
Y
Z
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
9.我国报道的高温超导体中,铊是组成成分之一,已知铊和铝是同族元素,关于铊的判断错误的是 ( )
A.铊是银白色金属 B.氢氧化铊[Tl(OH)3]是两性氢氧化物
C.铊能与盐酸反应置换出氢气 D.铊能形成+3的化合物
10.X、Y、Z三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期,X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1,下列说法正确的是 ( )
A.元素非金属性由强到弱的顺序是Z
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
二、填空题
11.下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
⑥
⑦
3
①
③
⑤
⑧
⑩
4
②
④
⑨
(1)10种元素中,化学性质最不活泼的是 ,除⑩外原子半径最大的是 。
(2)①②⑤三种元素最高价氧化物对应的水化物碱性最强的是
(3)①②③④⑤⑧六种元素形成的离子半径由大到小的顺序为
(4)元素⑦的氢化物的化学式为 ;该氢化物和元素②单质反应的化学方程式为 。
(5)①⑨形成的化合物灼烧时火焰焰色为 ;该化合物的溶液与元素⑧的单质反应的化学方程式为 。
(6)①、⑤和⑧最高价氧化物对应水化物间相互反应的离子方程式
______________________________________________________________________。
(7)③的单质在⑥⑦形成化合物中燃烧的化学方程式为 _________________;单质⑨溶入⑥⑧形成化合物所得溶液的颜色为 _____;⑧⑨形成氢化物的稳定性由强到弱顺序为_______________________________。
12.(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
A B C D
①ⅡA族元素的价电子数 。②第三周期元素的最高化合价 。
(2)A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知:A、B同周期,A、C 处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍。试回答:
①写出元素的名称:A______________、C_______________。
②写出由B、D组成的两种化合物的化学式分别为:____________、____________。
③C的固态氧化物化学式是__________。写出表示C的氧化物的一种重要的工业用途 __________________________________________________ 。
④A、C的最高价氧化物对应水化物中酸性较强的是__________(写水化物的分子式)。
⑤写出C的氧化物与D的最高价氧化物对应水化物反应的离子方程式:
3参考答案:
11.Na,Ar,HClO4,NaOH,Al(OH)3,
Al(OH)3+3H+==Al3++3H2O Al(OH)3+OH-==AlO2-+2H2O
12.(1)N,Si,S,Ca
(2)K,F,Ar
(3)HClO4,KOH,Al(OH)3,
3HClO4+Al(OH)3==Al(ClO4)3+3H2O,Al(OH)3+KOH==KAlO2+2H2O
HClO4+KOH==KClO4+H2O
(4)F,K
(5)Na,取少量Na、Mg分别投入冷水中,Na与冷水剧烈反应,Mg则很缓慢
Cl,在KBr溶液中滴入氯水,溶液变为橙色
13.(1)b
(2)ⅣA
(3)镁,bc
4参考答案:
11.(1)Ar,K
(2)KOH
(3)Cl->K+>Ca2+>Na+>Mg2+>Al3+
(4)H2O,2K+2H2O==2KOH+H2↑
(5)黄色,Cl2+2NaBr==Br2+2NaCl
(6)H++OH-==H2O Al(OH)3+3H+==Al3++3H2O Al(OH)3+OH-==AlO2-+2H2O
(7)2Mg+CO22MgO+C;橙红色;HCl>HBr
12.(1)①B ②C
(2)①硼、铝
②Na2O、Na2O2
③Al2O3。坩埚、耐火材料
④H3BO3
⑤Al2O3+2OH-==2AlO2-+H2O
苏教版 (2019)第一单元 元素周期律和元素周期表导学案及答案: 这是一份苏教版 (2019)第一单元 元素周期律和元素周期表导学案及答案,共15页。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应学案: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应学案,共3页。学案主要包含了学习目标,基础知识梳理等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表第2课时导学案及答案: 这是一份高中化学苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表第2课时导学案及答案,共11页。学案主要包含了元素周期表,元素周期表的应用等内容,欢迎下载使用。