高中化学第一单元 化学反应速率与反应限度教案设计
展开《第1课时 化学反应速率》
【阅读教材】P30 第1段
化学反应的本质:有新物质的生成
化学反应的规律:质量守恒、能量守恒、电荷守恒
化学反应的特征:化学反应还有快慢和进行程度之分
【新课导入】你了解下列化学变化过程(爆炸、溶洞的形成、铁生锈、牛奶变质)进行的快慢吗?化学反应的快慢与我们有什么关系呢?
“快慢”这个词在平时生活中也经常被说起,比如:刘翔跑的很快,蜗牛爬的很慢,那么我们是用什么术语来描述化学反应“快慢”的呢?如何描述?
一、化学反应速率
【教学目标】1.了解化学反应速率的含义及表示方法。能够进行化学反应速率的简单计算。
【阅读教材】P30 第2段,“观察与思考”,写出涉及的反应式:
石灰石溶洞的形成: CaCO3 +H2O+CO2=Ca(HCO3)2
合成氨工业:
酸碱中和反应: H++OH- = H2O
镁条与盐酸反应: Mg+2HCl = MgCl2+H2↑
铁片盐酸反应: Fe+2HCl = FeCl2+H2↑
【启发联想】
①钟乳石的形成,水垢的形成: Ca(HCO3)2 △ CaCO3↓+H2O+CO2↑
②“金属性强弱”的比较:与水或酸反应产生氢气的快慢
【阅读教材】P30第3段:
1.化学反应速率的含义及表示方法
(1)意义:表示化学反应进行 快慢程度 的物理量。
(2)定义:用单位时间内反应物浓度的减少或生成物浓度的增加来表示,
其常用单位是mol·L-1·min-1或mol·L-1·s-1 。
(3)公式:
【阅读教材】P30 第4段:2H2O2 △ 2H2O+O2↑
解:
或
【解题方式】“三段式”
【范例解析】
在一体积固定的密闭容器中加入N2和H2进行合成氨反应:N2+3H22NH3 。反应经2 min后,N2的浓度从开始时的1.0 mol·L-1降到0.8 mol·L-1 。已知反应开始时H2的浓度是1.2 mol·L-1 。求:
(1)2 min末H2、NH3 的浓度。
(2)以单位时间内N2的浓度的减小来表示2 min内该反应的平均速率。
解: N2 + 3H2 2NH3
起始 (mol·L-1): 1.0 1.2 0
2 min (mol·L-1): 0.8 0.6 0.4
改变 (mol·L-1): 0.2 0.6 0.4
∴ (1)c(H2)2min=0.6 mol·L-1 ,c(NH3)2min=0.4 mol·L-1
(2)
还可求出:
可得出结论:,即
(4)反应速率之比=化学方程式系数之比
(5)注意问题
①化学反应速率是指平均反应速率,而不是即时反应速率。
②虽然可以用单位时间内反应物浓度的减少量来表示反应速率,但化学反应速率均用正值表示。
③不同的化学反应具有不同的反应速率,其数值无可比性。
④在表示反应速率时必须指明以哪种物质为标准,否则这个速率的数值没有确定的含义。
比较化学反应速率快慢时应注意两点:
①单位是否一致,若不一致转化为同一单位。
②转化为同一物质表示的速率,再比较数值大小。
【范例解析】
(2010·海南高考)对于化学反应:3W(g)+2X(g) = 4Y(g)+3Z(g),下列反应速率关系中,
正确的是 ( )
A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
解:3W(g) + 2X(g) = 4Y(g) + 3Z(g)
3 2 4 3
v(W) v(X) v(Y) v(Z) 有:
【针对练习】
1.在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A+2B = 3C 。反应经2 min后,A的浓度从开始时的1.0 mol·L-1降到0.8 mol·L-1 。已知反应开始时B的浓度是1.2 mol·L-1 ,求:
(1)2 min末B、C的浓度。
(2)以单位时间内A的浓度的减小来表示2 min内该反应的平均速率。
【针对练习】
2.反应N2+3H2 2NH3,刚开始时,N2的浓度为3 mol·L-1,H2的浓度为5 mol·L-1,3min后测得NH3的浓度为0.6 mol·L-1,则此段时间内,下列反应速率表示正确的是( )
A.v(H2)=0.3mol·L·min-1 . B.v(N2)=1.0 mol·L·min-1
C.v(NH3)=0.2 mol·L-1·s-1 D.v(H2)=1.67 mol·L·min-1
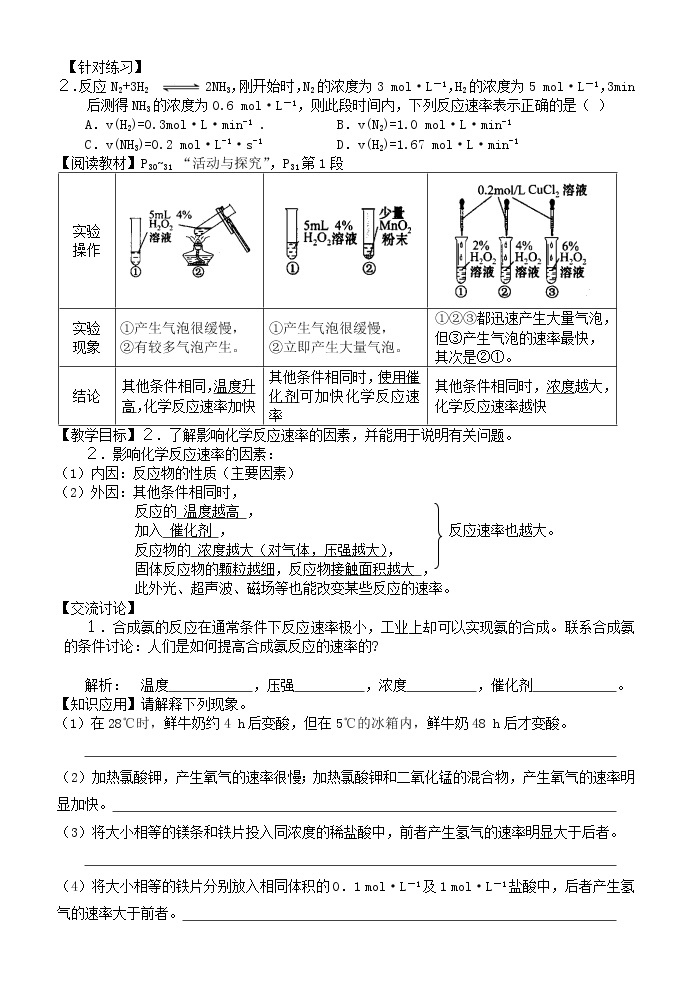
【阅读教材】P30~31 “活动与探究”,P31第1段
实验 操作 | |||
实验 现象 | ①产生气泡很缓慢, ②有较多气泡产生。 | ①产生气泡很缓慢, ②立即产生大量气泡。 | ①②③都迅速产生大量气泡, 但③产生气泡的速率最快, 其次是②①。 |
结论 | 其他条件相同,温度升高,化学反应速率加快 | 其他条件相同时,使用催化剂可加快化学反应速率 | 其他条件相同时,浓度越大,化学反应速率越快 |
【教学目标】2.了解影响化学反应速率的因素,并能用于说明有关问题。
2.影响化学反应速率的因素:
(1)内因:反应物的性质(主要因素)
(2)外因:其他条件相同时,
反应的 温度越高 ,
加入 催化剂 , 反应速率也越大。
反应物的 浓度越大(对气体,压强越大),
固体反应物的颗粒越细,反应物接触面积越大 ,
此外光、超声波、磁场等也能改变某些反应的速率。
【交流讨论】
1.合成氨的反应在通常条件下反应速率极小,工业上却可以实现氨的合成。联系合成氨的条件讨论:人们是如何提高合成氨反应的速率的?
解析: 温度 ,压强 ,浓度 ,催化剂 。
【知识应用】请解释下列现象。
(1)在28℃时,鲜牛奶约4 h后变酸,但在5℃的冰箱内,鲜牛奶48 h后才变酸。
(2)加热氯酸钾,产生氧气的速率很慢;加热氯酸钾和二氧化锰的混合物,产生氧气的速率明显加快。
(3)将大小相等的镁条和铁片投入同浓度的稀盐酸中,前者产生氢气的速率明显大于后者。
(4)将大小相等的铁片分别放入相同体积的0.1 mol·L-1及1 mol·L-1盐酸中,后者产生氢气的速率大于前者。
《第1课时 化学反应速率》练习
1.反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 在10L密闭容器中进行,半分钟后。水蒸气的物质的量增加了0.45 mol,则此反应的平均速率(x)(反应物的消耗速率或产物的生成速率)可表示为 ( )
A.( NH3)=0.010 mol·L-1·s-1 B.( O2)=0.0010 mol·L-1·s-1
C.( NO)=0.0010 mol·L-1·s-1 D.( H2O)=0.045 mol·L-1·s-1
2.(2008·17)对于反应2H2O2=2H2O+O2↑,下列措施不能增大化学反应速率的是( )
A.减小H2O2溶液的浓度. B.升高H2O2溶液的温度
C.向H2O2溶液中加入少量MnO2粉末 D.向H2O2溶液中加入一定浓度的FeCl3溶液
3.(2009·17)实验室用锌粒与2 mol/L 硫酸溶液制取氢气,下列措施不能增大化学反应速率的是 ( )
A.用锌粉代替锌 B.改用3mol/L硫酸溶液
C.改用热的2 mol/L硫酸溶液 D.向该硫酸溶液中加入等体积的水.
4.(2011·11)用下列方法制取氢气,反应速率最大的是 ( )
A.冬天,块状锌与2 mol/L硫酸溶液反应
B.冬天,粉末状锌2 mol/L硫酸溶液反应
C.夏天,块状锌与2 mol/L硫酸溶液反应
D.夏天,粉末状锌2 mol/L硫酸溶液反应.
5.下列各组反应(表中物质均为反应物)中,产生H2速率最快的是 ( )
编号 | 金属粉末/mol | 酸的浓度及体积 | 反应温度/℃ |
A | Mg,0.1 | 5mol/L盐酸10mL | 60 |
B | Mg,0.1 | 3mol/L盐酸10mL | 60 |
C | Fe,0.1 | 3mol/L盐酸10mL | 60 |
D | Mg,0.1 | 3mol/L盐酸10mL | 50 |
6.为了研究碳酸钙与稀盐酸反应的反应速率,某同学通过实验测定反应中生成的CO2气体体积随反应时间变化的情况,绘制出如图所示的曲线。请分析讨论以下问题。
(1)在O~t1、t1~t2、t2~t3各相同的时间段里,
收集到气体最多的是 时间段,
反应速率最大的是 时间段。
(2)在t4以后,为什么收集到的气体的体积不再增加?
(3)试分析三个时间段里,反应速率不同的可能原因
(该反应是放热反应)。
O~t1:盐酸浓度最 ,随着反应进行,浓度 ,
温度最 ,随着反应进行,反应放热,温度 ;
反应速率加快,此时 温度的升高 对反应起主要作用。
t1~t2:盐酸浓度继续 ,温度继续 ,反应速率最快,
此时 对反应起主要作用。
t2~t3:盐酸浓度继续 ,温度继续 ,反应速率减慢,
此时 对反应起主要作用。
《第2课时 化学反应的限度》
【教学目标】认识可逆反应有一定的限度,知道可逆反应在一定条件下能达到化学平衡状态。
【测试要求】设计实验证明某些化学反应的可逆性
【新课导入】我们已经知道,氯气溶解于水得到的氯水中既含有Cl2、、H2O分子,也含有H+、Cl-、HClO等微粒。这是由于Cl2能与H2O发生可逆反应:Cl2+H2OHCl+HClO,反应只能进行到一定限度。
二、化学反应的限度
1.可逆反应:(见《化学1》P43注释①)
在 相同条件下 下既能向 正反应 方向,又能向 逆反应 方向进行的反应。
学过的可逆反应有:
①Cl2+H2OHCl+HClO(《化学1》P43第2段)
②SO2+H2OH2SO3(《化学1》P89第2段)
③(《化学1》P89图4-1中)
④(《化学1》P98第1段)
⑤NH3+H2O NH3·H2O(《化学1》P99第1段)
【阅读教材】P32 “活动与探究”,P32第2、3段
【信息提示】 ①2Fe3+ + 2I-= 2Fe2+ + I2
② I2 遇 淀粉 显 蓝色 。
③ Fe3+ 与 SCN- 显 血红色 ,Fe3+ +3 SCN-== Fe(SCN)3
④CCl4可以萃取碘水中的I2, 下 层的 含I2的四氯化碳 层显 紫红色 。
【范例解析】
请设计实验证明反应2Fe3++2I-=2Fe2++I2的可逆性:
解:取一支试管,加入适量 FeCl3溶液;再加入过量的KI溶液,充分振荡;滴入KSCN溶液,溶液仍然出现血红色,证明还有Fe3+,该反应不能彻底进行,为可逆反应。
【阅读教材】P32 “交流与讨论”,P33第1、2段
2.化学反应的限度
(1)反应刚开始时,
反应物浓度 最大 ,正反应速率 最大 ,
生成物浓度为 0 ,逆反应速率为 0 。
(2)反应进行中,
反应物浓度逐渐 减小 ,正反应速率逐渐 减小 ,
生成物浓度逐渐 增大 ,逆反应速率逐渐 增大 。
(3)达到平衡时,
正反应速率与逆反应速率 相等 ,
反应物浓度 不再变化 ,生成物浓度也 不再变化 。
(1)化学平衡状态:正反应速率 等于 逆反应速率,各物质浓度 保持不变 的状态。
(2)化学平衡状态的特征和判断化学平衡状态的依据:
①v(正)=v(逆)≠0, ②各物质浓度保持不变。
(3)条件改变时,原化学平衡被破坏,一段时间后,达到新的平衡。
《第2课时 化学反应的限度》练习
1.下列关于反应速率的说法中,错误的是 ( )
A.反应速率用于衡量化学反应进行的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡状态,正、逆反应速率都为0
D.增大反应物的浓度,提高反应温度都能增大反应速率
2.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化.
3.(2010·14)对于工业合成氨反应:N2(g)+3H2(g) 2NH3(g),
下列说法错误的是 ( )
A.使用合适的催化剂可以加大反应速率
B.升高温度可以增大反应速率
C.增大N2浓度可以使H2化率达到100℅ .
D.增大N2浓度可以增大反应速率
4.(2012·21)N2+3H2 2NH3 是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是 ( )
A.增大N2浓度可以增大反应速率.
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.若反应在密闭容器中进行,N2和H2能100℅转化为NH3
5.下列各组反应中,属于可逆反应的一组是 ( )
A.2H2O 通电 2H2↑+O2↑, 2H2+O2 点燃 2H2O
B.NH3+CO2+H2O=NH4HCO3 ,NH4HCO3 △ NH3+CO2+H2O
C.H2+I2 △ 2HI, 2HI △ H2+I2
D.2Ag+Br2 CuO 2AgBr,2AgBr 光照 2Ag+Br2
6.下列对化学反应限度的叙述,错误的是 ( )
A.化学反应的限度不可改变 B.反应达到限度时,正逆反应速率相等
C.化学反应的限度与时间的长短无关 D.任何可逆反应都有一定的限度
7.为探究化学反应速率的有关问题,某研究小组进行了以下实验。以H2O2的分解为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | T/℃ | H2O2/mol·L-1 | H2O2/mL | MnO2/g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的研究 对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验 和实验 作对比。
(3)比较t1和t2,可以认识 对反应速率的影响。
高中化学鲁科版必修1第1节 元素与物质的分类教案设计: 这是一份高中化学鲁科版必修1第1节 元素与物质的分类教案设计,共4页。
高中化学鲁科版必修1第1节 元素与物质的分类教学设计: 这是一份高中化学鲁科版必修1第1节 元素与物质的分类教学设计,共3页。
高中化学鲁科版必修1第1节 元素与物质的分类教案: 这是一份高中化学鲁科版必修1第1节 元素与物质的分类教案,共3页。