

高中化学苏教版必修二专题3 有机化合物的获得与应用第二单元 食品中的有机化合物学案及答案
展开乙酸
班级_______学号_______姓名______________
[学习目标]
1、掌握乙酸的分子结构,理解羧基的结构特征,了解乙酸的物理性质,掌握乙酸的主要化学性质(酸性、跟醇发生酯化反应);
2、通过实验,培养学生的观察能力,加强基本操作训练,培养分析、综合的思维能力,通过碳酸、乙酸的酸性比较,提高分析比较常见酸的酸性强弱的能力;
3、通过乙酸在生活和生产的应用,了解有机物跟日常生活和生产的紧密联系,渗透化学重要性的教育。
[学海导航]
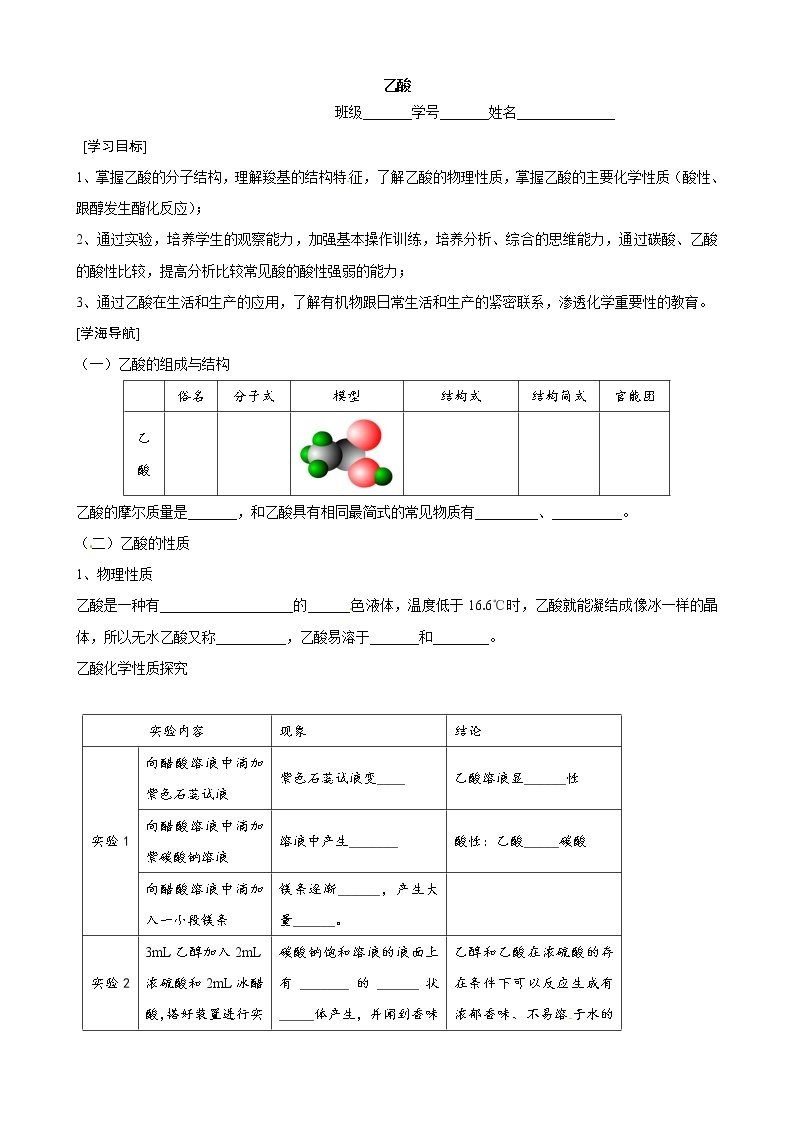
(一)乙酸的组成与结构
| 俗名 | 分子式 | 模型 | 结构式 | 结构简式 | 官能团 |
乙酸 |
|
|
|
|
|
乙酸的摩尔质量是_______,和乙酸具有相同最简式的常见物质有_________、__________。
(二)乙酸的性质
1、物理性质
乙酸是一种有___________________的______色液体,温度低于16.6℃时,乙酸就能凝结成像冰一样的晶体,所以无水乙酸又称__________,乙酸易溶于_______和________。
乙酸化学性质探究
实验内容 | 现象 | 结论 | |
实验1 | 向醋酸溶液中滴加紫色石蕊试液 | 紫色石蕊试液变____ | 乙酸溶液显______性 |
向醋酸溶液中滴加紫碳酸钠溶液 | 溶液中产生_______ | 酸性:乙酸_____碳酸 | |
向醋酸溶液中滴加入一小段镁条 | 镁条逐渐______,产生大量______。 |
| |
实验2 | 3mL乙醇加入2mL浓硫酸和2mL冰醋酸,搭好装置进行实验。 | 碳酸钠饱和溶液的液面上有_______的______状_____体产生,并闻到香味 | 乙醇和乙酸在浓硫酸的存在条件下可以反应生成有浓郁香味、不易溶于水的油状物质——_________。 |
2、乙酸的化学性质
(1)酸性
乙酸的电离方程式:______________________________________
乙酸与碳酸钠反应:_______________________________________
乙酸与碳酸钙反应:_______________________________________
说明:
①乙酸是______酸,是______电解质,但是酸性_______碳酸,具有酸的通性;
②乙酸显酸性,其实质是乙酸分子中________基电离出氢离子,是_______元酸。
(2)酯化反应
乙酸与乙醇在浓硫酸存在的条件下生成乙酸乙酯的反应
_______________________________________________________
说明:
①反应特点:
a、通常反应速率很低。
b、反应是可逆的。
②生成乙酸乙酯的条件及意义
a、加热。主要目的是提高反应速率,其次是使生成的乙酸乙酯挥发而收集,提高乙醇、乙酸的转化率。
b、浓硫酸作___________、___________。
③实验注意事项
a、 盛反应液的的试管要上倾45°,这样液体受热面积大。
b、试剂加入顺序为:乙醇、浓硫酸、乙酸;将浓硫酸加入乙醇中,要边加边振荡,为了防止混合产生的热量导致液体飞溅,冷却后再与乙酸混合,防止乙酸挥发。
c、导管起冷凝回流作用,防止未反应的乙酸和乙醇蒸发损失。且不伸入Na2CO3饱和溶液中,以防倒吸
d、实验中用小火加热保持微沸,这样有利于产物的生成与蒸出。
④实验中用饱和Na2CO3溶液吸收乙酸乙酯的优点
a、随着乙酸乙酯蒸发出来的乙酸与碳酸钠反应生成盐溶于水,乙醇溶于水,有利于乙酸乙酯与乙酸、乙醇的分离。
b、乙酸乙酯在无机盐溶液中溶解度减小,容易分层析出。
3、酯化反应
(1)概念:______和_______作用,生成______和水的反应叫做酯化反应。
(2)酯化反应的机理
如果用含同位素____的乙醇与乙酸作用,可发现,所生成的乙酸乙酯分子里含有____原子。
这就是说,酯化反应的一般过程是羧酸分子里的________,与醇分子里的___________结合生成水,期于部分生成________,酯化反应属于__________反应。
4、官能团和羧酸的介绍
(1)官能团的概念及实例:_____________________
(2)羧酸的通式及实例:______________________
(3)羧酸的通性
[学业测试]
一、选择题
1.可以说明乙酸的酸性比碳酸强的事实是 ( )
A.乙酸能以任意比混溶
B.乙酸能与碳酸钠溶液反应产生二氧化碳
C.1mol/L的乙酸能使紫色的石蕊试液变红色
D.乙酸能与乙醇反应生成乙酸乙酯
2.关于乙酸的下列说法中不正确的是 ( )
A.乙酸是一种重要的有机酸,是具有强烈刺激性气味的液体
B.乙酸分子里含有4个H原子,所以乙酸不是一元酸
C.无水乙酸又称冰醋酸,它是纯净物
D.乙酸易溶于水和乙醇
3.下列化合物分子中不含双键结构的是 ( )
A.乙醇 B.二氧化碳 C.乙酸 D.乙醛
4. 炒菜时,又加料酒又加醋,可使变得香美可口,原因是 ( )
A.有盐类物质生成 B.有酸类物质生成
C.有醇类物质生成 D.有酯类物质生成
5.下列每组中各有三对物质,它们都能用分液漏斗分离的是 ( )
A.乙酸乙酯和水;酒精和水;硝基苯和水
B.溴乙烷和水;溴苯和水;硝基苯和水
C.乙酸和水;乙酸乙酯和水;乙酸和乙醇
D.乙酸乙酯和水;甲苯和水;己烷和水
6.酯化反应是有机化学中的一类重要反应,下列对酯化反应理解不正确的是 ( )
A.酯化反应的产物只有酯 B.酯化反应可看成取代反应的一种
C.酯化反应是有限度的 D.浓硫酸可做酯化反应的催化剂
7.实验室用乙酸、乙醇、浓硫酸制取乙酸乙酯,应加热蒸馏,在饱和碳酸钠溶液的上面得到无色油状液体,当振荡混合液时,有气泡产生,原因是 ( )
A.产品中有被蒸馏出的硫酸 B.有部分未反应的乙醇被蒸馏出来
C.有部分乙醇与浓硫酸作用生成乙烯 D.有部分未反应的乙酸被蒸馏出来
8.若乙醇中的氧原子为 18O,它与乙酸反应生成酯的式量为 ( )
A.88 B.90 C.92 D.94
9.乙醇和乙酸乙酯组成的混合物中,若含碳的质量分数为54%,则此混合物中含氢的质量分数为 ( )
A.10.4% B.10% C.9.2% D.8.8%
10.A、B两种有机物组成的混合物,当混合物的质量相等时,无论A、B以何种比例混合,完全燃烧时产生CO2的质量都相等,符合这一条件的组合有:①同分异构体 ②同系物 ③具有相同的最简式 ④含碳的质量分数相同。其中正确的是 ( )
A.①②③ B.①③④ C.②③④ D.①②③④
二、填空题
11.写出乙酸分别与Na、NaOH、NaHCO3、CH3OH反应的化学方程式。
__________________________________________________________
___________________________________________________________
___________________________________________________________
___________________________________________________________
12.化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH 有香味的产物
(1)根据上述信息,对该化合物可作出的判断是_______(填序号)
A.一定含有—OH B.一定含有—COOH
C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用做__________________________________
(3)A与金属钠反应的化学方程式为:_________________________________________
13.Ⅰ.乙酸是生活中常见的有机物之一,乙酸的官能团为 (写名称)。用食醋浸泡有水垢(主要成分是CaCO3)的暖瓶或水壶,可以清除其中的水垢。写出该反应的方程式: 。
Ⅱ.在试管A中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
(1)试管B中盛放的溶液是____________________,
其作用是:_______________________________
(2)乙醇与乙酸反应的化学方程式是:
_________________________________________;
反应类型__________________
(3)实验完成后,试管B的液面上有透明的不溶于
水的油状液体产生。若分离B中的液体混合物
需要用到的玻璃仪器主要是 。
14.通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中含碳的质量分数为52.2%,含氢的质量分数为13.0%。已知X与高锰酸钾反应可生成Y,X与Y在浓硫酸存在下加热可生成一种有香味的物质Z,若184gX和120gY反应生成106gZ。
(1)X为____________、Y为____________、Z为_______________
(2)该反应的产率为________________
参考答案:
11.2CH3COOH+2Na→2CH3COONa+H2↑
CH3COOH+NaOH→2CH3COONa+H2O
CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑
CH3COOH+CH3OH2CH3COOCH3+H2O
12.(1)AC
(2)医疗用消毒剂
(3)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑
13.Ⅰ.羟基
2CH3COOH+CaCO3→(CH3COO)2Ca+H2O+CO2↑
Ⅱ.(1)饱和Na2CO3溶液,
除去乙酸、乙醇,降低乙酸乙酯的溶解度
(2)CH3COOH+CH3CH2OH2CH3COO CH2CH3+H2O
取代反应
(3)分液漏斗
14.(1)CH3CH2OH 、CH3COOH、CH3COO CH2CH3
(2)60.2%
化学必修 第二册第三节 乙醇与乙酸学案设计: 这是一份化学必修 第二册<a href="/hx/tb_c4000048_t4/?tag_id=42" target="_blank">第三节 乙醇与乙酸学案设计</a>,共5页。学案主要包含了课标要求,学业质量水平,学业要求,教学内容,实验7-4,实验7-5,学习目标,知识结构化等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸学案: 这是一份高中化学人教版 (2019)必修 第二册第三节 乙醇与乙酸学案,共6页。学案主要包含了课堂练习,特别提醒,总结提升等内容,欢迎下载使用。
高考化学 考点53 乙酸乙酯的制备学案(含解析): 这是一份高考化学 考点53 乙酸乙酯的制备学案(含解析),共6页。学案主要包含了乙酸乙酯的制备实验,如何辨析羧基和酯基等内容,欢迎下载使用。