人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质综合与测试教学设计
展开章末复习提升
专题一 化学键与物质类别的关系
1.只含非极性共价键的物质:同种非金属元素构成的单质,如:I2、N2、P4、金刚石、晶体硅等。
2.只含有极性共价键的物质:一般是不同非金属元素构成的共价化合物,如:HCl、NH3、SiO2、CS2等。
3.既有极性键又有非极性键的物质,如H2O2、C2H2、CH3CH3等。
4.只含有离子键的物质:活泼非金属元素与活泼金属元素形成的化合物,如:Na2S、CaCl2、K2O、NaH等。
5.既有离子键又有非极性键的物质,如:Na2O2、Na2Sx、CaC2等。
6.由离子键、共价键、配位键构成的物质,如:NH4Cl等。
7.由强极性键构成但又不是强电解质的物质,如:HF。
8.只含有共价键而无范德华力的化合物,如:原子晶体SiO2、SiC等。
9.无化学键的物质:稀有气体,如氩等。
10.共价键的分类
(1)配位键是一种特殊的共价键。
(2)根据共用电子对是否偏移,共价键分为极性键和非极性键。
(3)根据共用电子对数,共价键分为单键、双键、三键。
(4)根据原子轨道的重叠方式不同,可分为σ键(头碰头)和π键(肩并肩)。
典例1 有A、B、C、D四种元素,A元素是所有元素中原子半径最小的元素;B、C两种元素原子的核外电子层数相同,C元素的单质为深红棕色液体,B元素的最高价阳离子0.5 mol被还原成中性原子时,需得到6.02×1023个电子。当B元素的单质同盐酸充分反应时,放出0.02 g H2,用去B元素0.4 g;D元素的气态氢化物和最高价氧化物的水化物之间反应生成盐。
(1)各元素的名称分别为:A__氢____,B__钙____,C__溴____,D__氮____。
(2)用电子式表示A与C、B与C形成化合物的过程______、______,化学键类型分别为__共价键____、__离子键____。
(3)四种元素形成常见化合物中具有离子键、极性键、配位键的物质是__NH4Br____,电子式为______。
解析:(1)由题给条件可知,A元素是所有元素中原子半径最小的元素,只有H元素才符合此条件,故A为氢元素;由C元素形成的单质为深红棕色液体,应为溴,所以C为溴元素;又知B和C两种元素的原子核外电子层数相同,即B和C均为第四周期元素。设B元素的化合价为x,依题意有如下关系:1︰x=0.5︰1,x=2,所以B的化合价为+2价,通过化学方程式可计算得出B的相对原子质量为40,由此可知B为Ca。符合条件的D元素的气态氢化物必定为碱性气体NH3,故D元素为氮。
〔变式训练1〕 下列说法正确的是( C )
A.仅由非金属元素组成的化合物中不可能含有离子键
B.由金属元素和非金属元素组成的化合物一定是离子化合物
C.共价化合物中不可能含有离子键
D.含有金属阳离子的物质都是离子化合物
解析:NH4Cl等铵盐都是仅由非金属元素组成的化合物,其中含有离子键。NaCl、KOH等化合物由金属元素和非金属元素组成,它们都是离子化合物;AlCl3是由金属元素和非金属元素组成的,是共价化合物。金属单质都含有金属阳离子,它们不是化合物,更不是离子化合物。
专题二 杂化轨道理论、价层电子对互斥理论与分子立体结构的关系
1.杂化轨道类型与分子立体结构
杂化
轨道
理论
杂化
类型
杂化轨
道数目
杂化轨道
间夹角
分子的立
体构型
实例
sp
2
180°
直线形
BeCl2
sp2
3
120°
平面三角形
BF3
sp3
4
109.5°
四面体形
CH4
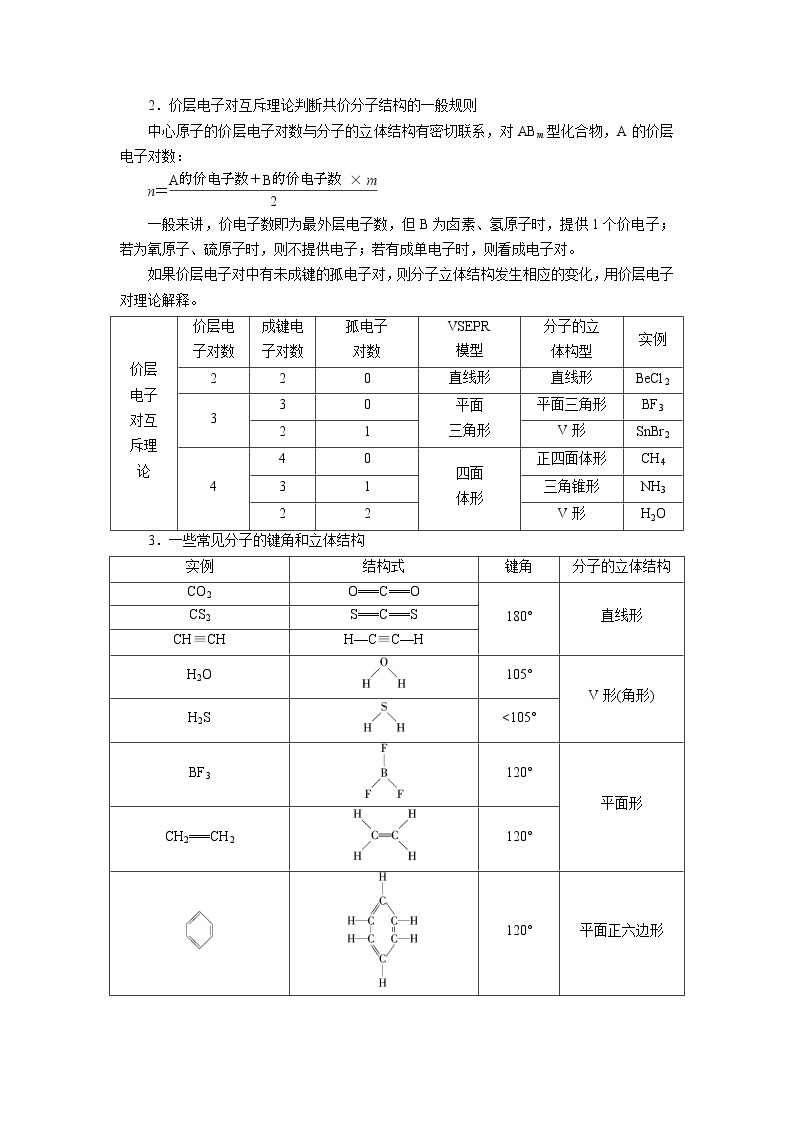
2.价层电子对互斥理论判断共价分子结构的一般规则
中心原子的价层电子对数与分子的立体结构有密切联系,对ABm型化合物,A的价层电子对数:
n=
一般来讲,价电子数即为最外层电子数,但B为卤素、氢原子时,提供1个价电子;若为氧原子、硫原子时,则不提供电子;若有成单电子时,则看成电子对。
如果价层电子对中有未成键的孤电子对,则分子立体结构发生相应的变化,用价层电子对理论解释。
价层
电子
对互
斥理
论
价层电
子对数
成键电
子对数
孤电子
对数
VSEPR
模型
分子的立
体构型
实例
2
2
0
直线形
直线形
BeCl2
3
3
0
平面
三角形
平面三角形
BF3
2
1
V形
SnBr2
4
4
0
四面
体形
正四面体形
CH4
3
1
三角锥形
NH3
2
2
V形
H2O
3.一些常见分子的键角和立体结构
实例
结构式
键角
分子的立体结构
CO2
O===C===O
180°
直线形
CS2
S===C===S
CH≡CH
H—C≡C—H
H2O
105°
V形(角形)
H2S
<105°
BF3
120°
平面形
CH2===CH2
120°
120°
平面正六边形
NH3
107°
三角锥形
P4
60°
正四面体形
CH4
109°28′
典例2 用价层电子对互斥理论推测下列分子或离子的空间构型。
(1)BeCl2 __直线形____;
(2)HCN __直线形____;
(3)NH __正四面体____;
(4)H3O+ __三角锥形____;
(5)H2O __V形____;
(6)NH3 __三角锥形____。
解析:首先计算中心原子的电子对(包括σ键电子对和孤电子对);其次依据“价层电子对互斥模型”,得到含有孤电子对的VSEPR模型;最后,略去中心原子上的孤电子对,即得到分子(或离子)的空间构型。
中心原子电子对数
VSEPR
模型
分子(离子)
空间构型
成键电
子对数
孤电子
对数
总电子
对数
BeCl2
2
0
2
直线形
直线形
HCN
4
0
4
四面体形
直线形(*)
NH
4
0
4
四面体形
正四面体
H3O+
3
1
4
四面体形
三角锥形
H2O
2
2
4
四面体形
V形
NH3
3
1
4
四面体形
三角锥形
(*)特别说明:HCN分子中C与N以共价三键结合,其结构式为H—C≡N,故分子的空间构型为直线形。
〔变式训练2〕 如图所示是甲醛分子模型的示意图。根据该图和所学的化学键知识回答下列问题:
(1)甲醛分子中碳原子轨道杂化的方式是__sp2杂化____,作出该判断的主要理由是__甲醛分子为平面三角形____。
(2)下列是对甲醛分子中碳氧键的判断,其中正确的是(用序号填空)__②③⑦____。
①单键 ②双键 ③极性键 ④非极性键 ⑤σ键
⑥π键 ⑦σ键和π键
(3)甲醛分子中C—H键与C—H键的夹角__<____(填“=”“>”或“<”)120°,出现该现象的主要原因是__碳氧双键中存在π键,它对C—H键电子对的排斥作用较强____。
解析:本题考查的是杂化轨道理论、价层电子对互斥模型、分子的立体结构与成键的类型、键参数等知识的综合运用。
(1)原子杂化轨道的类型不同,分子的立体结构也不同。由图可知,甲醛分子为平面三角形,所以甲醛分子中碳原子的杂化方式是sp2。
(2)碳与氧的电负性不同,所以碳氧键是极性键。醛的分子中都含有羰基(CO),所以甲醛分子中的碳氧键是双键。一般来说,双键是σ键和π键的组合。
(3)由于碳氧双键中存在π键,它对C—H键电子对的排斥作用较强,所以甲醛分子中C—H键与C—H键的夹角小于120°。
专题三 全面总结分子极性的判断方法
判断分子的极性,可以从正负电中心、对称性、分子的立体构型,键角、化合价、中心原子的孤电子对数、溶解牲等方面分析。
1.从正负电中心是否重合判断
正负电中心重合,为非极性分子;正负电中心不重合,为极性分子。
如SO3为平面正三角形结构,硫原子位于正三角形的中心,三个氧原子位于正三角形的三个顶点上,结构对称,正负电中心重合,因此SO3为非极性分子。
2.利用分子的对称性判断
当一个分子的对称元素(对称面、对称轴等)相交于一点时,该分子为非极性分子;当一个分子的对称元素相交于一条线时,该分子为极性分子。如甲烷分子的对称轴相交于中心碳原子上,所以甲烷分子为非极性分子。水分子、氨分子、一氧化碳分子的对称元素相交于一条线,所以这些分子为极性分子。
当中心原子指向不明时,需先预测它的结构,再判断其结构的空间对称性。如C5H12分子,若它的结构简式为C(CH3)4,把—CH3看成CH4分子中的—H,显然其为非极性分子;若它的结构为直链结构或其他带有支链的结构,则为极性分子。
3.从分子的立体构型判断
当多原子分子的结构呈直线形、平面正三角形、正四面体形时,该分子为非极性分子;否则为极性分子。如BeCl3、CO2、CS2分子呈直线形,SO3、BF3分子呈平面正三角形,CH4、CCl4、SiCl4等分子呈正四面体形,PCl5分子呈三角双锥形,它们都为非极性分子。H2O、SO2分子呈V形,NH3分子呈三角锥形,它们都为极性分子。
4.从键角判断
对多原子分子来说,当键角全部为180°、120°、109°28′时,为非极性分子;否则,为极性分子。如CO2、C2H2、BeCl2、CS2等,键角均为180°,SO3、BF3等,键角均为120°;CH4、CCl4等,键角均为109°28′。
5.从中心原子的化合价判断
不管中心原子是显正价还是显负价,只要其化合价的绝对值等于最外层电子数,该分子就为非极性分子;否则为极性分子。如CO2、CS2、BF3等,其中心原子的正化合价数值都与其最外层电子数相等,均为非极性分子;NH3分子中,H为+1价,N为-3价,中心原子N的最外层有5个电子,N的负化合价绝对值与其最外层电子数不等,NH3为极性分子。
6.从中心原子的孤电子对判断
当多原子分子中心原子的最外层电子全部参与成键,即不存在孤电子对时,为非极性分子;否则为极性分子。如CO2分子的中心原子C,最外层电子全部用于形成共价健,不存在孤电子对,CO2为非极性分子。SO2的中心原子S,最外层电子中存在1对孤电子对,SO2为极性分子。
7.从分子在某溶剂中的溶解性判断
根据“相似相溶”,极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。通过溶剂是否有极性,就可判断出分子是否有极性。如苯易溶于四氯化碳,而难溶于水,水为极性分子,而四氯化碳为非极性分子,则苯为非极性分子。
从以上各种方法的分析不难看出,虽然各种方法都能判断分子的极性,但真正容易操作的方法还是第5种。第7种方法须做实验,然后才能进行判断。其他5种方法,需在明确分子立体构型的前提下,才能进行分析和判断。
典例3 (1)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子。则A的电子式是__︰N⋮⋮N︰____;B的结构式是__H—C≡C—H____;C的名称是__一氧化碳____。
(2)1,2-二氯乙烯存在两种同分异构体, 其中属于极性分子的结构式是__A____(填字母编号,下同),属于非极性分子的结构式是__B____。
解析:(1)14个电子,且只有非极性键,只能为单质N2。14个电子,既有非极性键,又有极性键,则有两种元素,由等电子体想到C2H2,由C分子中有14个电子且属于极性分子知C为CO。
(2)正负电荷中心完全重合的为非极性分子,否则为极性分子。
〔变式训练3〕 下列说法中正确的是( D )
A.含有非极性键的分子一定是非极性分子
B.非极性分子中一定含有非极性键
C.等分子的立体构型都是对称的,它们都是非极性分子
D.只含有极性键的分子不一定是极性分子
解析:极性分子H2O2中含有非极性键,CO2是非极性分子但它只含有极性键,A、B两项错而D项正确;H2O分子中有对称轴但其立体构型是不对称的(四面体的分子中正电中心与负电中心不重合),是极性分子。
考纲要求 ☞
1.理解共价键的含义,能说明共价键的形成。
2.了解共价键的主要类型σ键和π键,能用键能、键长、键角等数据说明简单分子的某些性质(对σ键和π键之间的相对强弱的比较不作要求)。
3.了解键的极性和分子的极性,了解极性分子和非极性分子的某些性质差异。
4.了解“等电子原理”的含义,能结合实例说明等电子原理的应用。
5.能根据杂化轨道理论和价层电子对互斥模型判断简单分子或离子的空间构型(对d轨道参与杂化和AB5型以上复杂分子或离子的空间构型不作要求)。
6.了解简单配合物的成键情况。
7.知道分子间作用力的含义,了解化学键和分子间作用力的区别。
8.了解氢键的存在对物质性质的影响(对氢键相对强弱的比较不作要求)。
Z
1.(2018·全国卷Ⅰ)Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是__正四面体____、中心原子的杂化形式为__sp3____。
LiAlH4中,存在__A、B____(填标号)。
A.离子键 B.σ键
C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的Born-Haber循环计算得到。
可知,Li原子的第一电离能为__520____kJ·mol-1,O===O键键能为__498____kJ·mol-1,Li2O晶格能为__2 908____kJ·mol-1。
解析:(3)LiAlH4中的阴离子是AlH,中心原子铝原子含有的价层电子对数是4,且不存在孤对电子,所以空间构型是正四面体,中心原子的杂化轨道类型是sp3杂化;阴、阳离子间存在离子键,Al与H之间还有共价单键,不存在双键和氢键,答案选A、B。
(4)根据示意图可知Li原子的第一电离能是1 040 kJ·mol-1÷2=520 kJ·mol-1;0.5 mol氧气转化为氧原子时吸收249 kJ热量,所以O===O键能是249 kJ·mol-1×2=498 kJ·mol-1;根据晶格能的定义结合示意图可知Li2O的晶格能是2 908 kJ·mol-1。
2.(2018·全国卷Ⅱ)硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S
S8
FeS2
SO2
SO3
H2SO4
熔点/℃
-85.5
115.2
>600
(分解)
-75.5
16.8
10.3
沸点/℃
-60.3
444.6
-10.0
45.0
337.0
回答下列问题:
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的__H2S____。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__S8相对分子质量大,分子间范德华力强____。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为__平面三角____形,其中共价键的类型有__2____种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__sp3____。
解析:(2)根据价层电子对互斥理论,H2S、SO2、SO3的σ键电子对数分别为:2、2、3,其中心原子上的孤电子对数分别为×(6-2×1)=2,×(6-2×2)=1,×(6-3×2)=0,故三者中心原子价层电子对数分别为2+2=4,2+1=3,3+0=3,因此中心原子价层电子数不同于其他分子的是H2S。
(3)S8与SO2均为分子晶体,而S8相对分子质量大,因此分子间范德华力强,所以其熔沸点比SO2高。
(4)根据价层电子对互斥理论,SO3中心原子价层电子对数为3,孤电子对数为0,因此分子为平面三角形。分子中存在σ键和π键,其中π键为大π键。根据图(b)可以得出固体三氧化硫中SO4原子团,为四面体构型,因此S原子的杂化轨道类型为sp3。
3.(2018·江苏卷)臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO和NO,NOx也可在其他条件下被还原为N2。
(1)SO中心原子轨道的杂化类型为__sp3____;NO的空间构型为__平面(正)三角形____(用文字描述)。
(2)Fe2+基态核外电子排布式为__[Ar]3d6或1s22s22p63s23p63d6____。
(3)与O3分子互为等电子体的一种阴离子为__NO____(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__1∶2____。
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
答案:
解析:(1)SO中S的孤电子对为=0,价层电子对数为0+4=4,则S为sp3杂化。NO中N的孤电子对为=0,价层电子对数为0+3=3,则S为sp2杂化,则NO为平面三角形。(2)Fe为26号,价层电子数为26-18=8,电子排布式为[Ar]3d64s2,Fe2+为Fe失去2个电子,先失最外层4s上面的2个电子,则Fe2+的电子排布式为[Ar]3d6。(3)比O少一个价电子的是N,则NO与O3互为等电子体。(4)N2的结构式为N≡N,叁键中有一个为σ键,两个为π键,n(σ)∶n(π)=1∶2。(5)由题中信息知NO中N与Fe2+形成配位键,4个水分子与Fe2+形成配位键,结构式中还缺少1个水分子,H2O中的O中存在孤对电子,可以与Fe2+形成配位键。
4.(2017·新课标Ⅲ卷)研究发现,在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(2)CO2和CH3OH分子中C原子的杂化形式分别为__sp____和__sp3____。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为__H2O>CH3OH>CO2>H2____,原因是__水含氢键比甲醇中多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大____。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在__离子键、π键(或π键)____。
解析:(2)根据价层电子对互斥理论,CO2为直线形分子,C原子为sp杂化,而CH3OH中C原子的空间构型为四面体,sp3杂化;
(3)影响分子晶体沸点的因素有范德华力和氢键,H2O与CH3OH均为极性分子,H2O中氢键比甲醇多,故H2O的沸点高,CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力大,沸点更高。
(4)Mn(NO3)2为离子化合物,Mn2+ 与NO之间是离子键,根据NO的结构式,N与O之间存在双键,故除了σ键还存在π键。
5.(2018·全国卷Ⅲ)锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是__离子键____;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是__ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主、极性较小____。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为__平面三角形____,C原子的杂化形式为__sp2____。
解析:(3)ZnF2具有较高的熔点(872 ℃),ZnF2为离子晶体,故含有离子键;根据ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,可推知ZnCl2、ZnBr2、ZnI2为分子晶体,含有共价键,分子极性较小。
(4)ZnCO3中,阴离子CO中σ键=3,孤电子对数=(4+2-3×2)=0
所以价电子对数=3+0=3,CO空间构型为平面三角形,碳原子的杂化形式为sp2。
第二章 学业质量标准检测
(90分钟,100分)
一、选择题(本题包括17个小题,每小题3分,共51分)
1.下列关于σ键和π键的理解不正确的是( C )
A.σ键一般能单独形成,而π键一般不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.CH3—CH3、CH2===CH2、CH≡CH中σ键都是C—C键,所以键能都相同
D.碳碳双键中有一个σ键,一个π键,碳碳三键中有一个σ键,两个π键
解析:σ键可以单独形成,且可以绕键轴旋转,而π键不能单独形成也不能绕键轴旋转,A、B两项正确;C项三种物质中σ键为C—C键和C—H键,错误。
2.下列对HCl、Cl2、H2O、NH3、CH4这组分子中共价键形成方式的分析正确的是( A )
A.都是σ键,没有π键 B.都是π键,没有σ键
C.既有π键,又有σ键 D.除CH4外,都是σ键
解析:题中各分子的结构式分别为H—Cl、Cl—Cl、H—O—H、,分子中各原子之间均为单键,则都是σ键,没有π键。
3.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( B )
A.CCl4、SiCl4、SiH4
B.H2S、NF3、CH4
C.BCl3、CH2===CHCl、环己烷
D.SO3、C6H6(苯)、CH3C≡CH
解析:A项,中心原子都是sp3杂化,其键角相同;B项,中心原子都是sp3杂化,孤电子对数不同,分子的键角不相同;C项,三氯化硼和氯乙烯的中心原子都是sp2杂化,环已烷中碳原子为sp3杂化;D项,三氧化硫和苯的中心原子为sp2杂化,而丙炔中碳原子为sp和sp3杂化。
4.下列物质中都存在离子键、极性键和配位键的是( B )
A.氢氧化钠、过氧化钠、硫酸四氨合铜[Cu(NH3)4]SO4、氢化钠
B.硝酸铵、氢化铵、氢氧化二氨合银[Ag(NH3)2]OH、硫酸铵
C.硫酸、氢氧化钠、氮化钙、氢氧化钡
D.氯化铵、氢氧化钠、双氧水、过氧化钙
解析:铵离子中存在极性共价键和配位键,氨分子中氮原子上有孤电子对,H+、Cu2+、Ag+有空轨道,能形成配位键。A项,只有硫酸四氨合铜中含有离子键、共价键和配位键,A项错误;C项和D项中都不含配位键,C和D项错误。
5.用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。R分子的路易斯结构式可以表示为。则以下叙述错误的是( B )
A.R为三角锥形 B.R可以是BF3
C.R是极性分子 D.键角小于109°28′
解析:A.在中含有3个单键和1对孤电子对,价层电子对数为4,空间上为三角锥形,故A正确;B.B原子最外层含有3个电子,BF3中B原子形成3个共价键,B原子没有孤电子对,所以R不是BF3,故B错误;C.由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,R分子的结构不对称,R是极性分子,故C正确;D.三角锥形分子的键角为107°,键角小于109°28′,故D正确。
6.在化学中,常用一条短线表示一个化学键,如下图所示的物质结构中,虚线不表示化学键或分子间作用力的是( C )
解析:A选项中的虚线表示石墨结构中层与层之间存在的范德华力。C选项中的实线表示CCl4分子中实际存在的C—Cl共价键,虚线表示四个成键的氯原子相连时在空间形成的正四面体。B、D两项中的虚线表示共价键。
7.下列分子的立体构型用sp2杂化轨道来解释的是( A )
①BF3 ②CH2===CH2 ③ ④CH≡CH ⑤NH3
⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
解析:sp2杂化轨道形成夹角为120°的平面三角形,①BF3为平面三角形且B—F键角为120°;②CH2===CH2中的碳原子以sp2杂化,且未杂化的2p轨道形成π键;③同②相似;④乙炔中的碳原子为sp杂化;⑤NH3中的氮原子为sp3杂化;⑥CH4中的碳原子为sp3杂化。
8.Co(Ⅲ)的八面体配合物CoClm·nNH3,若1 mol该配合物与AgNO3作用生成1 mol AgCl沉淀,则m、n的值是( B )
A.m=1,n=5 B.m=3,n=4
C.m=5,n=1 D.m=4,n=5
解析:由1 mol配合物生成1 mol AgCl,知道1 mol配合物电离出1 mol Cl-即配离子显+1价,故外界有一个Cl-。又因为Co显+3价,所以[CoClm-1·nNH3]+中有两个Cl-,所以m=3,又因为+3价Co需要6个配体,n=6-2=4。
9.(2018·宁夏石嘴山月考)下列分子或离子中键角由大到小排列的是 ( B )
①BCl3 ②NH3 ③H2O ④PCl ⑤BeCl2
A.⑤④①②③ B.⑤①④②③
C.④①②⑤③ D.③②④①⑤
解析:根据价层电子对理互斥理论可知:BCl3价层电子对数为3,无孤电子对,所以为平面三角形结构,键角为120°;NH3价层电子对数为4,有一个孤电子对,排斥力较小,故为三角锥形结构,键角为107.3°;H2O价层电子对数为4,有2个孤电子对,排斥力较大,故为V形结构,键角为104.5°,PCl价层电子对数为4,无孤电子对,故结构为正四面体,键角为109°28′;BeCl2价层电子对数目为2,无孤电子对,故为直线型结构,键角为180°。所以键角的大小顺序为:BeCl2>BCl3>PCl>NH3>H2O,所以B正确。正确答案为B。
10.原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+l价离子比M的-1价离子少8个电子。根据以上叙述,下列说法中正确的是( C )
A.上述元素的原子半径大小为W
C.元素W与氢形成的原子个数比为1∶1的化合物有很多种
D.X与Y可形成含有非极性共价键的共价化合物
解析:原子序数依次增大的短周期元素W、X、Y、Z和M中,W的最外层电子数为其周期数的2倍,则W只能有2个电子层,最外层电子数为4,故W为碳元素;X和Z的A2B型氢化物均为V形分子,X为氧元素,Z为硫元素;Y的+1价离子比M的-1价离子少8个电子,Y为钠元素,M为氯元素。同周期元素随原子序数增大原子半径减小,同主族元素电子层数越多原子半径越大,故原子半径:Na>S>Cl>C>O,即X
A.离子键、配位键
B.非极性共价键、配位键
C.极性共价键、非极性共价键
D.极性共价键、配位键
解析:配离子[TiCl(H2O)5]2+中含有非金属原子之间的极性共价键以及配位键,其中钛元素的配位体是H2O、Cl-,答案选D。
12.下列说法正确的是( B )
A.HF、HCl、HBr、HI的熔、沸点依次升高
B.H2O的熔、沸点大于H2S是由于H2O分子之间存在氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
解析:HF分子间存在氢键,其沸点反常,A错;乙醇分子与水分子之间不只存在范德华力,还存在氢键,C错;D中的酸性强弱排列顺序反了。
13.根据等电子原理判断,下列说法中错误的是( B )
A.B3N3H6分子中所有原子均在同一平面上
B.B3N3H6分子中存在双键,可发生加成反应
C.H3O+和NH3是等电子体,均为三角锥形
D.CH4和NH是等电子体,均为正四面体形
解析:等电子原理是指具有相同价电子总数和相同原子总数的分子或离子具有相似的结构特征。苯是B3N3H6的等电子体,因此,它们的结构相似。苯分子中所有的原子均在同一平面上,苯分子中不存在双键,B错误。H3O+和NH3是等电子体,NH3是三角锥形,则H3O+也是三角锥形。CH4和NH是等电子体,CH4是正四面体形,所以NH也是正四面体形。
14.下列说法中正确的是( A )
A.ABn型分子中,若中心原子没有孤对电子,则ABn为空间对称结构,属于非极性分子
B.水很稳定是因为水中含有大量的氢键所致
C.H2O、NH3、CH4分子中的O、N、C分别形成2个、3个、4个键,故O、N、C原子分别采取sp、sp2、sp3杂化
D.配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO,配位数是1
解析:依据判断极性分子和非极性分子的经验规律可知A项正确;H2O很稳定是因为H—O键键能大,B项错误;在NH3、H2O、CH4中N、O、C均采取sp3杂化,只不过NH3、H2O分子中孤电子对占据着杂化轨道,C项错误;[Cu(H2O)4]SO4中配位体是H2O,配位数是4,D项错误。
15.有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层上有两个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p亚层上有一个空轨道;Q原子的L电子层的p亚层上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是( C )
A.元素Y和Q可形成一种化合物Y2Q3
B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强,是因为前者的非羟基氧原子数目大于后者
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是极性键构成的非极性分子
解析:X的电子排布式为1s22s22p63s23p4,为S元素;Y的电子排布式为1s22s22p63s23p63d64s2,为Fe元素;Z的电子排布式为1s22s22p2,为C元素;Q的电子排布式为1s22s22p4,为O元素;T的电子排布式为1s22s22p63s23p3,为P元素。C项中,X与Q形成的化合物SO2或SO3都为共价化合物,故C项不正确。
16.下列说法中,不正确的是( C )
A.N2O与CO2、CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.H2CO3与H3PO4的非羟基氧原子数均为1,二者的酸性(强度)非常相近
D.由ⅠA族和ⅥA族元素形成的原子个数比为1︰1、电子总数为38的化合物,是含有共价键的离子化合物
解析:N2O与CO2的原子数相同,电子数相同,CCl3F与CCl2F2的原子数相同,原子的最外层电子数之和相同,它们都是等电子体;CCl2F2无同分异构体,说明它是立体结构而不是平面结构,则碳原子采用sp3杂化方式;由于CO2与H2O的化合程度小,H2CO3的酸性比H3PO4弱得多,C错;D项中的物质指的是Na2O2,它是含有(非极性)共价键的离子化合物。
17.下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
下列说法正确的是( C )
A.沸点A2D
C.C形成的单质中σ键与π键个数之比为1∶2
D.B、C、D形成的气态氢化物互为等电子体
解析:根据各元素在周期表中的位置知,A为氢、B为碳、C为氮、D为氧、X为硫、Y为氯。A2D为H2O、A2X为H2S,H2O能形成氢键,故沸点H2O>H2S,A项错误;CA3为NH3是极性分子,B项错误;N2中有1个σ键2个π键,C选项正确;B、C、D的氢化物分别是CH4、NH3、H2O,微粒中原子数不同,不能互为等电子体,D项错误。
二、非选择题(本题包括5小题,共49分)
18.(2018·潍坊二模,35)Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为__3s23p63d5____,其核外共有__23____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是__Fe3+的电子排布为[Ar]3d5,3d轨道为半充满状态,比Fe2+电子排布[Ar]3d6更稳定____。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为__Br>Se>As____(用元素符号表示),SeO2分子的空间构型为__V形____。
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__sp3____,每个P4S3分子中含孤电子对的数目为__10____。
19.(2018·黑龙江哈尔滨一模)CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5; [Cu(NH3)2]Ac溶液用于除去CO的化学反应方程式:[Cu(NH3)2]Ac+CO+NH3===[Cu(NH3)3] Ac·CO (式中Ac代表醋酸根)。请回答下列问题:
(1)C、N、O的第一电离能最大的是__N____,原因是__N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能____。基态Fe 原子的价电子排布图为__ ____。
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是__C或碳____,羰基铁的结构如下图,根据该图可知CO作为配位体是以__Cu2+的半径小且所带电荷多、水化能大____原子为配位原子与Fe原子结合。
(3)离子水化能是气态离子溶于大量水中成为无限稀释溶液时释放的能量。离子在溶液中的稳定性可以从离子的大小、电荷、水化能等因素来解释。Cu2+和Cu+的水化能分别是-2 121 kJ·mol-1和-582 kJ·mol-1,在水溶液里Cu2+比Cu+稳定的原因是__sp3____。[Cu(NH3)2]+在水溶液中相对稳定,在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是__sp2____。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定能形成__bd____。
a.离子键 B.配位键
C.非极性键 D.σ键
解析:(1)同一周期元素,元素电负性随着原子序数增大而增大,但是N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能,所以这三种元素第一电离能为:N >O>C;铁原子的3d、4s能级为其价电子,基态铁原子的价电子排布为3d64s2,排布图为;正确答案:N;N的2p能级为半满稳定状态,能量低,第一电离能高于同周期相邻元素第一电离能;。
(2)根据羰基铁的常温下为黄色油状液体,说明沸点低,为分子晶体;根据羰基铁的结构图,可知CO作为配位体是以C原子为配位原子与Fe原子结合;正确答案:分子晶体;C或碳。
(3)Cu2+和Cu+的水化能分别是-2 121 kJ·mol-1和-582 kJ·mol-1,水化能越小,放出的热量越多,该离子越稳定,并且Cu2+半径比Cu+小,带电荷多,所以Cu2+比Cu+稳定;在配合物[Cu(NH3)2]Ac中碳原子的杂化类型是sp3、sp2;正确答案:Cu2+的半径小且所带电荷多、水化能大 ;sp3、sp2。
(4)用[Cu(NH3)2]Ac除去CO的反应中,肯定有铜原子与氮原子、碳原子之间形成的配位键且也是σ键生成;正确选项bd。
20.(10分)X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。
请回答下列问题:
(1)X、Y的元素符号依次是__S____、__C____。
(2)XZ2与YZ2分子的立体构型分别是__V形____和__直线形____,相同条件下两者在水中的溶解度较大的是__SO2____(写分子式),理由是__CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大_____。
(3)Q的元素符号是__Cr____,它属于第__4____周期,它的核外电子排布式为__1s22s22p63s23p63d54s1____,在形成化合物时它的最高化合价为__+6____。
(4)Y、Z、E三种元素原子的第一电离能由大到小的顺序是__F>O>C____。(用元素符号表示)
解析:(1)X原子核外的M层中只有两对成对电子,其外围电子排布应为3s23p4,可推得该元素为硫元素;Y原子核外的L层电子数是K层的两倍,K层有2个电子,则L层应有4个电子,该原子核外有6个电子,应为碳元素。
(2)地壳内含量最高的元素是氧元素,故Z元素应为氧元素,XZ2是SO2,YZ2是CO2,分子空间结构是由价层电子对互斥模型得出的。(3)Q的核电荷数是X与Z的核电荷数之和,所以Q的核电荷数为24,应为铬元素。(4)E在元素周期表的各元素中电负性最大,应为氟元素。同一周期从左到右元素的第一电离能呈增大的趋势。
21.(2018·广东梅州二模)2017年5月海底天然气水合物(俗称“可燃冰”)试采成功,这是我国能源开发的一次历史性突破。一定条件下,CH4和CO2都能与H2O形成如下图所示的笼状结构(表面的小球是水分子,内部的大球是CH4分子或CO2分子;“可燃冰”是CH4与H2O形成的水合物),其相关参数见下表。
参数
分子
分子直径/nm
分子与H2O的结合能E/kJ·mol-1
CH4
0.436
16.40
CO2
0.512
29.91
(1)CH4和CO2 所含的三种元素电负性从大到小的顺序为__O>C>H____;碳原子的最高能级的符号是__2p____,其电子云形状是__哑铃形____。
(2)CO2分子中碳原子的杂化轨道类型为__sp____,分子的立体构型为__直线型____。CO2与SO2相同条件下在水中的溶解度较大的是SO2,理由是__SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大____。
(3)为开采海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是__CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4____。
(4)“可燃冰”中分子间存在的作用力是氢键和__范德华力____,上图中最小的环中连接的原子总数是__10____。
解析:(1)一般来说,元素的非金属性越强,电负性越强,所以顺序为:O>C>H。碳为第6号元素,原子核外有6个电子,其最高能级为2p。p电子云的形状是哑铃形。
(2)根据价层电子对互斥理论,CO2的中心原子C的价电子对为2+(4-2×2)=2对,所以CO2的空间构型为直线型,C的杂化类型为sp杂化。CO2为直线型分子,所以
是非极性分子,而SO2为折线形,所以是极性分子,根据相似相溶的原理,SO2在极性溶剂(水)中的溶解度更大。
(3)已知上图中笼状结构的空腔直径为0.586 nm,根据上述图表,得到CO2分子的直径小于空腔直径,可以嵌入笼状结构中,同时二氧化碳与水分子的结合能高于甲烷,说明二氧化碳更易于与水结合,有可能将已经嵌入笼中的甲烷置换出来。
(4)分子之间存在的力除氢键以外,只可能是范德华力。图中最小的环是由5个水分子通过氢键构成的,其结构为,其中虚线代表氢键,实线代表共价键,所以最小的环中连接的原子为10个。
22.(2018·广东揭阳三中一模)太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等。回答下列问题:
(1)二价铜离子的电子排布式为__1s22s22p63s23p63d9____。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释:__亚铜离子价电子排布式为3d10,亚铜离子核外电子处于稳定的全充满状态____。
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:__F的电负性比N大,N-F成键电子对偏向F,导致NF3中氮原子核对其孤电子对的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子____。
(3)铜与类卤素(SCN)2反应生成Cu(SCN)2,1 mol (SCN)2中含有π键的数目为__4NA____,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H—S—C≡N )的沸点低于异硫氰酸(H—N=C=S)的沸点。其原因是__异硫氰酸分子间可形成氢键,而硫氰酸不能____。
(4)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3。在BF3·NH3中B原子的杂化方式为__sp3____,B与N之间形成配位键,氮原子提供__孤电子对____。
高中化学人教版 (新课标)选修3 物质结构与性质第一节 原子结构教案设计: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第一节 原子结构教案设计,共33页。
人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第四节 离子晶体教案设计: 这是一份人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质第四节 离子晶体教案设计,共16页。
高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质综合与测试教案及反思: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第三章 晶体结构与性质综合与测试教案及反思,共28页。