





高中化学人教版 (2019)必修 第一册第二节 离子反应优质课件ppt
展开公元225年,诸葛亮为了擒拿南王孟获,率军南征至云南西洱河,遇四口毒泉,其中一口为“哑泉”。时逢天气好生炎热,士兵引用了哑泉泉水后,一个个说不出话来。后来的一智者指教,复饮“安乐泉”泉水,“随即吐出恶涎,便能言语”。
【原因】原来哑泉水中含有较多的硫酸铜,导致铜盐中毒,致哑、呕吐、腹泻、最后虚脱、痉挛致死。 而安乐泉水中含有较多的碱,其中的碱会在肠胃中与硫酸铜发生离子反应: Cu2+ + 2OH- = Cu(OH)2↓ 使人体吸收的可溶性铜盐变成不溶性的Cu(OH)2沉淀而被排出,因此有解毒作用。
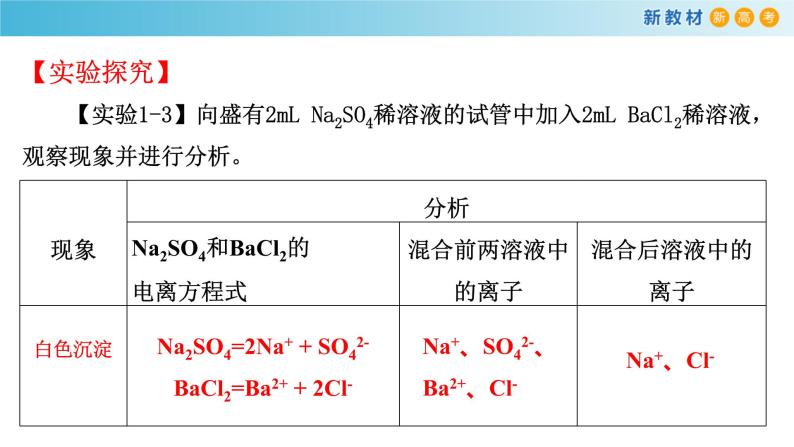
【实验1-3】向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液,观察现象并进行分析。
Na2SO4=2Na+ + SO42-BaCl2=Ba2+ + 2Cl-
Na+、SO42-、Ba2+、Cl-
实验中产生了白色沉淀,说明Ba2+ 和SO42- 发生反应,生成了BaSO4沉淀。这种离子间的反应,叫做离子反应。
2.离子反应:有_____参加或有_____生成的化学反应。
在水溶溶液中的离子反应的类型除了复分解反应之外还有很多,如有离子参加的置换反应等。
知识点二 离子方程式1.概念:用实际参加反应的__________来表示反应的式子。
2.离子方程式的书写步骤:
(1)写出化学方程式:Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
(2)将易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
离子方程式来自于化学方程式,首先应该正确书写化学方程式。
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
2Na+ + SO42-
Ba2+ + 2Cl-
2Na+ + 2Cl-
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
电解质的拆分原则:①能够进行拆分的只有易溶易电离的物质(强酸、强碱和大多数可溶盐)。②拆分时应该按照电离方程式的形式进行拆分,注意方程式中的系数。③其余不能拆分的物质不变,注意反应条件和沉淀、气体符号都不能改变。
离子方程式的书写步骤:
(2)将易溶于水且易电离的物质拆写成离子形式,其余物质仍以化学式表示:
(3)删去方程式两边不参加反应的离子,并将方程式化成最简:
SO42- + Ba2+ = BaSO4↓
(4)检查离子方程式两边各元素的原子个数和电荷总数是否相等:
2- + 2+ = 0
例:写出碳酸钙与盐酸反应的离子方程式
CaCO3 + 2HCl == CaCl2 + CO2↑ + H2O
CaCO3+2H+ +2Cl- == Ca2++2Cl-+ CO2↑ +H2O
CaCO3+2H+ == Ca2++CO2 ↑ +H2O
检查方程式两边各元素、原子个数和电荷数是否守恒。
小结: 四步中,“写”是基础,“拆”是关键,“删”是途径,“查”是保证。
四个不同的强酸强碱之间的中和反应,化学方程式不同
实质都是溶液中的H+和OH-的反应,离子方程式相同
强酸: HCl、H2SO4、HNO3
强碱:NaOH、KOH、Ba(OH)2
可溶性的盐:钾、钠、铵盐;硝酸盐等。
【特别提醒】(1)可拆物质(易溶易电离)
KCl K2SO4 KNO3 K2CO3NaCl Na2SO4 NaNO3 Na2CO3NH4Cl (NH4)2SO4 NH4NO3 (NH4)2CO3NaNO3 NH4NO3 AgNO3 Cu(NO3)2
单质:Fe、Zn、Cl2等
弱酸:H2S、CH3COOH、H2SO3等
弱碱:Cu(OH)2、Mg(OH)2 、NH3·H2O等
难溶性盐:AgCl 、 CaCO3、BaSO4等
氧化物:H2O、CO2、CaO等
1.H++OH-==H2O能表示所有的强酸和强碱发生的中和反应吗?
【提示】不能,H2SO4和Ba(OH)2的反应不能用该式表示。
2.能使紫色石蕊试液变红的溶液中CO32-能大量存在吗?
【提示】不能,使紫色石蕊试液变红的溶液显酸性,H+会与CO32-发生反应。
【特别提醒】判断离子方程式正误的两易、两等、两查
必修 第一册第一章 物质及其变化第二节 离子反应一等奖ppt课件: 这是一份必修 第一册<a href="/hx/tb_c161973_t3/?tag_id=26" target="_blank">第一章 物质及其变化第二节 离子反应一等奖ppt课件</a>,共35页。PPT课件主要包含了考纲要求,SO42-和Ba2+,离子反应,二离子方程式的书写,Cl-,CO2,H2O,三离子共存等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教学课件ppt,共29页。PPT课件主要包含了学习目标,Cl-等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应完美版ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应完美版ppt课件,共28页。PPT课件主要包含了学习目标,情境思考,实验探究,出现白色沉淀,实验分析,离子反应,Na+Cl-,Na2SO4,BaCl2,Na+等内容,欢迎下载使用。













