





高中化学第二节 离子反应优质ppt课件
展开【考纲要求】1.了解离子反应的概念、离子反应 发生的条件。2.能正确书写离子方程式,并能进行 有关计算。3.能正确判断离子能否大量共存。
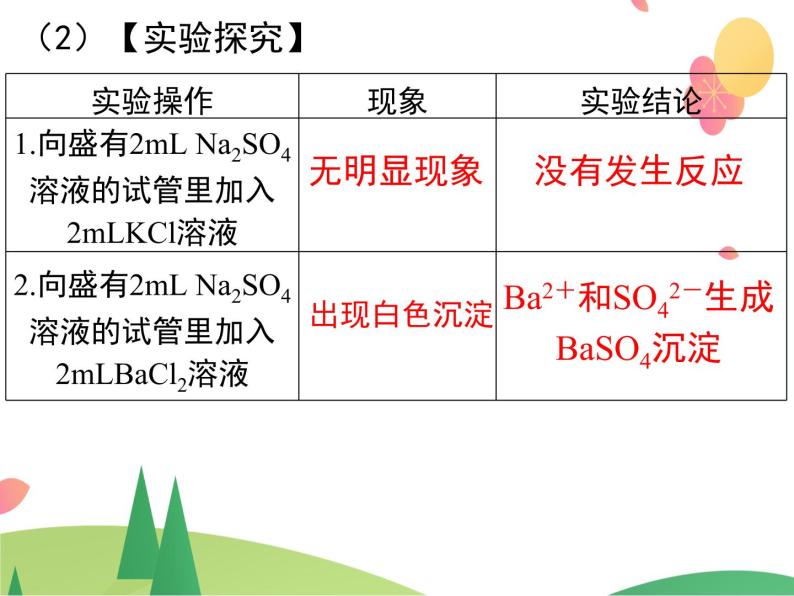
电解质溶于水后,电离成为自由移动的离子。因此,电解质在溶液中的反应一定与 有关。
(1)概念:有离子参加或有离子生成的反应称为离子反应。 电解质溶液的反应实质上就是电离出的 某些离子之间的反应。
Ba2+和SO42-生成BaSO4沉淀
(3)离子方程式:Ba2++SO42-===BaSO4↓ Na+ 离子和 Cl- 离子没有参与反应。离子方程式概念: 用实际参加反应的离子符号来表示反应的式子叫离子方程式 。
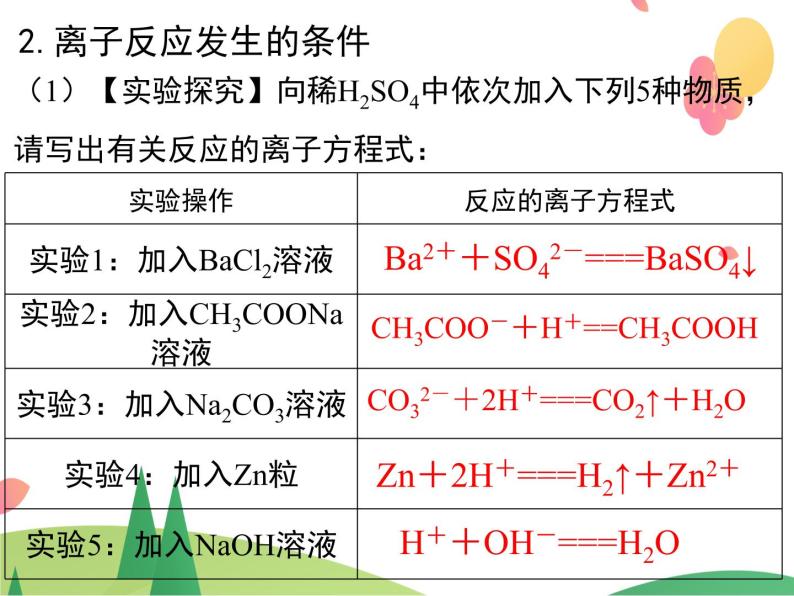
2.离子反应发生的条件
(1)【实验探究】向稀H2SO4中依次加入下列5种物质,请写出有关反应的离子方程式:
Ba2++SO42-===BaSO4↓
CH3COO-+H+==CH3COOH
CO32-+2H+===CO2↑+H2O
Zn+2H+===H2↑+Zn2+
H++OH-===H2O
【结论】从实验1~5可知离子反应发生的条件:①生成难溶的物质 ②生成难电离的物质③生成易挥发的物质 ④发生氧化还原反应
(2)离子反应的本质 实验1~5中,混合后溶液中SO42-的物质的量减少的 是 (填标号,下同); H+的物质的量减少的是 ;
【结论】 因此离子反应的本质是溶液中 某些离子的物质的量的减少。
1.离子方程式的书写;可分成“写、拆、删、查”四步①写:写出反应的化学方程式。②拆:把易溶于水,易电离的物质写成离子形式。③删:把不参加反应的离子从方程式两边删去。④查:检查方程式两边是否符合 原子守恒和电荷守恒。
【例题1】请写出硝酸银和氯化钾反应的 离子方程式写:AgNO3 + KCl == AgCl↓ + KNO3 改:Ag++NO3-+K++Cl-= AgCl↓+K++NO3- 删:Ag++NO3-+K++Cl-= AgCl↓+K++NO3-查: Ag+ + Cl- == AgCl↓
2.什么物质可以写成离子形式?易溶、易电离的物质(可溶性强电解质,包括强酸、强碱、可溶性盐)以实际参加反应的离子符号表示; 什么样的物质要用化学式表示?非电解质、弱电解质、难溶物、气体、单质、氧化物均用化学式表示。
【注意】(1)书写离子方程式时,浓硫酸不能拆写成离子形式,而浓硝酸、浓盐酸要拆写成离子形式。(2)多元弱酸的酸式酸根不能拆写成离子形式, 如HCO3-、HS-、HSO3-等; 而HSO42-在水溶液中要拆开写。(3)氨水作为反应物写为NH3·H2O;作为生成物,若有加热条件或浓度很大时,写为“NH3↑+H2O”。(4)拆写时,微溶物的澄清溶液要写成离子形式;呈浑浊状态或沉淀时要写成化学式,如澄清石灰水表示为“Ca2++2OH-”,而石灰乳表示为“Ca(OH)2”。
【练习】完成下列反应的离子方程式。① HCl+NaOH ② HCl+KOH ③ NaOH + H2SO4 ④ H2SO4+KOH
离子方程式都是H++OH-===H2O
3.离子方程式的意义 化学方程式只表示某一具体的反应,而 离子方程式不仅可以表示某一个具体的反应, 而且还可以表示同一类型的离子反应。
【思考】是否所有的酸碱中和反应的离子方程式都可表示为:H++OH-=H2O不是,强酸、强碱中和生成可溶性盐的反应通常可用H++OH-===H2O表示。
【例题2】完成下列反应的离子方程式:① Cu(OH)2+HCl ② CH3COOH+KOH ③ Ba(OH)2+H2SO4 【答案】 Cu(OH)2 + 2H+ == Cu2+ + 2H2O CH3COOH + OH- == CH3COO- + H2O Ba2++ 2OH-+2H+ + SO42- == BaSO4↓ +2H2O
4.根据离子反应的实质直接书写(以CaCO3溶于盐酸为例)
第1步:分析反应物在溶液中电离产生的大量离子。CaCO3难溶于水, 以大量离子的形式存在,盐酸中大量存在的离子为 和 。第2步:分析反应的本质CaCO3溶于盐酸的本质是CaCO3与 反应生成 气体和 。第3步:根据离子反应发生的条件或现象写出反应物和生成物的离子符号或化学式,并配平。 CaCO3+2H+===Ca2++CO2↑+H2O 第4步:检查方程式两边是否符合电荷守恒和原子守恒。
【强化记忆】溶解性钾、钠、铵盐、硝酸盐都可溶于水中间;硫酸盐难溶钡和铅;还有钙、银是微溶;盐酸盐难溶银、亚汞;碳酸盐钾钠铵外多不溶;碱中常溶钾、钠、钡、氨(一水合氨是弱碱);还有Ca(OH)2是微溶。
注意:(1)四种常见微溶物指Ag2SO4、CaSO4、MgCO3、Ca(OH)2;(2)AgCl、AgBr、AgI、BaSO4及微溶的CaSO4、Ag2SO4 都难溶于稀强酸。
1.无限定条件下的离子共存
(1)离子间发生复分解反应①生成难电离物质(水、弱酸、一水合氨等)的离子不能大量共存。如:H+与CH3COO-、CO32-、HCO3-、S2-等生成弱酸不能大量共存;OH-与NH4+(稀溶液)生成弱碱不能大量共存;H+与OH-生成水不能大量共存。②生成难溶物或微溶物的离子不能大量共存。如:Ba2+、Ca2+ 与 CO32-、SO42- 、SO32- 生成难溶物或微溶物不能大量共存。③生成气体及挥发性物质的离子不能大量共存。如:H+ 与 CO32-、HCO3-、SO32-、HSO3-生成气体不能大量共存。
(2)氧化还原反应类型(下个课题)
2.有限定条件(隐含条件)下的离子共存
(1)无色溶液:有色离子不能大量存在。 Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、 MnO4-(紫红色)、Cr2O42-(橙红色)等(2)溶液显酸性: 无大量的OH-及弱酸的酸根离子或酸式酸根离子。(3)溶液显碱性: 无大量的H+及弱碱的阳离子、弱酸的酸式酸根离子。(4)“一定”“可能”还是“不能”大量共存: 确定是“可能”还是“肯定”
【例题3】水溶液中能大量共存的一组离子是( )
1.判断下列说法的正误(正确的打“√”,错误的打“×”)。(1)盐在离子方程式中都可以拆分成离子形式( )(2)Ba2++SO42-===BaSO4↓只表示BaCl2与Na2SO4 反应的离子方程式( )(3)向NaOH溶液中加盐酸,由于发生反应:H++OH-=H2O,所以可以检验OH-的存在( )【答案】(1)× (2)× (3)×
2.能用H+ + OH-= H2O 来表示的化学反应是:A.溶液和溶液反应B.KOH溶液和溶液反应C.NaOH溶液和溶液反应D.CuO溶于稀HCl【答案】C
3.能正确表示下列化学反应的离子方程式正确的A.氢氧化镁与盐酸的反应:B.硫酸铜溶液与氢氢化钡溶液混合:C.溶液与NaOH溶液反应:D.碳酸钙溶于稀盐酸中:【答案】D
4.某无色透明溶液在碱性条件下能大量共存的离子组是( )
5.正确书写下列反应的离子方程式(1)澄清石灰水中加入稀盐酸(2)石灰乳与Na2CO3溶液反应(3)将浓硝酸滴到CaCO3固体上(4)NH4Cl与NaOH两稀溶液混合
高中化学人教版 (2019)必修 第一册第二节 离子反应教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教学课件ppt,共29页。PPT课件主要包含了学习目标,Cl-等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应完美版ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应完美版ppt课件,共28页。PPT课件主要包含了学习目标,情境思考,实验探究,出现白色沉淀,实验分析,离子反应,Na+Cl-,Na2SO4,BaCl2,Na+等内容,欢迎下载使用。
化学必修 第一册第二节 离子反应课前预习课件ppt: 这是一份化学必修 第一册第二节 离子反应课前预习课件ppt,共31页。PPT课件主要包含了教学分析,学情分析,教学目标,教学重难点,教学过程,第2节离子反应,第2课时离子反应,支持阿伦尼乌斯等内容,欢迎下载使用。













