突破06 备战2020年高考化学之突破物质结构性质与工艺流程题-工艺流程综合题(题型精练)
展开突破06 突破工艺流程综合题(1)
(注:本次训练重心在于熟练工艺流程题的结构与分析技巧)
限时:35分钟
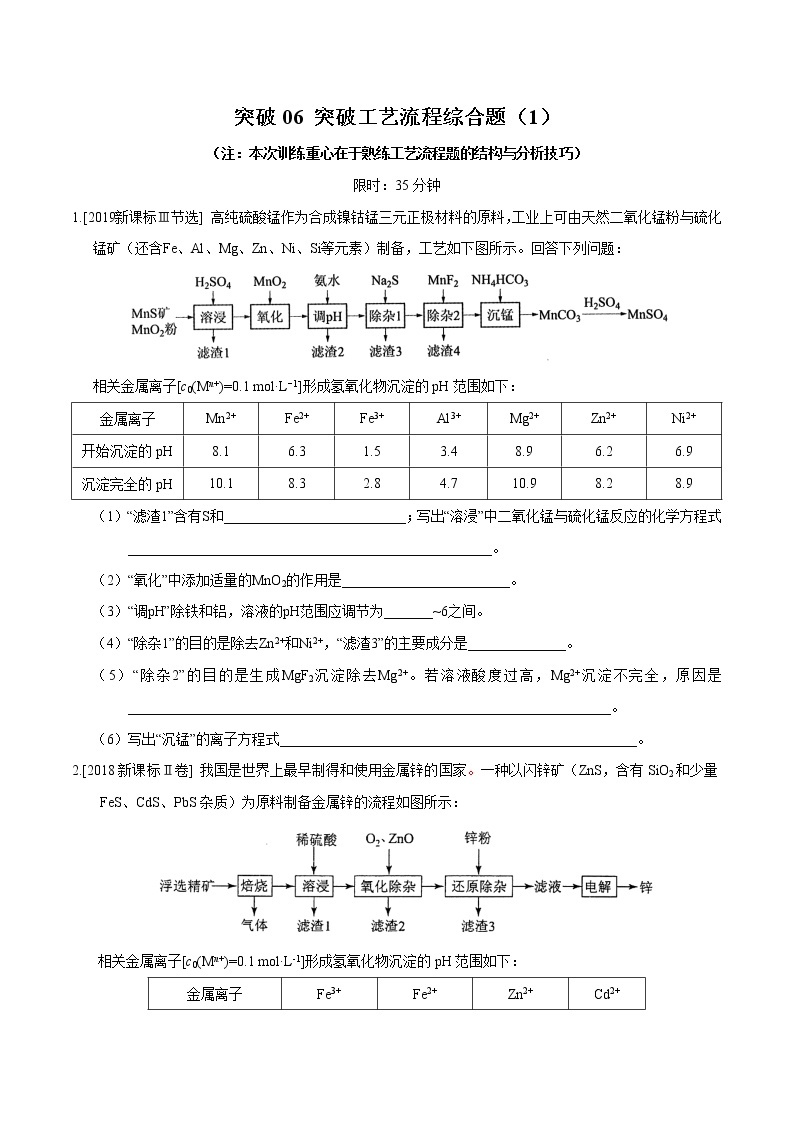
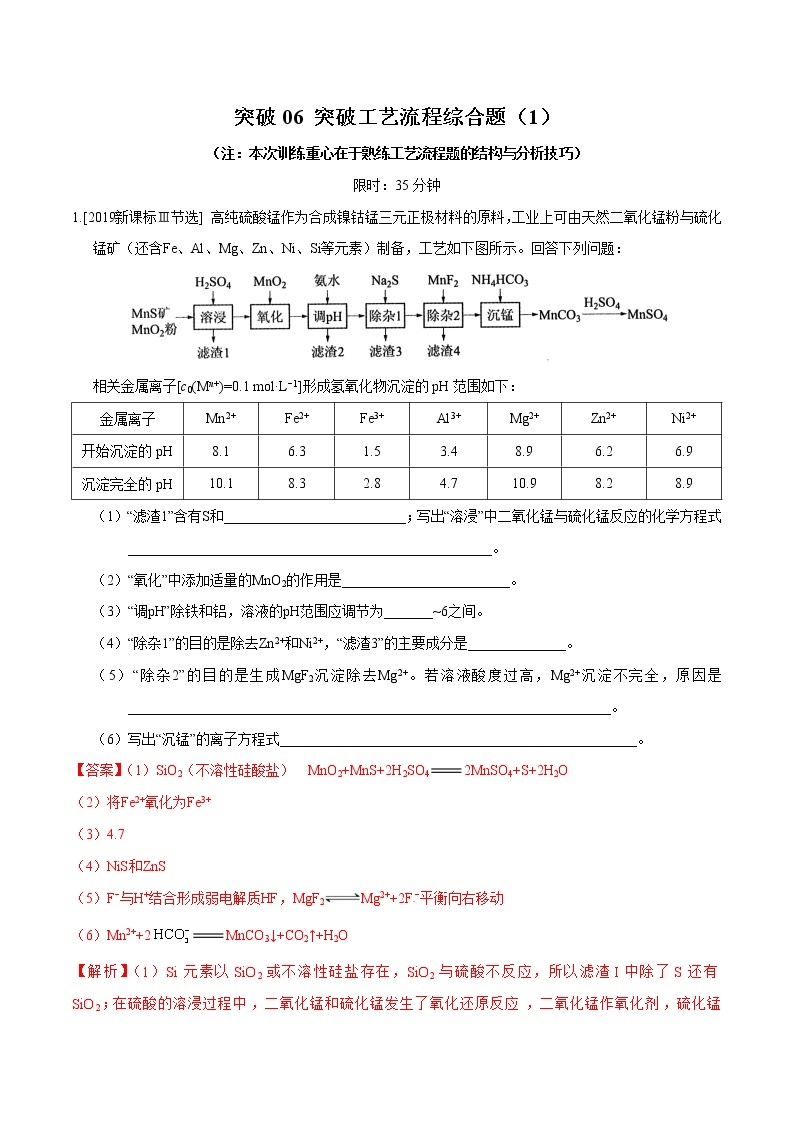
1.[2019新课标Ⅲ节选] 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
【答案】(1)SiO2(不溶性硅酸盐) MnO2+MnS+2H2SO42MnSO4+S+2H2O
(2)将Fe2+氧化为Fe3+
(3)4.7
(4)NiS和ZnS
(5)F−与H+结合形成弱电解质HF,MgF2Mg2++2F−平衡向右移动
(6)Mn2++2MnCO3↓+CO2↑+H2O
【解析】(1)Si元素以SiO2或不溶性硅盐存在,SiO2与硫酸不反应,所以滤渣I中除了S还有SiO2;在硫酸的溶浸过程中,二氧化锰和硫化锰发生了氧化还原反应,二氧化锰作氧化剂,硫化锰作还原剂,方程式为:MnO2+MnS+2H2SO42MnSO4+S+2H2O。
(2)二氧化锰作为氧化剂,使得MnS反应完全,且将溶液中Fe2+氧化为Fe3+。
(3)由表中数据知pH在4.7时,Fe3+和Al3+沉淀完全,所以应该控制pH在4.7~6之间。
(4)根据题干信息,加入Na2S除杂为了除去锌离子和镍离子,所以滤渣3是生成的沉淀ZnS和NiS。
(5)由HFH++F-知,酸度过大,F-浓度减低,使得MgF2Mg2++2F-平衡向沉淀溶解方向移动,Mg2+沉淀不完全。
(6)根据题干信息沉锰的过程是生成了MnCO3沉淀,所以反应离子方程式为:Mn2++2HCO3-MnCO3↓+CO2↑+H2O。
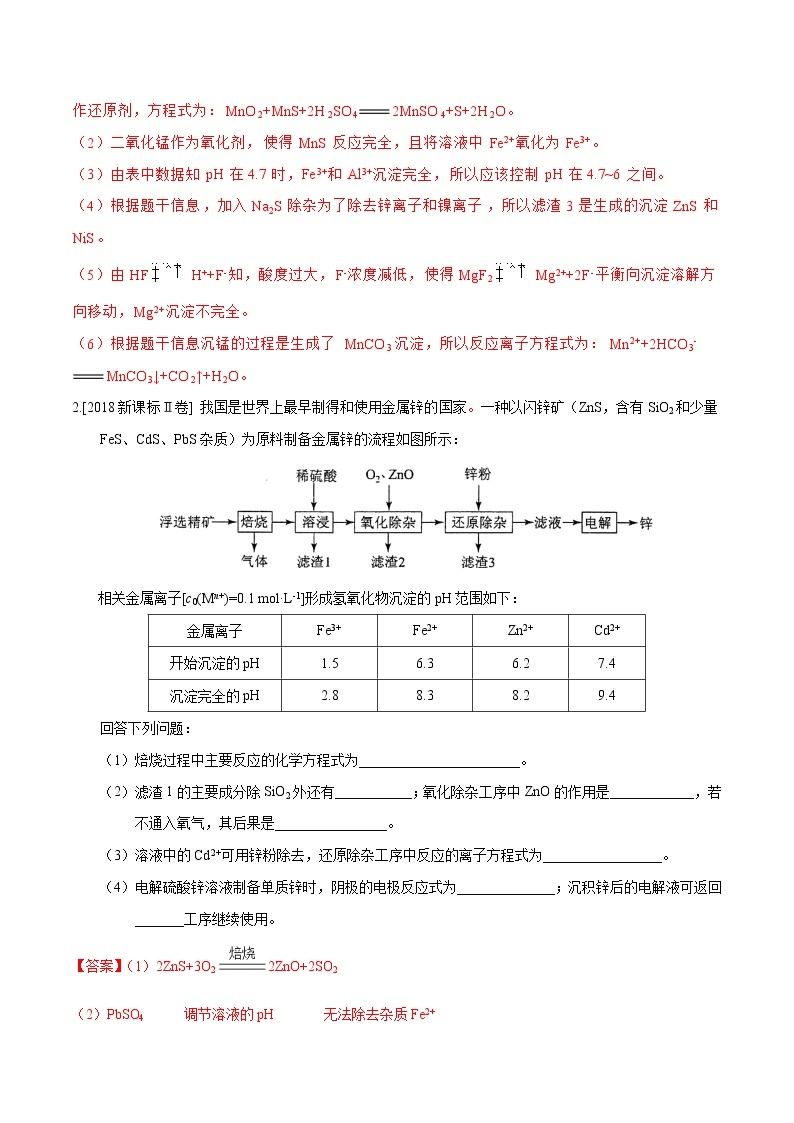
2.[2018新课标Ⅱ卷] 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为_______________________。
(2)滤渣1的主要成分除SiO2外还有___________;氧化除杂工序中ZnO的作用是____________,若不通入氧气,其后果是________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为_________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______________;沉积锌后的电解液可返回_______工序继续使用。
【答案】(1)2ZnS+3O22ZnO+2SO2
(2)PbSO4 调节溶液的pH 无法除去杂质Fe2+
(3)Zn+Cd2+Zn2++Cd
(4)Zn2++2e-Zn 溶浸
【解析】(1)闪锌矿的主要成分是ZnS,因此焙烧过程中主要反应为2ZnS+3O22ZnO+2SO2。
(2)由于硫酸铅不溶于水,因此滤渣1的主要成分除SiO2外还有PbSO4;要测定铁离子,需要调节溶液的pH,又因为不能引入新杂质,所以需要利用氧化锌调节pH,即氧化除杂工序中ZnO的作用是调节溶液的pH。根据表中数据可知沉淀亚铁离子的pH较大,所以若不通入氧气,其后果是无法除去杂质Fe2+。
(3)溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd。
(4)电解硫酸锌溶液制备单质锌时,阴极发生得到电子的还原反应,因此阴极是锌离子放电,则阴极的电极反应式为Zn2++2e-=Zn;阳极是氢氧根放电,破坏水的电离平衡,产生氢离子,所以电解后还有硫酸产生,因此沉积锌后的电解液可返回溶浸工序继续使用。
3.[2017·新课标III]重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为________。
【答案】(1)2∶7 陶瓷在高温下会与Na2CO3反应
(2)铁 Al(OH)3
(3)小 2+2H++H2O
(4)d 复分解反应
(5)×100%
【解析】(1)FeO·Cr2O3是还原剂,氧化产物为Na2CrO4和Fe2O3,每摩转移7 mol电子,而NaNO3是氧化剂,还原产物为NaNO2,每摩转移2 mol电子,根据电子守恒可知,FeO·Cr2O3和NaNO3的系数比为2∶7;陶瓷在高温下会与Na2CO3反应,则熔融时不能使用陶瓷容器。
(2)熔块中氧化铁不溶于水,过滤后进入滤渣1,则滤渣1中含量最多的金属元素是铁;滤液1中含有AlO2−、SiO32−及CrO42−,调节溶液pH并过滤后得滤渣2为Al(OH)3及含硅杂质。
(3)滤液2调节pH的目的是提高溶液的酸性,pH变小;因为溶液中存在2CrO42−+2H+Cr2O72−+H2O,增大溶液中H+浓度,可促进平衡正向移动,提高溶液中Cr2O72−的浓度。
(4)由图示可知,在10 ℃左右时,得到K2Cr2O7的固体最多;2KCl+Na2Cr2O7=K2Cr2O7↓+2NaCl的反应类型为复分解反应。
(5)样品中Cr2O3的质量为m1×40% kg,则生成K2Cr2O7的理论质量为m1×40% kg×,则所得产品的产率为m2 kg÷(m1×40% kg×)×100%=×100%。
4.钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。
(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________________。
(2)物质A为________(填化学式),“一系列操作”为______________________________________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________________________、________________________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________________;
若制得金属Ti 9.60 g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式__________________________________;
若反应后的溶液中c(Fe2+)=2×10-6 mol·L-1,则溶液中c(CO)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1)
【答案】 (1)FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O
(2)Fe 蒸发浓缩、冷却结晶、过滤
(3)加水稀释反应物 加碱中和生成的酸、加热等
(4)TiO2+4e-===Ti+2O2- 4 480
(5)Fe2++2HCO===FeCO3↓+CO2↑+H2O 1×10-5
【解析】 (1)因钛铁矿主要成分为FeTiO3,且滤液1中钛元素以TiO2+形式存在,所以其主要反应化学方程式为FeTiO3+2H2SO4TiOSO4+FeSO4+2H2O。(2)该流程中还有副产物FeSO4·7H2O,故需将溶浸产物中的Fe3+除去,物质A为Fe,“一系列操作”包括蒸发浓缩、冷却结晶、过滤。(3) “水解”反应为TiO2++(x+1)H2O===TiO2·xH2O↓+2H+,根据平衡移动原理,为提高TiO2·xH2O的产率可以加水稀释反应物、加碱中和生成的酸、加热等。(4)“电解”过程中阴极反应:TiO2+4e-===Ti+2O2-,阳极反应:2O2--4e-===O2↑,若制得金属Ti 9.60 g,则n(Ti)=n(O2)=0.2 mol,V(O2)=4 480 mL(标准状况下)。(5)由题意知该反应化学方程式为:Fe2++2HCO===FeCO3↓+CO2↑+H2O;由常温下FeCO3饱和溶液浓度为4.5×10-6 mol·L-1,Ksp(FeCO3)=2.025×10-11 mol2·L-2,则c(CO)==1.013×10-5 (mol·L-1)。








