

2018-2019学年广西南宁市第三中学高二上学期期末考试化学试题 Word版
展开南宁三中2018~2019学年度上学期高二期考
理科化学试题
出题人:李双根 审题人:高二化学备课组 2019.1
可能用到的相对原子质量:H-1 C-12 O-16 I-127
一、单选题(每小题3分,共45分)
1.下列说法不正确的是( )
A. 食用油反复加热会产生稠环芳烃等有害物质
B. 加热能杀死流感病毒是因为蛋白质受热变性
C. 油脂和蛋白质都属于高分子化合物
D. 煤经过气化和液化两个化学变化过程,可变为清洁能源
2.下列物质在水溶液中电离方程式中,书写正确的是( )
A.CH3COOH = H++CH3COO-
B.KHSO4 K++H++SO42-
C.Al(OH)3Al3++3OH-
D.H3PO4 3H++PO43-
3. 下列实验装置图正确的是 ( )
4.分支酸可用于生化研究,其结构简式如图。下列关于分支酸的叙述正确的是( )
A.1mol分支酸最多可与3molNaOH发生中和反应
B.可与乙醇、乙酸反应,且反应类型相同
C.分支酸的分子式为C10H8O6
D.往分支酸中滴加浓溴水,产生白色浑浊
5. 将A g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如下图的实线所示,在相同的条件下,将B g粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )(已知A>B)
6.下列事实不能用勒夏特列原理(平衡移动原理)解释的是 ( )
A.对于反应体系 CO(g) + NO2(g) NO(g) + CO2(g),压缩体积可使颜色变深
B. 实验室可用排饱和食盐水的方法收集氯气
C. 重铬酸钾溶液中存在如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色),
向K2Cr2O7溶液中加入几滴氢氧化钠,溶液变黄色
D. 开启啤酒瓶后,瓶中马上泛起大量泡沫
7. 根据碘与氢气反应的热化学方程式(1)I2(g)+ H2(g) 2HI(g) ΔH=-9.48 kJ/mol
(2)I2(s)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol,下列判断正确的是( )
A.254 g I2(g)中通入2 gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(2)的反应物总能量比反应(1)的反应物总能量低
D.反应(1)的产物比反应(2)的产物稳定
8.某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是 ( )
A. a、b、c三个状态只有b是平衡状态
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2<T1,则正反应一定是吸热反应
D. b点时,平衡体系中A、B原子数之比接近1∶3
9.某单烯烃与氢气的加成产物为:CH3CH2CH(CH3)CH2CH3 ,
下列相关说法正确的是( )
A.该产物的名称是3-甲基已烷 B.该产物有3种沸点不同的一氯代物
C.原单烯烃可能有3种不同结构 D.原单烯烃与分子式为C5H10的烃一定互为同系物
10.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
A.反应物的键能总和大于生成物的键能总和
B.升高温度,利于A的转化率增大
C.加入催化剂时,可以降低反应热
D.增大压强,能够缩短反应达到平衡状态的时间
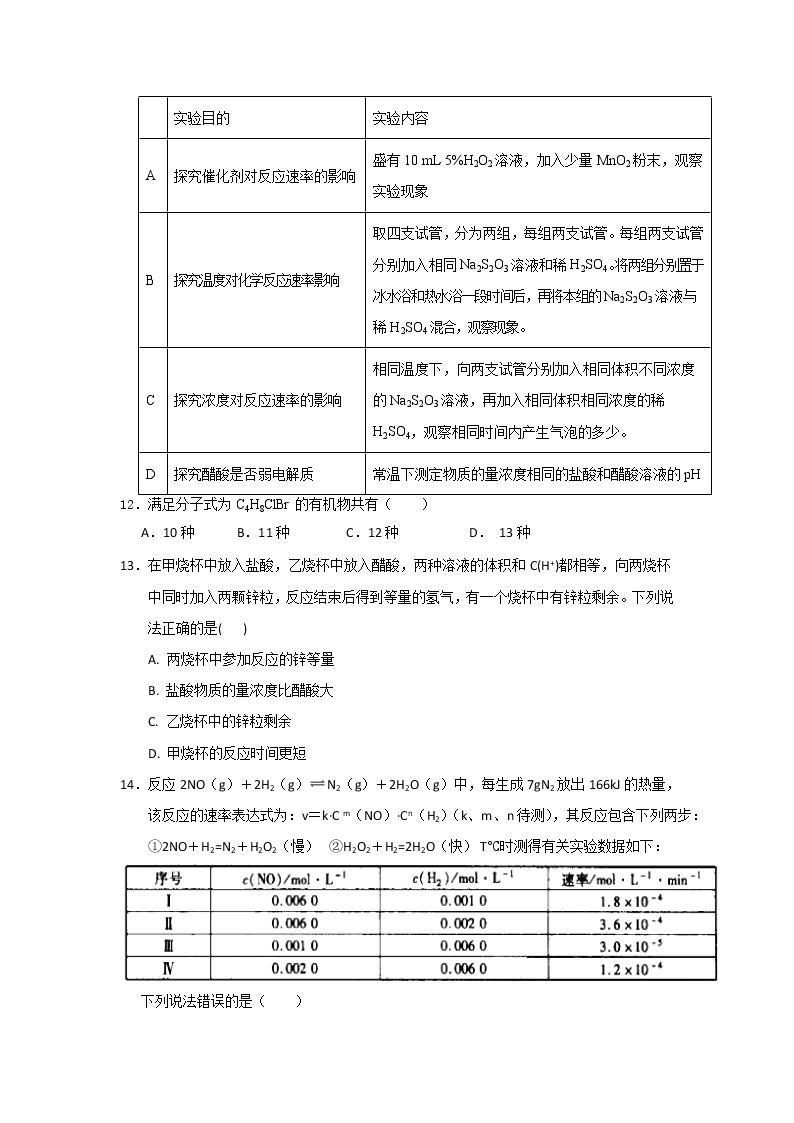
11.按照下列实验内容,不能达到实验目的的是( )
| 实验目的 | 实验内容 |
A | 探究催化剂对反应速率的影响 | 盛有10 mL 5%H2O2溶液,加入少量MnO2粉末,观察实验现象 |
B | 探究温度对化学反应速率影响 | 取四支试管,分为两组,每组两支试管。每组两支试管分别加入相同Na2S2O3溶液和稀H2SO4。将两组分别置于冰水浴和热水浴一段时间后,再将本组的Na2S2O3溶液与稀H2SO4混合,观察现象。 |
C | 探究浓度对反应速率的影响 | 相同温度下,向两支试管分别加入相同体积不同浓度的Na2S2O3溶液,再加入相同体积相同浓度的稀H2SO4,观察相同时间内产生气泡的多少。 |
D | 探究醋酸是否弱电解质 | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH |
12.满足分子式为C4H8ClBr的有机物共有( )
A.10种 B.11种 C.12种 D. 13种
13.在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和C(H+)都相等,向两烧杯中同时加入两颗锌粒,反应结束后得到等量的氢气,有一个烧杯中有锌粒剩余。下列说法正确的是( )
A. 两烧杯中参加反应的锌等量
B. 盐酸物质的量浓度比醋酸大
C. 乙烧杯中的锌粒剩余
D. 甲烧杯的反应时间更短
14.反应2NO(g)+2H2(g)N2(g)+2H2O(g)中,每生成7gN2放出166kJ的热量,
该反应的速率表达式为:v=k·C m(NO)·Cn(H2)(k、m、n待测),其反应包含下列两步:
①2NO+H2=N2+H2O2(慢) ②H2O2+H2=2H2O(快) T℃时测得有关实验数据如下:
下列说法错误的是( )
A.该反应速率表达式:v=5000·C2(NO)·C(H2)
B.整个反应速率由第①步反应决定
C.正反应的活化能:①<②
D.该反应的热化学方程式为2NO(g)+2H2(g)=N2(g)+2H2O(g) △H=-664kJ·mol-1
15. 已知酸性:H2SO4>>H2CO3>> HCO3—,综合考虑反应物的转化率和原料成本等因素,将转变为的方法有( )
A.与足量的NaOH溶液共热后,再加入适量H2SO4
B.与足量的NaOH溶液共热后,再通入足量CO2
C.与稀H2SO4共热后,加入足量的NaHCO3溶液
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
二、填空题(共55分)
16.(14分) 工业上可用CO2和H2反应合成甲醇。
已知25°C、101 kPa下:
H2(g)+1/2O2(g)=H2O (g) △H1= - 242kJ/mol
CH3OH(g)+3/2O2(g) =CO2(g)+2H2O(g) △H2= - 676kJ/mol
(1)写出CO2与H2反应生成CH3OH(g)与H2O (g)的热化学方程式_________________。
常温下,某实验中将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图曲线 (甲)所示。请完成下列问题:
(2)该反应能在________(填“高温”或“低温”)条件下自发进行;
从a点到b点,用H2表示该反应的平均化学反应速率是____________。(保留两位有效数字)
a点逆反应速率_____b点逆反应速率(填“>”、“<”或“=”);
达平衡时,CO2的转化率是 。
(3)若仅改变某一实验条件再进行一次实验,测得H2的物质的量随时间变化如图中虚线(乙)所示,曲线(乙)对应改变的实验条件可以是________(填序号)。
a.加催化剂 b.增大压强 c.升高温度 d.增大H2浓度
(4)若曲线甲b点达到平衡时体系压强为100MPa,此时H2的平衡分压为_______MPa。
(某物质分压=总压×某物质的物质的量分数)
(5)下列叙述能标志该反应达到化学平衡状态的是
a.CO2与H2的转化率之比不变 b.v(生成H2) : v(消耗H2O) = 3:1
c.混合气体的相对分子质量不变 d.甲醇与水蒸气的分压比不变
17.(11分)电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示。根据该表,回答下列问题:
化学式 | HF | CH3COOH | H2SO3 | H2CO3 | H2S |
电离平衡 常数(Ka) | 7.2×10-4 | 1.8×10-5
| K1=1.54×10-2 K2=1.02×10-7 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)同浓度的F-、CO32-、CH3COO-、HS-结合H+的能力最强的为
(2)溶液中不可能大量共存的离子组是
a.HS-、SO32- b.HF、CH3COO- c.HS-、HCO3- d. HSO3-、HCO3-
(3)Na2CO3溶液通入过量H2S的离子方程式是: 。
(4)已知pH= -lg[H+],体积为10 mL pH=2的醋酸溶液与
一元酸HX分别加水稀释至1000 mL,稀释过程中pH
变化如图所示,则HX的电离平衡常数______醋酸的
电离平衡常数(填“>”、“<”或“=”)。 任意写一种方法
证明醋酸是弱电解质 。
(5)向 0.l mol•L-1 HF 溶液中滴加 NaOH 溶液至
C(HF) : C(F-) =5 : 36,此时溶液pH = 。
18.(15分)煤气中主要的含硫杂质有H2S以及CS2、COS等有机硫,煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标,脱除煤气中H2S的方法有干法脱硫和湿法脱硫,其中湿法脱硫的原理是利用Na2CO3溶液吸收H2S生成NaHS,再进一步被空气氧化成Na2S2O3。
请回答下列问题:
(1) ①Na2S2O3的化学名称为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为 ;
增大压强,COS的转化率_____________(填“提高”、“不变”或“降低”)。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S | |
E/kJ•mol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率如图1所示;某温度下,COS的平衡转化率与的关系如图2所示。
由图1可知,催化剂活性最大时对应的温度约为_______,高于该温度时, COS的转化率________(填“是或“不是”)对应温度下的平衡转化率,判断的理由是 ;
由图2可知,P点时平衡常数K= (保留2位有效数字)。
(3) 回收处理燃煤烟气中SO2的方法之一是用氨水先将SO2转化为NH4HSO3,再通入空气将其氧化成(NH4)2SO4。能提高燃煤烟气中SO2去除率的措施有__________(填字母)。
a.增大氨水浓度 b.增大燃煤烟气的流速 c.升高温度 d.增大压强
19.(15分) A(C3H6)是基本有机化工原料。由A制备聚合物C和的合成路线(部分反应条件略去)如图所示:
回答下列问题:
(1)D的名称是 ,B含有的含氧官能团的名称是 。
(2)C的结构简式为 ,D→E的反应类型为 。
(3)E→F的化学方程式为 。
(4)中最多有 个原子共平面,
发生缩聚反应生成有机物的结构简式为 。
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有 种;
其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是 (写结构简式)。
(6)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线。
(无机试剂任选,合成路线流程图示例见本题题干)
南宁三中 2018~2019学年度高二上学期化学期考参考答案
1-5:CCBBC 6-10: ACDCD 11-15:CCACB
填空题若无特殊说明,每空2分。
16.(14分)(1)CO2(g)+3H2(g) =CH3OH(g)+H2O(g) ΔH= -50 kJ/mol
(2)低温(1分)0.28mol/(L·min) < (1分)33.3%(3)b(4)20
(5)ac(选对一项得1分,错选倒扣1分,下同)
17. (11分)(1)CO32-(1分)(2)b (2分)(3)H2S+CO32- ==HCO3-+HS- (2分)
(4)大于(2分)(5)4(2分)
18.(15分) (1)①硫代硫酸钠(1分) (2)① (1分)
②COS+4Br2+12OH- = CO32- + SO42- + 8Br- +6H2O 提高(1分) ③+8 ④150℃ (1分)
不是(1分) 该反应是吸热反应,温度升高,平衡正向移动,转化率应该升高。 0.048
(3)ad
19. (15分)(1)3-氯丙烯(1分);酯基(1分)
(2) ;取代反应或水解反应(1分)
(3)
(4)10(1分);
(5)8(1分);
(6)
(无条件扣0.5分,对两步得1分,全对得2分)








