

- 重难点04 浓硫酸、浓硝酸的性质与反应计算-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷 试卷 2 次下载
- 重难点05 化学反应中热量的变化情况判断-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷 试卷 3 次下载
- 重难点07 化学反应速率影响因素的探究-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷 试卷 2 次下载
- 重难点08 化学反应速率及平衡图像问题的分析-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷 2 次下载
- 重难点09 烃的代表物分子结构及其性质比较-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷 试卷 1 次下载
重难点06 原电池正、负极的判断与电极反应式的书写-2019-2020学年高一化学重难点探究(人教版2019必修第二册) 试卷
展开2019-2020学年高一化学重难点探究(人教版2019必修第二册)
重难点06 原电池正、负极的判断与电极反应式的书写
方法探究
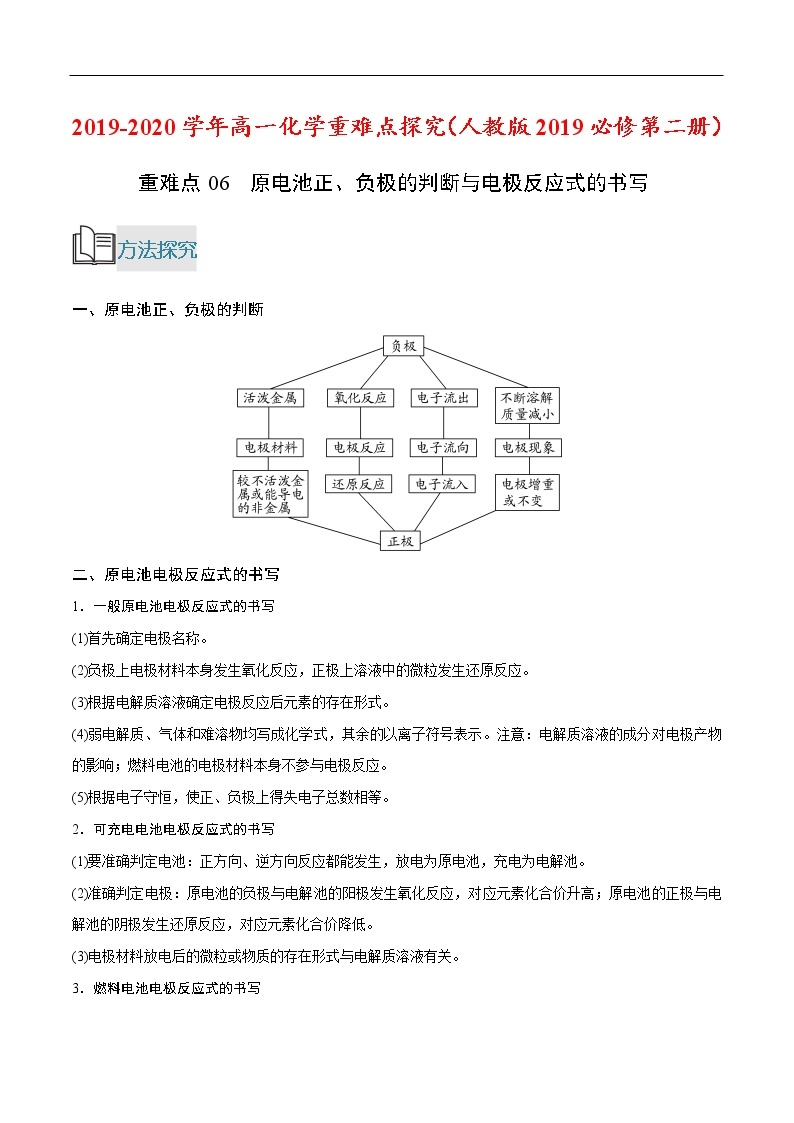
一、原电池正、负极的判断
二、原电池电极反应式的书写
1.一般原电池电极反应式的书写
(1)首先确定电极名称。
(2)负极上电极材料本身发生氧化反应,正极上溶液中的微粒发生还原反应。
(3)根据电解质溶液确定电极反应后元素的存在形式。
(4)弱电解质、气体和难溶物均写成化学式,其余的以离子符号表示。注意:电解质溶液的成分对电极产物的影响;燃料电池的电极材料本身不参与电极反应。
(5)根据电子守恒,使正、负极上得失电子总数相等。
2.可充电电池电极反应式的书写
(1)要准确判定电池:正方向、逆方向反应都能发生,放电为原电池,充电为电解池。
(2)准确判定电极:原电池的负极与电解池的阳极发生氧化反应,对应元素化合价升高;原电池的正极与电解池的阴极发生还原反应,对应元素化合价降低。
(3)电极材料放电后的微粒或物质的存在形式与电解质溶液有关。
3.燃料电池电极反应式的书写
首先写出总反应方程式,因为燃料电池的总反应方程式等于燃料燃烧方程式和燃烧产物与电解质溶液反应的方程式的叠加式。其次将总反应拆开,找出氧化反应物质对:还原剂——氧化产物,和还原反应物质对:氧化剂——还原产物,分别作为负极反应和正极反应,在书写时要特别注意考虑溶液的酸碱性环境对电极反应式书写的影响,最后利用电子守恒、电荷守恒和质量守恒进行配平。
典例剖析
例1 (2020·河北省唐山一中高一月考)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。
下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是+2H++e−=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
【答案】D
【解析】【分析】0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
【详解】0~t1时,铝为原电池的负极,铜为正极,到t1时,铝在浓硝酸中钝化后不再反应,此时铜又成了原电池的负极。
A、0~t1时,原电池的负极是Al片,故A正确;
B、0~t1时,硝酸根离子在正极得电子生成红棕色气体NO2,正极的电极反应式是NO3-+2H++e−=NO2↑+H2O,故B正确;
C、t1后,铝发生钝化,铜作负极,所以,电池的正、负极发生互变,故C正确;
D、t1后,铜是负极,每有0.3 mol电子发生转移,就有0.15 mol铜失去电子,负极质量减少9.6 g,故D错误。
故选D。
【点睛】本题考查原电池原理,通过图象判断不同时刻原电池的正负极为解答本题的关键,也是易错点。
例2 以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
(1)H+向___________极移动(填“正”或“负”)。
(2)电子流动方向由____________极流向____________极(填“正”或“负”)。
(3)若有1 mol e− 流过导线,则理论上负极质量减少____________g。
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极反应式表示)。
【答案】(1)正 (2)负 正 (3)32.5 (4)铜极 Cu2++2e−===Cu
【解析】(1)在原电池工作的过程中,阳离子向正极移动,故答案为:正;
(2)在原电池中,电子由负极流出,正极流入,故答案为:负、正;
(3)负极的电极反应为:Zn−2e−===Zn2+,当转移1 mol e−时,消耗0.5 mol Zn,质量为:0.5 mol×65 g/mol=32.5 g,故答案为:32.5;
(4)稀硫酸换成硫酸铜溶液后,在正极为铜离子得电子被还原,故答案为:铜极、Cu2++2e−===Cu。
精选习题
1.(2020·横峰中学高一开学考试)某原电池总反应的离子方程式为:2Fe3++Fe=3Fe2+能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极是Fe,电解质溶液为FeCl2
C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4
【答案】A
【解析】【分析】该原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,铁离子得电子被还原,则可溶性铁盐溶液为电解质溶液,Fe失电子发生氧化反应,则Fe作负极,不如Fe活泼的金属或导电的非金属作正极。
【详解】A.Fe作负极、Cu作正极、氯化铁溶液为电解质溶液,符合题给信息,故A正确;
B.活泼性Zn>Fe,则Zn作负极,不符合题给信息,故B错误;
C.活泼性Zn>Fe,则Zn作负极,不符合题给信息,故C错误;
D.电解质为硫酸铜,应该为可溶性铁盐,故D错误;故选A。
2.(2020·新疆维吾尔自治区高一期中)如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5 mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是Cu→Zn ⑥正极反应式:Cu-2e-=Cu2+,发生氧化反应
A.①②③ B.②④ C.②③④ D.④⑤⑥
【答案】B
【解析】【分析】Zn-Cu原电池中,电池反应Zn+2H+=Zn2++H2↑,Zn作负极发生氧化反应,铜是正极发生还原反应,电子由负极流向正极,阴离子向负极移动,据此分析判断。
【详解】①Zn为负极,Cu为正极,故①错误;
②Cu电极上发生2H++2e-=H2↑,所以Cu极上有气泡产生,发生还原反应,故②正确;
③SO42-向负极锌极移动,故③错误;
④由2H++2e-=H2↑可知,有0.5mol电子流经导线,产生氢气0.25mol,故④正确;
⑤电子由Zn电极流向Cu电极,故⑤错误;
⑥正极反应为2H++2e-=H2↑,故⑥错误;
正确的有②④,故选B。
3.(2019·河北省沧州市一中高一月考)关于如图所示装置的叙述,正确的是
A.该装置构成原电池,锌易失电子作负极、Cu 作正极,负极上电极反应式为 Zn-2e-=Zn2+,所以锌的质量逐渐减少
B.电流从负极锌沿导线流向正极铜
C.该装置是将电能转化为化学能的装置,为原电池
D.氢离子在锌片上被还原,所以锌片上有气泡生成
【答案】A
【解析】【分析】该装置构成原电池,活泼金属锌为负极,锌失去的电子通过导线流向铜,锌发生氧化反应,不活泼金属铜为正极,得到电子,发生还原反应,据此分析解答。
【详解】A.该装置构成原电池,锌易失电子作负极、Cu作正极,负极上Zn-2e-=Zn2+,锌的质量逐渐减少,故A正确;
B.锌失去的电子通过导线流向铜,所以电流由Cu经导线流入Zn片,故B错误;
C.原电池是将化学能转变为电能的装置,故C错误;
D.锌片、铜片和稀硫酸溶液构成原电池,铜作正极,正极上氢离子得电子生成氢气,故D错误;
故选A。
4.(2020·四川省遂宁市第二中学校高一期中)如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-=Cu2+,发生氧化反应。
A.①②③ B.②④⑥ C.③④⑤ D.②④
【答案】D
【解析】【分析】Zn-Cu原电池中,Zn 作负极,Cu作正极,发生电池反应Zn+2H+=Zn2++H2↑,电子由负极流向正极,阳离子向正极移动,据此分析进行解答。
【详解】①Zn活泼失电子为负极,Cu为正极,①错误;
②Cu极上氢离子得电子发生还原反应,所以Cu上有气泡产生,②正确;
③溶液中阴离子向负极移动,即SO42-向Zn极移动,③错误;
④Cu为正极,正极上发生反应2H++2e-=H2↑若有0.5mol电子流经导线,则可产生0.25mol气体,④正确;
⑤电子由负极流向正极,即电子的流向是:Zn→Cu,⑤错误;
⑥Cu为正极,正极上发生反应2H++2e-=H2↑,得到电子是还原反应,⑥错误;
答案选D。
5.(2019·天津芦台二中高一月考)某小组为研究原电池原理,设计如图装置。下列叙述不正确的是( )
A.无论a和b是否连接均可形成原电池
B.a和b不连接时,铁片上会有金属铜析出
C.a和b用导线连接时,铜片上发生的反应为Cu2++2e-= Cu
D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
【答案】A
【解析】A.a和b不连接时,不构成原电池,A错误;
B.a和b不连接时,铁片上会有金属铜析出,B正确;
C.a和b用导线连接时,铜片为正极,所以铜片上发生的反应为,C正确;
D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色,D正确。
答案选A。
6.(2020·石门县第二中学高二月考)为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
编号 | 电极材料 | 电解质溶液 | 电子流向 |
① | Mg—Al | HNO3(浓) | Mg→Al |
② | Mg—Al | HCl(aq) | Mg→Al |
③ | Mg—Al | NaOH(aq) | Al→Mg |
④ | Al—Cu | HNO3(浓) | Cu→Al |
根据以上表格内容回答:
(1)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
(2) 实验2中Mg电极反应式为____________________________。Al电极上的电极反应式为_________________________。
【答案】(1)负极 氧化反应
(2)Mg-2e-=Mg2+ 2H++2e-=H2↑
【解析】【分析】本题可根据电子的流动方向判断原电池的正负极;同时,也可根据物质的具体性质判断正负极:镁比铝活泼,镁与HNO3(浓) 和HCl(aq)都能发生反应,且铝遇冷、浓硝酸会钝化,而镁不会。据此可对各个电池反应进行判断,结合原电池工作原理可对各个小题进行解答。
【详解】(1)原电池中电子由负极沿导线流向正极,正极发生还原反应,负极发生氧化反应。实验1中,电子由镁流向铝,所以镁是负极,发生氧化反应。答案为:负极;氧化反应
(2)实验2中,电子由镁流向铝,可见镁作负极并发生氧化反应,电极反应式为:Mg-2e-=Mg2+;铝为正极,氢离子被还原,电极反应式为:2H++2e-=H2↑。答案为:Mg-2e-=Mg2+;2H++2e-=H2↑
7.(2020·河南省巩义中学高一期中)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑,判断能否设计成原电池A._____________,B._____________。(填“能”或“不能”)
(2)将纯锌片和纯铜片图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是_______________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲______________乙(填“>”、“<“或“=”)
③请写出图中构成原电池的负极电极反应式_____________。
【答案】(1)不能 能
(2)BD > Zn–2e-=Zn2+
【解析】(1)原电池中发生的是自发的氧化还原反应,A为酸碱中和反应,是非氧化还原反应,故不能设计成原电池;B是置换反应,是氧化还原反应,能设计成原电池,故答案为:不能,能;
(2)①甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀;A.甲是化学能转变为电能的装置,乙不是,故A错误;B.乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故B正确;C.甲、乙中锌片质量都减少,故C错误;D.两个烧杯中都产生氢气,氢离子浓度都降低,所以溶液的pH均增大,故D正确,故答案选BD;
②原电池原理引起的腐蚀速度大于化学腐蚀的速度,甲中形成原电池,则产生气泡的速度:甲>乙,故答案为:>;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,故答案为:Zn–2e-=Zn2+。
【点睛】
明确原电池的构成条件及反应必须是放热反应是解本题的关键。构成原电池的条件是:①有两个活泼性不同的电极;②将电极插入电解质溶液中;③两电极间构成闭合回路;④能自发的进行氧化还原反应。
8.某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 | 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 | |
2 | 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 | |
3 | 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。
【答案】(1)有气体生成 发生偏转
①活泼性不同的两个电极 ②形成闭合回路 ③有电解质溶液
(2)Zn−2e−===Zn2+ 2H++2e−===H2↑
(3)Cu 13
【解析】(1)实验3中构成原电池,锌是负极,铜是正极,溶液中的氢离子放电,则铜棒表面的现象是有气体生成,电流计指针发生偏转;①实验2和3相比电极不一样,因此可得出原电池的形成条件是有活泼性不同的两个电极。②实验1和3相比实验3中构成闭合回路,由此可得出原电池的形成条件是形成闭合回路。③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,由于乙醇是非电解质,硫酸是电解质,因此可得出原电池形成条件是有电解质溶液。
(2)锌是负极,发生失去电子的氧化反应,则Zn棒上发生的电极反应式为Zn−2e−===Zn2+。铜是正极,溶液中的氢离子放电,则Cu棒上发生的电极反应式为2H++2e−===H2↑。
(3)实验3中锌是负极,铜是正极,则电流是从Cu棒流出,反应过程中若有0.4 mol电子发生了转移,根据Zn−2e−===Zn2+可知消耗0.2 mol锌,则Zn电极质量减轻0.2 mol×65 g/mol=13.0 g。
9.(2020·山西省高一月考)已知化学反应:
a.
b.
请回答下列问题:
(1)上述两个化学反应中有一个不可用于设计原电池,它是__________(填写代号),其原因是__________;另一个可用于设计原电池,该原电池中,负极反应式是____________,正极反应式是___________,电池总反应的离子方程式是_______________。
(2)如果利用化学反应Cu+2Fe3+=Cu2++2Fe2+,设计原电池,请在如图方框中标明电极材料和电解质溶液的名称(图中“I”表示电流)。______、______、______
【答案】(1)a a是复分解反应,不是自发的氧化原反应 Cu-2e-═Cu2+ 2Ag++2e-═2Ag Cu+2Ag+=Cu2++2Ag+ Cu
(2)不如铜活泼的金属或石墨 氯化铁或硫酸铁
【解析】(1)上述两个化学反应中有一个不可用于设计原电池,它是a(填写代号),其原因是a是复分解反应,不是自发的氧化原反应;另一个可用于设计原电池,该原电池中,负极上铜失电子发生氧化反应,正极上银离子得电子发生还原反应,负极反应式是Cu-2e-═Cu2+;正极反应式是2Ag++2e-═2Ag;电池总反应的离子方程式是:Cu+2Ag+=Cu2++2Ag+;
故答案为:a;a是复分解反应,不是自发的氧化原反应;Cu-2e-═Cu2+;2Ag++2e-═2Ag;Cu+2Ag+=Cu2++2Ag+;
(2)根据电池反应式知,负极上铜失电子发生氧化反应,正极上铁离子得电子发生还原反应,所以负极材料应该是铜,正极材料应该是不如铜活泼的金属或石墨,电解质溶液应该是氯化铁或硫酸铁都可,
故答案为:Cu;不如铜活泼的金属或石墨;氯化铁或硫酸铁。
10.某研究性学习小组对Mg和Al的性质进行了下列的实验及研究。
(1)以镁条、铝片为电极,稀NaOH溶液为电解质构成的原电池(如图1所示)时发现,刚开始时,电流表指针向右偏转,镁条做负极;但随后很快指针又向左偏转,镁条表面有极少量的气泡产生。
①开始阶段,负极发生的电极反应式是________。
②随后阶段,铝片发生的电极反应式是_______;则镁电极发生的电极反应式是________。
(2)经研究测定,镁与不同浓度的硝酸反应,生成气体产物的含量随HNO3浓度变化曲线如图2所示,溶液中的产物有Mg(NO3)2、NH4NO3和H2O。96 mg Mg在1 L 4 mol•L−1的HNO3中完全溶解,并可收集到22.4 mL(标准状况下)气体(忽略反应过程中HNO3浓度的变化),该反应的化学方程式是________。
【答案】(1)①Mg+2OH−−2e−===Mg(OH)2↓ ②Al+4OH−−3e−===AlO2−+2H2O 2H++2e−===H2↑(或2H2O+2e−===H2↑+2OH−)
(2)40Mg+100HNO3===5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O
【解析】(1)①镁较活泼所以做负极,Mg失电子变成Mg2+,负极反应为Mg+2OH−−2e−===Mg(OH)2↓;②Mg虽比Al活泼,但Mg不能与NaOH溶液反应,而Al可与NaOH溶液反应,故Al作负极,失电子生成Al3+,Al3+结合OH−生成AlO2−,镁做正极,H+在镁电极上得电子生成氢气,电极反应式分别是Al+4OH−−3e−===AlO2−+2H2O、2H++2e−=H2↑或2H2O+2e−===H2↑+2OH−;
(2)金属镁的物质的量是0.004 mol,气体的物质的量是0.001 mol,Mg与总气体物质的量比值为4:1,由图知:NO2:H2:N2:NO=1:1:3:5,设NO2、H2、N2、NO系数分别为1,1,3,5,Mg为40。根据电子转移的数目:产生1 mol NO2,转移1 mol。同理H2:2 mol,N2:10 mol,NO:3 mol,因此总共转移电子为(1×1+1×2+3×10+5×3) mol=48 mol,但是40 mol的Mg,转移80 mol电子,还差了32 mol,所以一定是还有NH4NO3生成,生成1 mol NH4NO3,转移8 mol电子,现在有32 mol电子,所以是4 mol NH4NO3,再根据N守恒,H守恒可知反应为40Mg+100HNO3===5NO↑+H2↑+NO2↑+3N2↑+4NH4NO3+40Mg(NO3)2+41H2O。








