

贵州省六盘山育才中学2020届高三第五次月考化学(解析版) 试卷
展开贵州省六盘山育才中学2020届高三第五次月考
7.中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是( )
A.我国近年来大力发展核电、光电、风电、水电。电能属于一次能源
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
8.化合物如图的分子式均为C7H8。下列说法正确的是( )
A.W、M、N均能与溴水发生加成反应
B.W、M、N的一氯代物数目相等
C.W、M、N分子中的碳原子均共面
D.W、M、N均能使酸性KMnO4溶液褪色
9.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10−12 NA
C.30g乙酸和葡萄糖混合物中的氢原子数为2NA
D.标准状况下,2.24L C2H6含有的共价键数为0.6NA
10.W、X、Y、Z均为短周期元素,原子序数依次增加,W的原子核最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )
A.原子半径:Y>Z>X>W
B.简单氢化物的稳定性:X>Z>W
C.最高价氧化物的水化物的酸性:W>Z
D.X可分别与W、Y形成化合物,其所含的化学键类型相同
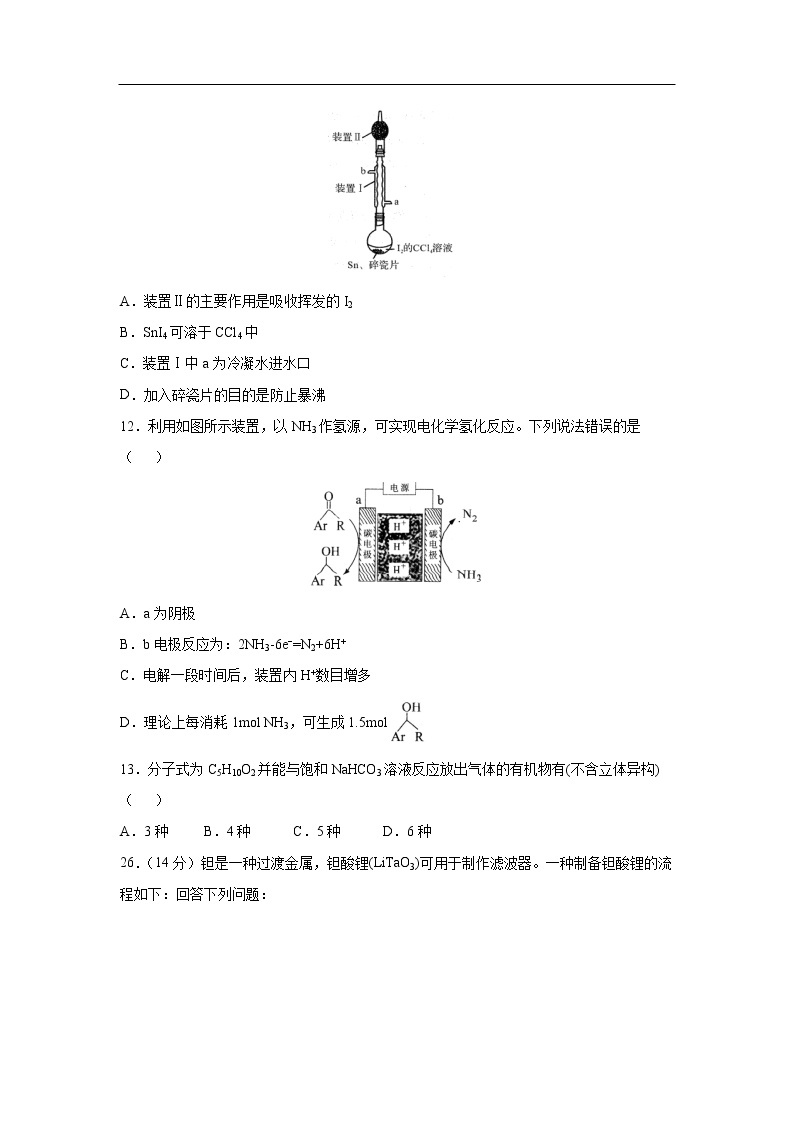
11.锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2SnI4制备SnI4。下列说法错误的是( )
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
12.利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是( )
A.a为阴极
B.b电极反应为:2NH3-6e−=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1mol NH3,可生成1.5mol
13.分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构) ( )
A.3种 B.4种 C.5种 D.6种
26.(14分)钽是一种过渡金属,钽酸锂(LiTaO3)可用于制作滤波器。一种制备钽酸锂的流程如下:回答下列问题:
(1)LiTaO3中钽的化合价为___。
(2)同体A呈红色,其主要成分是___________(写化学式),常见用途有_____________(填一种即可)。
(3)操作2的名称是___________,用来检验溶液B中阴离子的常用试剂是_________。
(4)HTaO3是_____(填字母)。
a.难溶的强酸 b.可溶的弱酸 c.可溶的强酸 d.难溶的弱酸
(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为_______________________________________。
(6)上述废料中含Ta2O5的质量分数为44.2%,杂质不含Ta元素。现有100kg该废料,按上述流程最多可制备_________kgLiTaO3。
27.(14分)为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸,然后关闭活塞b。
(1)B中盛装稀硫酸的仪器的名称是_____________。
(2)装置D的作用是_____________________________________,装置C中的实验现象为____________________________________________。
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为_________mg·L−1。
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN−的含量__________(选填“偏大”、“偏小”、“不变”)。
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为_________________。
(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,反应的离子方程式为_____________________________。
28.(15分)还原法处理氮的氧化物是环境科学研究的热点课题。
I.氧气还原法。H2还原NO发生的反应为:2NO(g)+2H2(g)N2(g)+2H2O(g)。
(1)已知儿种化学键的键能数据如下:
2NO(g)+2H2(g)N2(g)+2H2O(g) ΔH=_____kJ·mol−1。
(2)2NO(g)+2H2(g)N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2)(k是速率常数,只与温度有关)。科学研究发现上述反应分两步进行:
反应1:2NO(g)+H2(g)N2(g)+H2O2(g)
反应2:H2O2(g)+H2(g)2H2O(g)
总反应速率由反应较慢的一步决定,由此推知上述两步反应中,活化能较大的是反应___(填“l”或“2”)。c(NO)对总反应速率的影响程度_________c(H2)(填“大于”“小于”或“等于”)。
Ⅱ.NH3还原法。在恒容密闭容器中充入NH3和NO2,在一定温度下发生反应:8NH3(g)+6NO2(g)7N2(g)+12H2O(g)。
(3)下列表明该反应达到平衡状态的是___(填字母)。
A.混合气体密度保持不变 B.NO2和N2的消耗速率之比为6∶7
C.混合气体中c(N2)=c(NO2) D.混合气体压强保持不变
III.CO还原法。利用高效催化剂处理汽车尾气中的NO和CO,发生反应:2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH。在2L恒容密闭容器中充人2mol CO和2mol NO,测得NO的转化率与温度、时间的火系如图所示。
(4)下列说法正确的是_____(填字母)。
A.图像中,T1>T2
B.上述反应在高温下能自发进行
C.10min时,T2K下正、逆反应速率相等
D.增大NO的浓度,反应物的转化率增大
(5)T2K温度下,0~10min内用CO表示的平均反应速率v(CO)=___mol/L−1·min−1;T1K温度下,上述反应的平衡常数K=___L·mol−1。
(6)T1K温度下,向平衡后的容器内再加入2mol N2和2mol NO,则平衡___(填“向右移动”“向左移动”或“不移动”)。
35.【化学——选修3:物质的结构与性质】
铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3-中不存在的化学键有_________。
A.离子键 B.金属键 C.氢键 D.共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为d g·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
36.【化学——选修5:有机化学基础】
丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
已知:
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为__________,其反应类型为__________;
(2)D的化学名称是____________,由D生成E的化学方程式为__________________________________________________;
(3)J的结构简式为__________;
(4)G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应的结构简式__________(写出一种即可);
(5)由甲醛和化合物A经下列步骤可得到2一苯基乙醇:
反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
【参考答案】
7. 【答案】D
【解析】A.我国近年来大量减少化石燃料的燃烧,大力发展核电、光电、风电、水电,电能属于二次能源,故A错误;B.新型无机非金属材料在性能上比传统无机非金属材料有了很大的提高,可适用于不同的要求。如高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等都属于新型无机非金属材料,故B错误;C.光缆的主要成分是二氧化硅,故C错误;D.金属材料包括纯金属以及它们的合金,铝锂合金属于金属材料,故D正确;答案选D。
8. 【答案】D
【解析】A.由结构简式可知,W不能和溴水发生加成反应,M、N均能与溴水发生加成反应,故A错误;B.W的一氯代物数目为4种,M的一氯代物数目3种,N的一氯代物数目4种,故B错误;C.根据甲烷分子的正四面体结构、乙烯分子和苯分子的共面结构可知,W、N分子中的碳原子均共面,M中的碳原子不能共面,故C错误,D.W中与苯环相连的碳原子了有氢原子,M和N均含碳碳双键,故W、M、N均能被酸性KMnO4溶液氧化,故D正确;答案:D。
9. 【答案】C
【解析】A.标准状况下,HF是液态,22.4L的H2和22.4L的F2混合后,气体分子数少于2NA。B.常温下pH=12的NaOH溶液,由于缺少溶液的体积,水电离出的氢离子没法计算。C.乙酸和葡萄糖的实验式均为CH2O,式量为30,30g乙酸和葡萄糖混合物中的氢原子数为2NA,故C正确; D.1mol C2H6含有7mol共价键数,标准状况下,2.24L C2H6含有的共价键数为0.7NA,故D错误;故选C。
10. 【答案】B
【解析】W原子的最外层电子数是次外层的2倍,则W为碳(C);X-、Y+具有相同的电子层结构,则X为氟(F),Y为钠(Na);Z的阴离子不能发生水解反应,则Z为氯(Cl)。A.比较原子半径时,先看电子层数,再看最外层电子数,则原子半径Na>Cl>C>F,A错误;B.非金属性F>Cl>C,所以简单氢化物的稳定性X>Z>W,B正确;C.非金属性C
【解析】A,SnI4易水解,装置Ⅱ的主要作用是防止空气中的水蒸气进去到反应装置中,故A错误;符合题意B,根据相似相溶原理,SnI4是非极性分子溶于CCl4非极性分子中,故B正确,不符合题意;C,冷凝水方向是“下进上出”,因此装置Ⅰ中a为冷凝水进水口,故C正确,不符合题意; D,在液体加热时溶液暴沸,因此需要加入碎瓷片,碎瓷片的目的是防止暴沸,故D正确,不符合题意。综上所述,答案为A。
12. 【答案】C
【解析】根据图像可知,b极氨气中的N原子化合价由-3变为0价,得电子为电解池的阳极,则b极为阴极,化合价降低得电子;电解质溶液中的氢离子向阴极移动;A.分析可知,a为阴极得电子,A正确;B.b电极氨气中的N原子化合价由-3变为0价,生成氮气和氢离子,其电极反应为:2NH3-6e−=N2+6H+,B正确;C.电解一段时间后,a电极消耗溶液中的氢离子,装置内H+数目不变,C错误;D.理论上每消耗1mol NH3,消耗溶液中3mol氢离子,发生加成反应,可生成1.5mol,D正确;答案为C。
13. 【答案】B
【解析】能与Na2CO3反应放出气体,气体为二氧化碳,则化学式为C5H10O2的物质为羧酸,分子中含有官能团-COOH,该有机物可以书写为:C4H9COOH,丁烷分子中含有的位置不同的氢原子数目,即为该羧酸的同分异构体数目;丁烷存在的同分异构体为:①CH3CH2CH2CH3和②CH(CH3)3,其中①CH3CH2CH2CH3中存在2种位置不同的H原子;②CH(CH3)3中也存在2种CH(CH3)3,所以满足条件的该有机物同分异构体总共有:2+2=4种,故选B。
26. 【答案】(1)+5 (2)Fe2O3 制作颜料 (3)过滤 AgNO3和稀硝酸
(4)d (5) (6)47.2
【解析】含Ta2O5、FeO及油脂的废料在空气中高温出去油脂将FeO氧化为Fe2O3,加NaOH溶液得NaTaO3过量盐酸得HTaO3,再加Li2CO3灼烧得LiTaO3。(1)LiTaO3中钽的化合价为X=0-(+1)-(-2)×3=+5,故答案为:+5;(2)固体A为Fe2O3,可用于制作颜料;故答案为:Fe2O3;制作颜料;(3)操作2用于分离溶液B和固体HTaO3,故操作2为过滤;溶液B中含有阴离子为Cl−,可用AgNO3和稀硝酸来鉴别;故答案为:过滤;AgNO3和稀硝酸;(4)由操作2过滤可知HTaO3为难溶性酸,溶液A中含有TaO与盐酸反应生成HTaO3,HTaO3为弱酸;故答案为:d;(5)烧渣与NaOH溶液转化成溶液A的过程中,发生反应的离子方程式为;故答案为:;(6)100kg该废料中含Ta2O5质量 则Ta2O5物质的量,则LiTaO3物质的量为200mol,LiTaO3质量;故答案为:47.2。
27. 【答案】(1)分液漏斗
(2)防止空气中的CO2进入装置C中 有白色沉淀生成,溶液的红色逐渐变浅(或褪去)
(3)78 偏大
(4)Cl−+ClO−+2H+=Cl2↑+H2O
(5)5H2O2+2CN−=N2↑+2HCO+4H2O(或5H2O2+2CN−+2OH−=N2↑+2CO+6H2O)
【解析】实验的原理是利用CN−+ClO−=CNO+Cl−;2CNO−+2H++3ClO−=N2↑+2CO2↑+3Cl−+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,装置A是除去通入空气中所含二氧化碳,装置B中的反应是CN−+ClO−=CNO+Cl−;2CNO−+2H++3ClO−=N2↑+2CO2↑+3Cl−+H2O,通过装置C吸收生成的二氧化碳,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰。(1)B中盛装稀硫酸的仪器的名称是分液漏斗,故答案为:分液漏斗;(2)实验的原理是利用CN−+ClO−=CNO+Cl−;2CNO−+2H++3ClO−=N2↑+2CO2↑+3Cl−+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,故答案为:防止空气中的CO2和水蒸气进入C装置;有白色沉淀生成,溶液的红色逐渐变浅(或褪去); (3)①依据反应CN−+ClO−=CNO+Cl−;2CNO−+2H++3ClO−=N2↑+2CO2↑+3Cl−+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成59.1mg沉淀为BaCO3↓物质的量==3×10−4mol
CN−∼CNO−∼CO2∼BaCO3↓
1 1
3×10−4mol 3×10−4mol
c(CN−)==0.078g/L=78g/L,故答案为:78;②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,空气中二氧化碳也会和氢氧化钡溶液反应,生成碳酸钡出的质量会增大,测定含氰废水中CN−的含量偏大,故答案为:偏大;(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的气体单质为氯气,是氯离子和次氯酸根离子在酸溶液中发生氧化还原反应生成,反应的离子方程式为:Cl−+ClO−+2H+=Cl2↑+H2O,故答案为:Cl−+ClO−+2H+=Cl2↑+H2O;(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,结合电子守恒、原子守恒和电荷守恒书写离子方程式为:5H2O2+2CN−=N2↑+2HCO+4H2O (或5H2O2+2CN−+2OH−=N2↑+2CO+6H2O),故答案为:5H2O2+2CN−=N2↑+2HCO+4H2O(或5H2O2+2CN−+2OH−=N2↑+2CO+6H2O)。
28. 【答案】(1)-666 (2)1 大于 (3)BD (4)AC
(5)0.08 1 (6)向右移动
【解析】(1)ΔH=反应物的化学键断裂吸收的能量-生成物的化学键形成释放的能量反应2NO(g)+2H2(g)N2(g)+2H2O(g) ,故答案为:-666;(2)2NO(g)+2H2(g)N2(g)+2H2O(g)的反应速率表达式为v=kc2(NO)·c(H2),反应1:2NO(g)+H2(g)N2(g)+H2O2(g);反应2:H2O2(g)+H2(g)2H2O(g)。总反应速率由反应较慢的一步决定,则反应1反应速率慢活化能高,由反应速率表达式可知c(NO)对总反应速率的影响程度大于c(H2);故答案为:1;大于;(3)恒容容器中8NH3(g)+6NO2(g)7N2(g)+12H2O(g),反应达到平衡,正反应速率等于逆反应速率故NO2和N2的消耗速率之比为6∶7,B正确;反应为增压反应,容器中压强不变则可证明反应达到平衡,故D正确;A.密度恒定不变,无法说明达到平衡;C.c(N2)=c(NO2)浓度相等不等于反应速率相等,故C错误;故答案选BD。(4)对于反应2CO(g)+2NO(g) N2(g)+2CO2(g):A.由图像可知初始反应速率T1>T2,则温度T1>T2,故A正确;B.T1>T2平衡时转化率T1
则平衡常数K=,故答案为:0.08;1;(6)T1K温度下,向平衡后的容器内再加入2mol N2和2mol NO,则浓度商Q=<1故平衡正移,故答案为:向右移动。
35.【答案】(1)第四周期Ⅷ族 [Ar]3d5或1s22s22p63s23p63d5 (2)AC
(3)K<C<O<N sp、sp2 2∶1 (4)4
(5)分子 (6)
【解析】(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,位于第四周期Ⅷ族据;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为) [Ar]3d5或1s22s22p63s23p63d5故答案为:第四周期Ⅷ族,[Ar]3d5或[Ar]3d5或1s22s22p63s23p63d5;(2)[Fe(CN)6]3−是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用力,不是化学键,故选AC;故答案为:AC;(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为K
(2)2-甲基丙烯 CH2=C(CH3)2+HBr→(CH3)3CBr
(3) (4)或或
(5)光照 镁、乙醚
【解析】比较A、B的分子式可知,A与HBr发生加成反应生成B,B的核磁共振氢谱只有一组峰,则可知D为CH2=C(CH3)2,E为(CH3)3CBr,根据题中已知①可知F为(CH3)3CMgBr,C能发生银镜反应,同时结合G和F的结构简式可推知C为,进而可以反推得,B为,A为,根据题中已知①,由G可推知H为,J是一种酯,分子中除苯环外,还含有一个五元环,则J为,与溴发生取代生成K为,K在镁、乙醚的条件下生成L为,L与甲醛反应生成2-苯基乙醇。(1)由A生成B的化学方程式为+Br2+HBr,其反应类型为取代反应;(2)D为CH2=C(CH3)2,名称是2-甲基丙烯,由D生成E的化学方程式为CH2=C(CH3)2+HBr→(CH3)3CBr,故答案为2-甲基丙烯;CH2=C(CH3)2+HBr→(CH3)3CBr;(3)根据上面的分析可知,J的结构简式为,故答案为;(4)G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应,说明有酚羟基,这样的结构为苯环上连有-OH、-CH2Br呈对位连结,另外还有四个-CH3基团,呈对称分布,或者是-OH、-C(CH3)2Br呈对位连结,另外还有2个-CH3基团,以-OH为对称轴对称分布,这样有或或;(5)反应Ⅰ的为与溴发生取代生成K为,反应条件为光照,K在镁、乙醚的条件下生成L为,故答案为光照;镁、乙醚;。








