

2020年高考化学三轮冲刺要点突破讲练 专题05 再议化工流程
展开05 再议化工流程
【难点突破】
一、原料预处理的各种方法
1.粉碎或研磨:增大固液(或固气或固固)接触面积,加快反应(溶解)速率,增大原料的转化率(或浸取率)。
2.煅烧或灼烧:不易转化的物质转为容易提取的物质;其他矿转化为氧化物;除去有机物;除去热不稳定的杂质。
3.浸取:向固体中加入适当溶剂或溶液,使其中可溶性的物质溶解,包括水浸取、酸溶、碱溶、醇溶等。
4.酸浸:溶解、去氧化物(膜)、抑制某些金属离子的水解、除去杂质离子等。
5.碱浸:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀)。
6.水浸:与水接触反应或溶解。
7.水洗:用水洗去可溶性杂质,类似的还有酸洗、醇洗等。
8.浸出率:固体溶解后,离子在溶液中的含量的多少。
【例1】(节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(1) 步骤①的目的是去除废铁屑表面的油污,方法是_________________。
【答案】(1) 碱煮水洗
【解析】(1)步骤①的目的是去除废铁屑表面的油污,油污在碱性条件下容易水解,所以工业上常常用热的碳酸钠溶液清洗,即碱煮水洗。
【对点练习】
1.MgSO4·7H2O可用于造纸、纺织、陶瓷、油漆工业,也可在医疗上用作泻盐。某工业废渣主要成分是MgCO3,另外还有CaCO3、SiO2等杂质。从此废渣中回收MgSO4·7H2O的工艺如下:第一不用硫酸浸出。 “浸出”步骤中,为提高镁的浸出率,可采取的措施有 (要求写出任意一条)。
二、调节溶液的PH:
1.目的:使溶液中的…………金属阳离子形成氢氧化物完全沉淀下来而除去。
2.需要的物质:含主要阳离子的难溶性氧化物或氢氧化物或碳酸盐,即能与H+反应,是PH增大的物质如用MgO、Mg(OH)2等等。
3.原则:不管是调高还是调低,原则都是加过量的除杂剂而不引进新的杂质,这里分两种情况(1)如果要得到滤液,可加固体沉淀剂消耗H+或OH—,如除去含Cu2+溶液中混有的Fe3+,可通过加入CuO、Cu(OH)2、Cu(OH)2CO3等;(2)要得到滤渣,则需加入碱性溶液,如氨水或氢氧化钠溶液。调低PH值的原则与调高PH的原则相同。
4.PH控制的范围:大于除去离子的完全沉淀值,小于主要离子的开始沉淀的PH。
5.题目呈现方式:题中通常会以表格数据形式,或“已知信息”给出需求的适宜PH范围的信息(大于除去离子的完全沉淀值,小于主要离子的开始沉淀的PH);
6.解题步骤:(1)判断溶液呈酸(或碱)性;(2)判断调高还是调低;(3)选择合适的调节试剂。
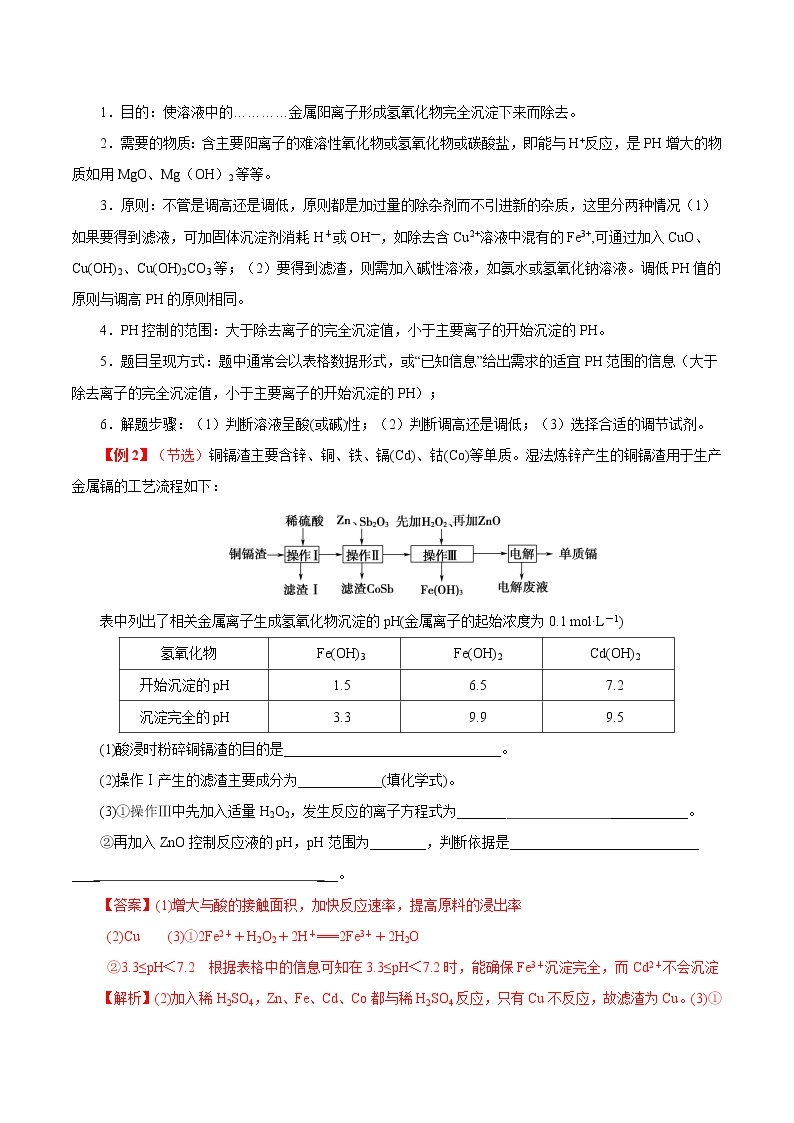
【例2】(节选)铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如下:
表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 mol·L-1)
氢氧化物
Fe(OH)3
Fe(OH)2
Cd(OH)2
开始沉淀的pH
1.5
6.5
7.2
沉淀完全的pH
3.3
9.9
9.5
(1)酸浸时粉碎铜镉渣的目的是_______________________________。
(2)操作Ⅰ产生的滤渣主要成分为____________(填化学式)。
(3)①操作Ⅲ中先加入适量H2O2,发生反应的离子方程式为_______ ___________。
②再加入ZnO控制反应液的pH,pH范围为________,判断依据是___________________________ ____ ___。
【答案】(1)增大与酸的接触面积,加快反应速率,提高原料的浸出率
(2)Cu (3)①2Fe2++H2O2+2H+===2Fe3++2H2O
②3.3≤pH<7.2 根据表格中的信息可知在3.3≤pH<7.2时,能确保Fe3+沉淀完全,而Cd2+不会沉淀
【解析】(2)加入稀H2SO4,Zn、Fe、Cd、Co都与稀H2SO4反应,只有Cu不反应,故滤渣为Cu。(3)①加入适量H2O2,将Fe2+氧化为Fe3+,根据氧化还原规则和质量守恒可知反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。②加入ZnO提高pH,将Fe3+转化为Fe(OH)3过滤除去,同时不能损失Cd2+,所以控制反应液的pH范围为3.3~7.2。
【例3】(节选)氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种工业酸性废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42—)中回收氧化铁流程如图所示:
已知:常温下Ksp[Mg(OH)2]=1.2×10-11;Ksp[Fe(OH)2]=2.2×10-16;Ksp[Fe(OH)3]=3.5×10-38;Ksp[Al(OH)3]=1.0×10-33
(3)常温下,根据已知条件计算在pH=5的溶液中,理论上下列微粒在该溶液中可存在的最大浓度c(Fe3+)=_________。
(4)有人用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是____________(填化学式,下同),用___________试剂可将其除去。
【答案】 (3)3.5×10-11 mol/L (4)Al(OH)3 NaOH
【解析】 (3)溶液pH=5,则c(OH-)=10-9mol•L-1,根据Ksp[Fe(OH)3]=3.5×10-38,则c(Fe3+)==3.5×10-11mol•L-1;(4)根据Ksp[Al(OH)3]=1.0×10-33,可计算出溶液pH=5时,c(OH-)=10-9mol•L-1,c(Al3+)==1.0×10-6<1.0×10-5,Al3+也几乎完全沉淀,Mg2+没有沉淀故可能混有的杂质是Al(OH)3;Al(OH)3溶于强碱,而Fe(OH)3不溶,故可用NaOH溶液除去。
【对点练习】
2.欲降低废水中重金属元素铬的毒性,可以将Cr2O72-转化为Cr(OH)3沉淀除去。已知Cr3+的氢氧化物开始沉淀的pH和完全沉淀的pH分别为5.0和7.0,Fe3+的氢氧化物开始沉淀的pH和完全沉淀的pH分别为2.7和3.7,Fe2+的氢氧化物开始沉淀的pH和完全沉淀的pH分别为7.6和9.6。(1)某含铬废水处理的主要流程如图所示:
调节溶液pH至 ,可使得到的金属阳离子Fe3+和Cr3+沉淀完全。
3.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知:阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物
Fe(OH)3
Al(OH)3
Mg(OH)2
pH
3.4
5.2
12.4
一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。
(2)上述流程中两次使用试剂X,推测试剂X是 (填以下字母编号)
A.水 B.氧化铝 C.氨水 D.氢氧化钠
三、体系环境氛围及其它条件的控制
(1)蒸发或结晶时,加入相应的酸或碱,以抑制某些盐的水解;
(2)需要在HCl气流中干燥FeCl3、AlCl3 、MgCl2等含水晶体,以防止水解。如从海水中提取镁,从MgCl2的溶液里结晶析出的是氯化镁结晶水合物,电解熔化氯化镁才能制得金属镁,要去除氯化镁晶体中的结晶水需要在HCl气流中加热,否则煅烧所得的最后固体不是MgCl2,而是熔点更高的MgO, 具有相似情况的还有FeCl3 、AlCl3等;
(3)营造还原性氛围:加热煮沸酸液后再冷却,其目的是排除酸溶液中的氧气,如用废铁制备绿矾晶体,需要把硫酸加热煮沸后再加入,同时还不能加入过量,防止Fe2+被氧化;
(4)营造氧化性氛围:加入氧化剂进行氧化,如加入绿色氧化剂 H2O2 将 Fe2+ 氧化转化为Fe3+等 。
四、温度的控制
1.加热:(1)加快反应速率或溶解速率;(2)促进平衡向吸热方向移动;(3)除杂,除去热不稳定的杂质,如NaHCO3 、Ca(HCO3)2、KMnO4、I2、NH4Cl等物质;(4)使沸点相对较低或易升华的原料气化。
2.降温:(1)防止某物质在高温时会溶解(或分解) ;(2)使化学平衡向着题目要求的方向移动(放热方向);(3)使某个沸点较高的产物液化,使其与其他物质分离;(4)降低晶体的溶解度,减少损失。
3.控温(用水浴或油浴控温便于控温且受热均匀):(1)防止某种物质温度过高时会分解或挥发;(2)为了使某物质达到沸点挥发出来;(3)使催化剂的活性达到最好;(4)防止副反应的发生;降温或减压可以减少能源成本,降低对设备的要求,达到绿色化学的要求;(5)若题目中出现了包括产物在内的各种物质的溶解度信息,则要根据它们的溶解度随温度升高而改变的情况,寻找合适的结晶分离方法 ( 蒸发结晶或冷却结晶) 。
【例4】(节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为__________(填标号)。
【答案】 (2)加快反应速率 水浴加热 C
【解析】 (2)步骤②需要加热的目的是为了加快反应速率;温度保持80~95 ℃,由于保持温度比较恒定且低于水的沸点,故采用的合适加热方式是水浴加热(热水浴);铁屑中含有少量硫化物,硫化物与硫酸反应生成硫化氢气体,可以用氢氧化钠溶液吸收,为了防止倒吸可以加装倒置的漏斗,故选择C装置。
五、浓度、压强的控制
1.增大反应物浓度 、 加压:(1)可加快反应速率 。对气体分子数减少的反应,加压使平衡向生成物方向移动。但压强太大,动力消耗更多,设备要求更高,成本增加,故必须综合考虑;(2)加压一般是提高气体反应物浓度措施 ,在气体和固体、液体反应的体系中并不适宜;(3)生产中常使廉价易得的原料适当过量,以提高另一原料的利用率。
2.减压蒸馏:减小压强,降低液体的沸点,防止(如浓HNO3、NH3.H2O、H2O2、NH4HCO3)等物质分解。
六、除杂、实验操作类
1.盐溶液的分离提纯方法:结晶法
(1)纯物质溶液得到晶体:蒸发结晶(NaCl型);蒸发浓缩(至有晶膜出现为止),冷却结晶(KNO3型和含有结晶水的晶体)。
(2)混合溶液(分离A和B):蒸发结晶,趁热过滤(得NaCl型),将滤液冷却结晶,过滤(得KNO3型)。
(3)由FeCl3、AlCl3、CuCl2、MgCl2等溶液获取对应晶体,采取的措施是:在干燥的HCl气氛中加热蒸干。
模板:加热浓缩→冷却结晶→过滤→洗涤→干燥
仪器:蒸发皿、玻璃棒、烧杯
【例5】(节选)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
回答下列问题:
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
【答案】(3) 将Fe2+全部氧化为Fe3+,不引入新的杂质 因为H2O2本身易分解,所以在加入时需分量加入,同时为了防止Fe3+水解 (4) 加热浓缩、冷却结晶、过滤(洗涤)
【解析】(3)步骤③中选用足量的H2O2,H2O2可以将Fe2+氧化为Fe3+,且H2O2的还原产物为H2O,不会引入新的杂质,故理由是:将Fe2+全部氧化为Fe3+,不引入新的杂质。因为H2O2本身易分解,所以在加入时需分量加入,同时为了防止Fe3+水解,溶液要保持pH小于0.5;(4)为了出去可溶性的硫酸铵、铁离子等,需要经过的步骤为:加热浓缩、冷却结晶、过滤(洗涤)。
2.沉淀洗涤
(1)沉淀洗涤的目的:除去沉淀表面附着或沉淀中包夹的可溶性离子。
①水洗:洗去晶体表面的杂质离子(适用于溶解度小的物质);
②冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗(适用于高温溶解度大、低温溶解度小的物质)。
(2)洗涤方法:向漏斗内加蒸馏水至浸没沉淀,待水自然流出后,重复操作2~3次。
(3)误差分析:若沉淀不洗涤或洗涤不干净,则使沉淀的质量偏高。若沉淀洗涤次数过多,则会使部分沉淀溶解而使其质量偏低。
(4)沉淀是否洗涤干净的判断方法
答题模板
取最后一次洗涤液少量于试管中,滴加……(试剂),若没有……现象,证明沉淀已洗净
3.实验操作
答题模板
取少量待测液于试管中,滴加……(试剂,用量),若没有……现象,证明没有……;若出现……现象,证明含有……
当滴入最后一滴×××标准溶液后,溶液变成×××色,且半分钟内不恢复原来的颜色。
四、终点现象的描述:
【例6】(节选)锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
Li2CO3在不同温度下的溶解度如下表:
温度/℃
0
10
20
50
75
100
Li2CO3的溶解度/g
1.539
1.406
1.329
1.181
0.866
0.728
请回答下列问题:
反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称 ,洗涤所得Li2CO3沉淀要使用 (选填“热水”或“冷水”),你选择的理由是_____________________________________________________________________________________。
【对点练习】
4.(节选)镍电池电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的pH如下表所示:
M(OH)n
Ksp
开始沉淀时pH
沉淀完全时的pH
Al(OH)3
1.9×10-23
3.4
4.2
Fe(OH)3
3.8×10-38
2.5
2.9
Ni(OH)2
1.6×10-14
7.6
9.8
(3) 检验电解滤液时阳极产生的气体的方是: 。
(5) 如何检验Ni(OH)3是否洗涤干净? 。
5.取20.00mL富碘卤水放入___(填仪器名称)中,将0.1 mol·L-1的酸性高锰酸钾溶液装入滴定管中,达到滴定终点的标志是________ ___。
6.“除杂”操作是加入适量过氧化氢,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中少量Fe2+。检验Fe2+是否除尽的实验操作是________ ___。
七、滤液和滤渣的成分判断
◆熟记常见难溶于水微溶于水的物质
①盐酸盐:AgCl 、HgCl、CuCl ; ② 硫酸盐:BaSO4、PbSO4、CaSO4、Ag2SO4。
③碳酸盐、亚硫酸盐:除K、Na、NH4+外均难溶;④氢氧化物:除KOH、NaOH、Ba(OH)2、NH3·H2O外均难溶。
【例7】NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
【答案】B
【解析】含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)加入硫酸酸溶,滤渣1为SiO2,滤液1含有NiSO4、CuSO4、FeSO4,加入FeS,可除去Cu2+,生成滤渣2含有CuS,滤液2加入碳酸钠,可生成碳酸亚铁,加入硫酸溶液可生成硫酸亚铁,蒸发结晶得到硫酸亚铁晶体,滤液3含有NiSO4。A项,根据流程图分析最终目的是制备FeSO4·7H2O,为避免生成杂质,所以“酸溶”时应选用硫酸,A正确;B项,FeS可转化为溶解度更小的CuS,由于亚铁离子易被氧化,则滤液中可含有Fe3+,Fe3+氧化S2-生成S单质,则滤渣2的成分为CuS、FeS和S,B错误;C项,由溶液得到晶体,可用蒸发结晶的方法,C正确;D项,合理处理废弃物,可减少污染,有利于保护环境和资源再利用,D正确;故选B。
【对点练习】
7.由菱镁矿(主要成分为MgCO3、CaCO3、FeCO3、SiO2)制备高纯Mg(OH)2的一种工艺如下:
下列说法不正确的是( )
A.“煅烧”时FeCO3发生反应为4FeCO3+O22Fe2O3+4CO2
B.“浸取”产生的气体X为NH3
C.“滤渣1”“滤渣2”分别为SiO2、CaSO4
D.“沉镁”所得的固体是否洗涤干净可用BaCl2溶液检验
【答案】C
【解析】菱镁矿通入空气中煅烧,得到MgO、CaO、Fe2O3,SiO2不反应,加入水和氯化铵,得到氨气、氯化镁、氯化钙,过滤,除去不溶解的SiO2、Fe2O3,所以“滤渣1”主要成分为SiO2、Fe2O3,向滤液中加入硫酸镁,氯化钙与硫酸镁反应生成硫酸钙的沉淀和氯化镁溶液,“滤渣2”为CaSO4,然后向滤液中加入氨气,得到氢氧化镁沉淀。过滤,得到高纯度的氢氧化镁。A项,煅烧碳酸亚铁,得到二氧化碳气体和氧化铁固体,反应方程式为:4FeCO3+O2 2Fe2O3+4CO2,A正确;B项,MgCO3经过煅烧得到MgO,加入水和氯化铵浸取,得到氯化镁、氨气和水,故“浸取”产生的气体 X 为 NH3,B正确;C项,由分析可知,“滤渣 1”为 SiO2和Fe2O3、“滤渣 2”为CaSO4,C错误;D项,“沉镁”步骤所得的固体进行洗涤,如果没有洗净,固体表面有残留的SO42-,加入BaCl2溶液,若产生白色沉淀,就证明未洗涤干净,否则洗涤干净,D正确;故选C。
八、氧化还原反应和反应方程式的相关信息
1.选择合适的氧化剂:不引入新的杂质,无污染等;
2.离子方程式的书写;
3.氧化还原反应方程式的书写。
思路:(1)、判断出氧化剂、还原剂、氧化产物和还原产物
(2)配平三部曲
①电子守恒;
②电荷守恒;
③原子守恒。
九、相关计算
与Ksp、平衡常数相关的计算(计算pH、计算离子浓度)
【例8】(节选)铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如下:
表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 mol·L-1)
氢氧化物
Fe(OH)3
Fe(OH)2
Cd(OH)2
开始沉淀的pH
1.5
6.5
7.2
沉淀完全的pH
3.3
9.9
9.5
③若加入的H2O2不足,加入ZnO后所得的电解液中会含有Fe元素。请设计实验方案加以鉴别:______________________________________。
(4)处理含镉废水常用加入碳酸钙实现沉淀转化,该沉淀转化的反应方程式为___________________________________。除去工业废水中的Cd2+时,若反应达到平衡后溶液中c(Ca2+)=0.1 mol·L-1,溶液中c(Cd2+)=________mol·L-1[已知25 ℃,Ksp(CdCO3)=5.6×10-12,Ksp(CaCO3)=2.8×10-9]。
【答案】③取待电解液少量于试管中,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红{或向其中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀},则待电解液中含有Fe元素(其他合理答案即可)
(4)CaCO3(s)+Cd2+(aq) ⇌ CdCO3(s)+Ca2+(aq) 2.0×10-4
【解析】③若加入的H2O2不足量,则待电解溶液中有Fe2+残余。(4)除去废水中的Cd2+时,若反应达到平衡后溶液中c(Ca2+)=0.1 mol/L,则溶液中的c(CO)=Ksp(CaCO3)÷c(Ca2+)=2.8×10-9÷0.1=2.8×10-8mol/L,溶液中c(Cd2+)=Ksp(CdCO3)÷c(CO)=5.6×10-12÷2.8×10-8=2×10-4 mol/L。
【例9】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上以废铁为主要原料生产氧化铁黄的一种工艺流程如下:
(1)废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是 (填离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是 。
(3)检验洗涤是否完全的方法是 。
(4)色光度是产品质量的指标之一,合格氧化铁黄的色光度值范围为-0.5~0.5。
①氧化过程若温度太高,会导致产品颜色偏红,可能含有的杂质是 。
②氧化过程溶液pH对产率、色光度的影响如右图所示,氧化时应控制pH的合理范围是 ,pH过小导致产率较低的可能原因是 。
【答案】(1)CO32-+H2O ⇌ HCO3-+OH-
(2)4FeSO4+O2+8NaOH==4FeOOH↓+4Na2SO4+2H2O
(3)取少量最后一次的洗涤滤液于试管中,向其中滴入盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全,否则未洗涤完全
(4)①Fe2O3[或Fe(OH)3] ②3.5~4.0 pH过小导致氧化铁黄部分溶于酸(或抑制Fe3+水解等其他答案合理即可)
【解析】(1)纯碱的水溶液因Na2CO3的水解而显碱性,能使废铁表面的油污水解。(2)过量的废铁屑中加入浓硫酸后生成FeSO4,通入空气后,在碱性条件下被氧化成FeOOH。(3)因为在氧化过程中生成了Na2SO4,滤渣是否洗涤干净,主要看洗涤滤液中是否存在SO42-,若含有SO42-则未洗涤干净。(4)①铁的化合物中,Fe2O3、Fe(OH)3呈红褐色,故产品偏红是因为含有Fe2O3或Fe(OH)3。②由图数据看出,pH在3.5~4.0时,色光度值在合格范围内且产率较高;pH过小时,FeOOH能与H+反应,从而使得产率较低。








