

河北省石家庄市第二中学2020届高中毕业班四月份教学质量监测卷理科综合化学部分
展开石家庄市第二中学2020届高中毕业班四月份教学质量监测卷
理科综合化学部分
说明: 1.全卷满分300分,考试时间150分钟。
2.全卷分为试题卷和答题卡,答案要求写在答题卡上,不得在试题卷上作答,否则不给分。
第Ⅰ卷(选择题共126分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5 K 39 Ti 48 Fe 56 I 127 Ag-108
一、选择题:本大题包括13小题,每小题6分。在每小题给出的四个选项中,只有一项符合题目要求。
7.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
8.用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
9.在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+c(s)2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( )
A.反应CO2(g)+c(s)2CO(g) △S>0、△H<0
B.体系的总压强P总:P总(状态Ⅱ)<2P总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ)
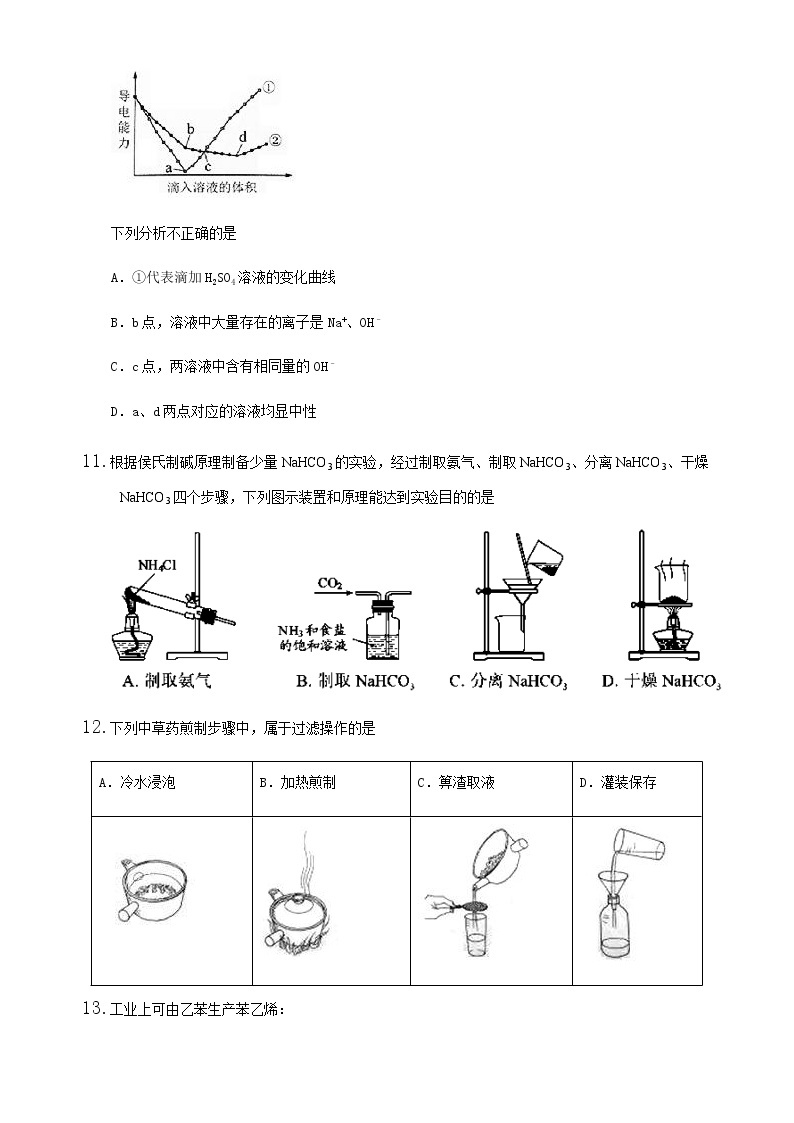
10.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
11.根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
12.下列中草药煎制步骤中,属于过滤操作的是
A.冷水浸泡 | B.加热煎制 | C.箅渣取液 | D.灌装保存 |
13.工业上可由乙苯生产苯乙烯:
,下列说法正确的是
A.该反应的类型为加成反应
B.乙苯的同分异构体共有三种
C.可用Br2/CCl4鉴别乙苯和苯乙烯
D.乙苯和苯乙烯分子内共平面的碳原子数均为7
三、非选择题:包括必考题和选考题两部分。第22题-第32题为必考题每个试题考生都必须作答,第33题-第38题为选考题,考生根据要求作答。
(一)必考题:11题,共129分。
26.(14分)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应,反应中生成K2MnO4、MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为 ,阴极逸出的气体是 。
③“电解法”和“歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
27.(15分)碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2·3H2O,该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;②取25.00 mL溶液A,加入足量AgNO3溶液,得AgCl 0.1722 g;③另取25.00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L−1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2−CuY2−+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)。
28.(14分)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
(二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。注意所做题目的题号必须与所涂题目的题号一致,在答题卡选答区域指定位置答题。如果多做,则每学科按所做的第一小题计分。
35.【化学—选修3:物质结构与性质】(15分)
碳及其化合物广泛存在于自然界中,回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态原子中,核外存在 对自旋相反的电子。
(2)碳在形成化合物时,其键型以共价键为主,原因是 。
(3)CS2分子中,共价键的类型有 ,C原子的杂化轨道类型是 ,写出两个与CS2具有相同空间构型和键合形式的分子或离子 。
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于 晶体。
碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
①在石墨烯晶体中,每个C原子连接 个六元环,每个六元环占有 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接 个六元环,六元环中最多有 个C原子在同一平面。
36.【化学—选修5:有机化学基础】(15分)
功能高分子P的合成路线如下:
(1)A的分子式是C7H8,其结构简式是___________________。
(2)试剂a是_______________。① ③ ② ④ ⑤ ⑥ n
(3)反应③的化学方程式:_______________。
(4)E的分子式是C6H10O2。E中含有的官能团:_______________。
(5)反应④的反应类型是_______________。
(6)反应⑤的化学方程式:_______________。
(5)已知:。
以乙烯为起始原料,选用必要的无机试剂合成E,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
参考答案
一、选择题
二、非选择题 CDCCCCC
26.(1)增大反应物接触面积,加快反应速率,提高原料利用率;
(2)2MnO2+4KOH + O22K2MnO4+2H2O;
(3)提高氧气的压强,加快反应速率,增加软锰矿转化率;
(4)①KHCO3;②MnO42−−e−=MnO4−;H2;③3:2;
(5)。
27.(1)①4CuCl + O2+ 8H2O2Cu2(OH)2Cl2·3H2O ②Fe2+
(2)n(Cl−)=n(AgCl)×==4.800×10−3mol
n(Cu2+)=n(EDTA)×
=0.08000 mol·L−1×30.00 mL×10−3 L·mL−1×=9.600×10−3 mol
n(OH−)=2n(Cu2+)−n(Cl−)=2×9.600×10−3 mol-4.800×10−3 mol=1.440×10−2 mol
m(Cl−)=4.800×10−3 mol×35. 5 g· mol −1 =0.1704 g
m(Cu2+)=9.600×10−3 mol×64 g· mol −1 =0.6144 g
m(OH−)=1.440×10−2 mol×17 g· mol −1 =0.2448 g
n(H2O)==4.800×10−3 mol
a∶b∶c∶x = n(Cu2+)∶n(OH−)∶n(Cl−)∶n(H2O)=2∶3∶1∶1
化学式为Cu2(OH) 3Cl·H2O
28.(1)—99;+41(2);a;反应①为放热反应,平衡常数应随温度升高变小;
(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高
35.(1)电子云 2 (2)C有4个价电子且半径较小,难以通过得或失电子达到稳定电子结构
(3)σ键和π键 sp CO2、SCN- (4)分子 (5)①3 2 ②12 4
36.(1)(2)浓硫酸和浓硝酸
(3)
(4)碳碳双键、酯基 (5)加聚反应
(6)(7)








