

高中化学常考基本理论知识归纳
展开(1)原子核中无中子的原子:H。
(2)最外层有1个电子的元素:H、Li、Na。
(3)最外层有2个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数2倍的元素:C;是次外层电子数3倍的元素:O;是次外层电子数4倍的元素:Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)电子总数为最外层电子数2倍的元素:Be。
(8)次外层电子数是最外层电子数2倍的元素:Li、Si。
(9)内层电子总数是最外层电子数2倍的元素:Li、P。
(10)电子层数是最外层电子数2倍的元素:Li。
(11)最外层电子数是电子层数2倍的元素:He、C、S。
(12)最外层电子数是电子层数3倍的元素:O。
2.核外电子总数为10的微粒
分子(5种):Ne、HF、H2O、NH3、CH4
阳离子(5种):Na+、Mg2+、Al3+、N、H3O+
阴离子(5种):F-、O2-、N3-、OH-、N
3.核外电子总数为18的微粒
分子:Ar、HCl、H2S、PH3、SiH4、H2O2、N2H4、C2H6
阳离子:K+、Ca2+
阴离子:Cl-、S2-、HS-、
4.元素周期律的具体表现形式
(二)化学反应速率与化学平衡常考点归纳
1.判断化学平衡状态的方法
(1)“两审”
一审题干条件,是恒温恒容还是恒温恒压;二审反应特点:①反应前后气体体积是否发生变化;②反应是吸热反应还是放热反应。
(2)“两标志”
①等:v正=v逆
分析v正、v逆的关系。主要分析在某一可逆反应中,正反应消耗掉某反应物的速率是否等于逆反应生成该物质的速率。
②定:达到平衡状态时,反应混合物中各组分的含量一定
a.分析体系中各组分的物质的量浓度、体积分数、物质的量分数是否保持不变。
b.对于有有色物质参加或生成的可逆反应,体系的颜色是否不再随时间而变化。例如,2NO2(g) N2O4(g)。
c.体系中某反应物的转化率或某生成物的产率是否达到最大值或不再随时间而变化。
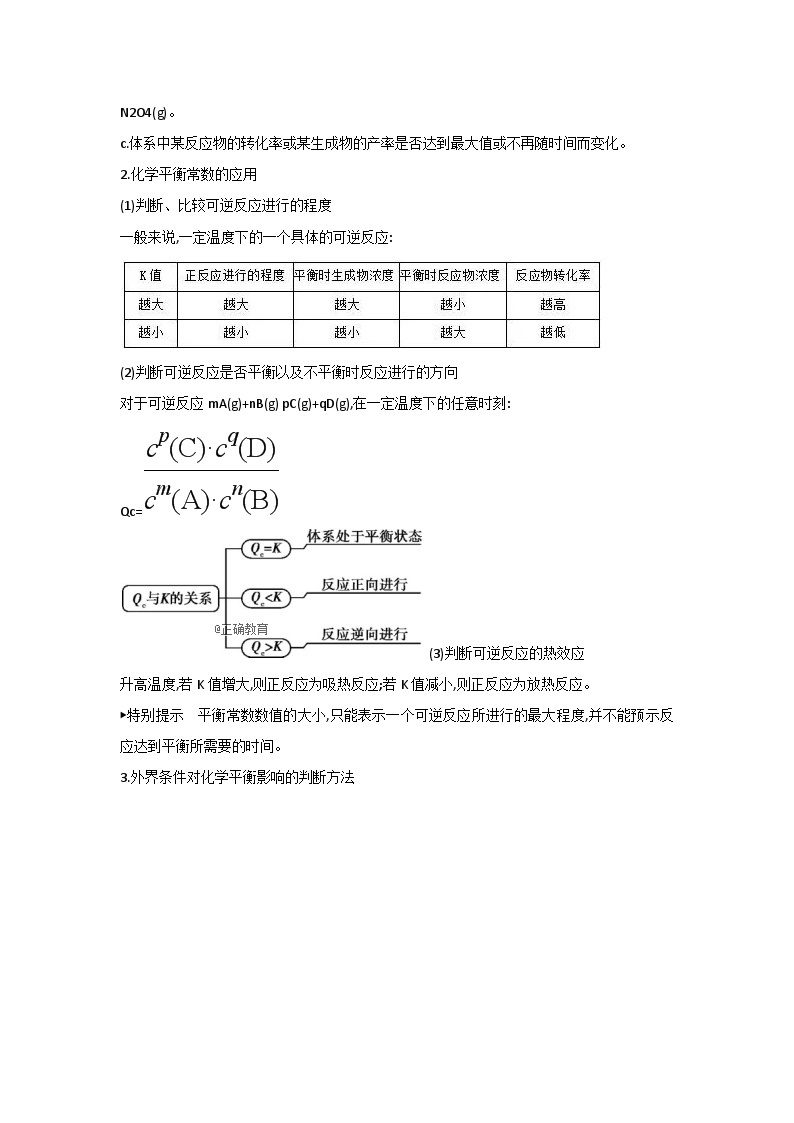
2.化学平衡常数的应用
(1)判断、比较可逆反应进行的程度
一般来说,一定温度下的一个具体的可逆反应:
(2)判断可逆反应是否平衡以及不平衡时反应进行的方向
对于可逆反应mA(g)+nB(g) pC(g)+qD(g),在一定温度下的任意时刻:
Qc=
(3)判断可逆反应的热效应
升高温度,若K值增大,则正反应为吸热反应;若K值减小,则正反应为放热反应。
▶特别提示 平衡常数数值的大小,只能表示一个可逆反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。
3.外界条件对化学平衡影响的判断方法
(三)电解质溶液
1.等浓度、等pH的盐酸和醋酸溶液的比较
2.溶液中微粒浓度的三大定量关系
(1)电荷守恒规律
电解质溶液中,无论存在多少种离子,溶液都是呈电中性的,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。如NaHCO3溶液中存在着Na+、H+、HC、C、OH-,其电荷守恒关系为:c(Na+)+c(H+)=c(HC)+c(OH-)+2c(C)。
(2)物料守恒规律
电解质溶液中,由于某些离子能够水解或电离,离子种类有所变化,但原子总是守恒的。如K2S溶液中S2-、HS-都能水解,故S原子以S2-、HS-、H2S三种形式存在,且有如下守恒关系:c(K+)=2c(S2-)+2c(HS-)+2c(H2S)。
(3)质子守恒规律
如Na2S水溶液中的质子转移情况图示如下:
由图可得到Na2S水溶液中的质子守恒式:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。质子守恒关系式也可以由电荷守恒式与物料守恒式推导得到。
(四)电化学原理常考点归纳
1.燃料电池电极反应式的书写
(1)正极反应式的书写
正极通入的气体一般是氧气,根据电解质的不同,分以下几种情况:
①在酸性溶液中生成水:
O2+4H++4e- 2H2O
②在碱性溶液中生成氢氧根离子:
O2+2H2O+4e- 4OH-
③在固体电解质(高温下能传导O2-)中生成O2-:
O2+4e- 2O2-
④在熔融碳酸盐(如熔融K2CO3)中生成碳酸根离子:
O2+2CO2+4e- 2C。
(2)负极反应式的书写
负极通入的是燃料,发生氧化反应,负极生成的离子一般与正极产物结合,有以下几种情况:
①若负极通入的气体是氢气,则
a.酸性溶液中:H2-2e- 2H+;
b.碱性溶液中:H2-2e-+2OH- 2H2O;
c.熔融氧化物中:H2-2e-+O2- H2O。
②若负极通入的气体为含碳的化合物,如CO、CH4、CH3OH等,碳元素均转化为正四价碳的化合物,在酸性溶液中生成CO2,在碱性溶液中生成C,熔融碳酸盐中生成CO2,熔融氧化物中生成C;含有的氢元素最终生成水。如CH3OH燃料电池负极反应式在酸性溶液中为CH3OH-6e-+H2O CO2↑+6H+,在碱性溶液中为CH3OH-6e-+8OH- C+6H2O。
2.以惰性电极电解电解质溶液的类型和规律
▶注意 电解水型的电解质溶液为稀溶液时才符合上述规律。
专题21 化学反应速率 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年): 这是一份专题21 化学反应速率 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年),共21页。
专题29 乙醇 乙酸 基本营养物质 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年): 这是一份专题29 乙醇 乙酸 基本营养物质 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年),共20页。
专题32 烃的含氧衍生物 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年): 这是一份专题32 烃的含氧衍生物 常考点归纳与变式演练 学案 高中化学 二轮复习 人教版(2022年),共23页。












