






- 【期中复习】人教版2019必修第二册2023-2024学年高一下册化学 专题06 化学反应的速率与限度(考点专练)(8大题型).zip 试卷 0 次下载
- 【期中复习】人教版2019必修第二册2023-2024学年高一下册化学 专题06 化学反应的速率与限度(考点梳理+练习).zip 试卷 0 次下载
- 【期中复习】人教版2019必修第二册2023-2024学年高一下册化学 第六章 化学反应与能量(考点梳理) 课件 0 次下载
- 【期中模拟】人教版2019必修第二册2023-2024学年高一下册化学 期中测试卷一【测试范围:第五、六章】.zip 试卷 1 次下载
- 【期中模拟】人教版2019必修第二册2023-2024学年高一下册化学 期中测试卷二【测试范围:第五、六章】.zip 试卷 0 次下载
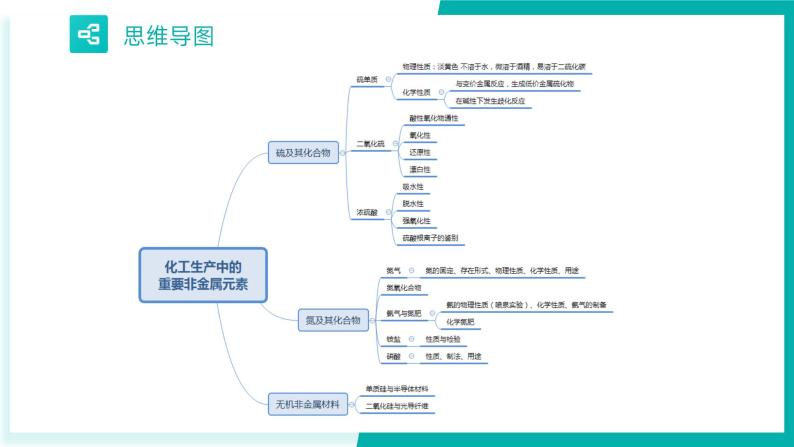
【期中复习】人教版2019必修第二册2023-2024学年高一下册化学 第五章 化工生产中的重要非金属元素(考点梳理)
展开考点01 硫及其化合物
一、硫单质物理性质:淡黄色 不溶于水,微溶于酒精,易溶于CS2化学性质:1. 与金属反应 (规律:硫与变价金属反应,生成低价金属硫化物)2. 在碱性下发生歧化反应:3S+6NaOH 2Na2S+Na2SO3+3H2O (应用:用于除试管底部残留的硫粉)
二、二氧化硫酸性氧化物的通性: ① 与水反应:SO2+H2O H2SO3
② 与碱性氧化物反应:SO2 + CaO = CaSO3③ 与碱反应:SO2(少量)+2NaOH=Na2SO3+H2O SO2(少量)+Ca(OH)2=CaSO3↓+2H2O 2SO2(过量)+Ca(OH)2=Ca(HSO3)2④ 与某些盐反应:SO2+Na2CO3=NaSO3+CO2
漂白性 品红 无色溶液 品红+SO2↑
还原性:2SO2+O2 2SO3 SO2+X2+2H2O=H2SO4+2HX(X=Cl、Br、I)
氧化性:2H2S +SO2 = 3S↓ + 2H2O
SO2与有色物质化合生成不稳定的无色物质,这些无色物质容易分解而恢复原色。【若Cl2与SO2等物质的量混合,则二者都失去漂白Cl2+SO2+H2O=2HCl+H2SO4】
吸水性:是指浓H2SO4吸收游离水的性能。应用:浓H2SO4是一种理想的干燥剂,但不能干燥的气体有:NH3、H2S、HI、HBr等。脱水性:是指浓H2SO4将有机物中氢氧元素按氢氧原子个数比2:1夺出。应用:浓H2SO4是很多有机反应的脱水剂。强氧化性:是指硫酸分子中+6价的硫易得电子,通常被还原为SO2。铜与浓硫酸反应:Cu+2H2SO4 (浓) CuSO4 +2H2O+SO2 ↑ 浓硫酸与木炭反应:C+2H2SO4(浓) 2H2O+CO2↑+2SO2↑硫酸根离子的鉴别:先加盐酸,无现象后再加氯化钡,若产生白色沉淀则证明有硫酸根。
【典例01】【硫单质】下列有关单质硫的说法中,不正确的是A.硫单质与变价金属反应时一般生成低价态的金属硫化物B.单质硫燃烧时,氧气少量时生成SO2,氧气足量时可通过一步反应生成SO3C.残留在试管内壁上的硫可用CS2溶解除去,也可用热的NaOH溶液除去D.汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理
【典例02】【二氧化硫】双碱法脱硫过程如图所示,下列说法错误的是A.过程I中,SO2未被氧化B.双碱法脱硫过程中,Ca(OH)2可以循环利用C.过程II中,1mlO2可氧化2mlNa2SO3D.总反应为2Ca(OH)2+2SO2+O2=2CaSO4+2H2O
【演练02】【二氧化硫】某研究性学习小组欲用如图所示的装置证明酸性:H2SO3>HClO。正确的是
A.通过本实验能得出非金属性: Cl>SB.可以去掉C、D装置,将从B中出来的气体直接通入E中, 若观察到有沉淀析出,则证明酸性:H2SO3>HClOC.B中饱和NaHSO3溶液的作用是除去挥发的HCl气体D.A中的酸不用浓硫酸的原因是浓硫酸与亚硫酸钠发生氧 化还原反应,不能制得二氧化硫气体
【典例03】【浓硫酸】用下图所示实验装置(夹持仪器已略去)探究足量铜丝与5mL物质的量浓度为18ml/L的浓硫酸的反应。下列说法不合理的是
A.上下移动①中铜丝可控制SO2的量B.充分反应后消耗铜丝的质量为2.88gC.③中选用NaOH溶液吸收多余的SO2D.为确认CuSO4生成,应该冷却后把①中混合物慢慢倒入盛有水的烧杯中,观察颜色
【演练03】【浓硫酸】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。不正确的是
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3∶2B.相对于途径①、③,途径②更好地体现了绿色化学思想C.1mlCuSO4在1100℃受热分解,若所得混合气体X中含有两种成分,则O2为0.75mlD.Y应该具有还原性
考点02 氮及其化合物
一、氮气氮的固定(简称固氮):将游离态的氮转化为含氮化合物叫做氮的固定。
氮的固定主要有自然固氮和人工固氮(或工业固氮)两种方式。
高能固氮(放电或高温)
生物固氮(大豆植物根瘤菌)
无机化合物:氧化物、硝酸、NH3、铵盐
有机化合物:氨基酸、蛋白质和核酸
纯净的氮气是一种无色、无味、无毒的气体,密度比空气的稍小。氮气在水中的溶解度很小,通常状况下,1体积水中只能溶解大约0.02体积的氮气。在压强为101kPa时,氮气在-195.8℃时变成无色液体,在-209.9℃时变成雪花状固体。
一、氮气氮气的化学性质
N2 + 3Mg Mg3N2
制冷剂,保护气,冷藏食品,制氨气、硝酸、化肥。
氨的物理性质无色、有刺激性气味的气体;标况下,密度为0.771g/L,比空气轻;极易溶于水且能快速溶解,在常温常压下,1体积水能溶解700体积氨气。
三要 ① 装置气密性——要好; ② 烧瓶和气体——要干; ③ 烧瓶内的气体——要满。
氨的喷泉实验成功的关键
氨的化学性质: (1)与水反应:NH3+H2O NH3 · H2O NH4++OH- (2)与酸反应:NH3+HCl=NH4Cl(生成白烟) NH3+H2SO4=(NH4)2SO4 NH3+HNO3=NH4NO3 用途:可以检验氨气的存在。
(3)与氧化剂反应: ①与氧气反应(NH3体现还原性): 4NH3+5O2======4NO+6H20(工业制硝酸的基础) ②与Cl2反应:8NH3+3Cl2=N2+6NH4Cl(用于检验Cl2是否泄漏) ③与CuO反应:2NH3+3CuON2+3Cu+3H2O (4)与还原剂反应:4NH3+6NO=5N2+6H2O
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
实验室快速制氨气的方法
浓氨水滴入生石灰(或NaOH)中制氨气
① 铵态氮肥(NH4+):硫铵[(NH4)2SO4]、碳铵(NH4HCO3)、氯化铵(NH4Cl)、硝铵(NH4NO3)。② 硝态氮肥(NH3-):硝铵(NH4NO3)③ 有机态氮肥:尿素[CO(NH2)2]
注意:a、铵态氮肥不能与碱性物质如草木灰等混合使用。 b、碳铵储存时,应密封包装并放在阴凉通风处。
铵盐的物理性质:白色晶体,易溶于水。铵盐的化学性质: (1)受热分解:NH4HCO3 2NH3↑+CO2↑+H2O NH4Cl NH3↑+HCl,NH3+HCl=NH4Cl (试管底部白色固体减少,试管壁上出现白色固体) (NH4)2CO3 NH3↑+CO2↑+H2O (2)与碱反应:NH4++OH- NH3↑+H2O
因为铵盐中存在NH4+,所以铵盐的检验主要就是NH4+的检验。(1)若试样为固体,可用两种方法来检验: 方法一:取少量样品放入研钵中,加入固态碱进行研磨。若闻到有氨的刺激性气味,说明样品中含有NH4+。 方法二:取少量样品与碱混合于试管中,然后加热,将湿润的红色石蕊试纸靠近管口试纸变蓝,说明样品中有NH4+;也可将蘸有浓盐酸的玻璃棒靠近管口,若有白烟产生,说明样品中含有NH4+。(2)若试样为液体,可取少量液体注入试管中,再加入碱液,微热,然后用湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒检验。
硝酸的物理性质:纯净的硝酸是无色、易挥发、有刺激性气味的液体,熔点为-42℃,沸点为83℃,密度为1.5g/cm3,质量分数为95%以上的浓硝酸在空气中由于挥发出硝酸蒸汽会产生“发烟“现象,通常叫做发烟硝酸。硝酸的化学性质:(1)强酸性:具有酸的通性。(2)不稳定性:浓硝酸受热或见光分解成红棕色的NO2气体。 4HNO3(浓) 4NO2↑+O2↑+2H2O 硝酸越浓,越易分解。浓硝酸久置呈黄色,是由于硝酸分解产生的NO2溶于稀硝酸。为了防止硝酸见光分解,一般将它保存在棕色试剂瓶里,放置在阴凉处。
(3)强氧化性: ① 与金属反应:4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O 剧烈反应,铜不断溶解,溶液先变绿后变蓝,生成红棕色气体。 8HNO3(稀)+3Cu=3Cu(NO3)2+2NO↑+4H2O 反应速度慢,铜不断溶解,溶液变蓝,生成无色气体,遇空气后变成红褐色。 【常温下,浓硝酸可使铁、铝表面形成致密的氧化膜而钝化。】 【浓硝酸与浓盐酸的混合物(体积比3:1)叫王水,能使一些不溶于硝酸的金属如铂、金等溶解。】 ② 与非金属反应:4HNO3(浓)+C CO2↑+4NO2↑+2H2O
硝酸的工业制法: 4NH3+5O2=====4NO+6H2O 2NO+O2====2NO2 3NO2+H2O====2HNO3+NO硝酸的用途:重要的化工原料,常用来制氮肥、染料、塑料、炸药、硝酸盐等。
【典例01】【氮气】下列关于氮的固定,说法不正确的是A.在雷雨天,N2可直接转化为NOB.工业上将氨转化为硝酸和其他含氮化合物的过程被称之为人工固氮C.氮的固定的过程中氮原子有可能被氧化,也有可能被还原D.一些豆科植物的根瘤菌可以将空气中的N2转化为硝酸盐
【演练01】【氮气】下列关于氮气性质的说法中正确的是A.点燃条件下,N2在氧气中燃烧生成NOB.点燃时,N2与金属Mg反应生成Mg3N2,N2作还原剂C.合成氨反应中,N2发生氧化反应D.氮气的化学性质稳定,其原因是两个氮原子之间以共价三键结合
【典例02】【氮氧化物】关于氮氧化物的说法正确的是A.NO和NO2都是常见的酸性氧化物,可以在一定条件下相互转化B.在NO2被水吸收的反应中,NO2只作氧化剂。C.氨催化还原法指的是用氨作还原剂,将NO、NO2转化为无毒的气体D.NO、NO2都是大气污染气体,在空气中都能稳定存在
【演练02】【氮氧化物】下列气体去除杂质的方法中,能实现目的的是
【典例03】【氨气与氮肥】下列关于氨气、液氨、氨水的叙述不正确的是A.氨气、液氨均为纯净物B.蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒相互靠近,有白烟生成C.液氨常用来作制冷剂D.氨气溶于水能导电,氨气是电解质
【演练03】【氨气与氮肥】下列关于实验室(用熟石灰和氯化铵)制氨气的说法,正确的是 A.NH4Cl可以换为NH4HCO3,Ca(OH)2可以换为NaOHB.检验氨气可以用润湿的蓝色石蕊试纸或蘸有浓盐酸的玻璃棒C.棉花团的作用是防止空气中的水蒸气进入D.在实验室里也可按如右图所示装置干燥并收集气体NH3,且吸收多余的NH3
【典例04】【铵盐】下列描述正确的是A.氯化铵和氯化钠的固体混合物可用升华法分离B.将少量硫酸铵和熟石灰混合在研钵中进行研磨,可以闻到刺激性气味C.检验某白色固体是铵盐的方法是:加氢氧化钠溶液,加热,用湿润蓝色石蕊试纸在试管口检验,观察试纸是否变红D.所有铵盐都易溶于水,铵盐中的氮元素均为-3价
【演练04】【铵盐】下列关于铵盐的说法,错误的是A.绝大多数铵盐易溶于水B.铵盐受热易分解,并且都能产生氨气C.铵盐能与热的浓NaOH溶液反应生成氨气D.铵盐都是离子化合物
【典例05】【硝酸】我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指硝酸,下列有关硝酸的相关描述中正确的是A.王水指浓硝酸与浓盐酸按3:1的体积比混合所得的混合物B.向装有Fe(NO3)2溶液的试管中加入稀硫酸,可在试管口观察到红棕色气体C.常温下,浓硝酸可以用铝制容器储存,说明浓硝酸与铝不反应D.稀HNO3与金属反应时,可被还原为更低价态,说明稀HNO3氧化性强于浓HNO3
【演练05】【硝酸】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
A.由①中的红棕色气体,推断产生的气体一定都是氮的氧化物B.②中产生红棕色气体说明②中木炭与浓硝酸产生了反应C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D.③的气体产物中检测出CO2由此说明木炭一定与浓硝酸发生了反应
考点03 无机非金属材料
一、单质硅与半导体材料硅的物理性质:单质硅有晶体硅和无定形硅(非晶体)两种。 ① 晶体硅是灰黑色、有金属光泽、硬而脆的固体。 ② 单质硅的导电性介于导体和绝缘体之间。硅的存在状态:化合态。硅的化学性质:常温下,硅的化学性质不活泼,在加热条件下可发生反应。
一、单质硅与半导体材料工业获取硅:
制得粗硅:SiO2+2C Si+2CO↑进一步提纯:Si+2Cl2 SiCl4 SiCl4+2H2 Si+4HCl
硅的用途: 用做半导体材料,制造晶体管、集成电路、硅整流器和太阳能电池等。
二、二氧化硅与光导纤维
二氧化硅的物理性质:二氧化硅广泛存在于自然界中,沙子、石英的主要成分是二氧化硅。二氧化硅的熔点高、硬度大,不溶于水。纯净的二氧化硅是无色透明的晶体。
SiO2+2C Si+2CO↑SiO2+CaO CaSiO3SiO2+2NaOH=Na2SiO3+H2OSiO2+4HF=SiF4↑+2H2O(常被用来刻蚀玻璃)SiO2+Na2CO3 Na2SiO3+CO2↑SiO2+CaCO3 CaSiO3+CO2↑
二氧化硅常被用于制石英表中的压电材料和高性能的现代通信材料——光导纤维。
硅酸的物理性质:硅酸为白色粉末状固体,不溶于水。硅酸的化学性质:H2SiO3 H2O+SiO2 H2SiO3+2NaOH====Na2SiO3+2H2O 原硅酸:将较强酸溶液(或CO2气体)加入(通入)可溶性硅酸盐溶液中,即生成白色胶状的原硅酸(H4SiO4)。原硅酸几乎不溶于水,是弱酸,不稳定。这种白色胶状物在空气里放置一段时间后,会失水变成硅酸。
三、硅酸与硅酸盐:硅酸盐制品性质稳定,熔点较高,大都难溶于水。
硅酸盐的表示方法:硅酸盐的组成比较复杂,常用氧化物的形式表示。表示顺序:活泼金属氧化物、较活泼金属氧化物、二氧化硅、水。 玻璃: (1)主要原料:石灰石、纯碱、石英 (2)制玻璃的反应:Na2CO3+ SiO2 Na2SiO3+CO2↑ CaCO3+ SiO2 CaSiO3+CO2↑ (3)主要成分:Na2SiO3,CaSiO3,SiO2 (4)种类:普通玻璃、有色玻璃、铅玻璃、钢化玻璃 (5)主要性能:玻璃态物质没有固定的熔沸点,可在一定范围内软化。
水泥: (1)主要原料:粘土、石灰石、石膏等 (2)主要成分: 硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3) (3)主要性能:水硬性、不可逆性 陶瓷: (1)主要原料:粘土 (2)种类:土器、陶瓷、瓷器 (3)主要性能:抗氧化、抗酸碱腐蚀、耐高温、绝缘
硅酸钠的性质: 硅酸钠是极少数可溶于水的硅酸盐中的一种,其水溶液俗称“水玻璃”,是建筑业的一种黏合剂。 Na2SiO3+2HCl=2NaCl+H2SiO3↓ Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
【典例01】【单质硅与半导体材料】我国在科技领域取得了很多与化学密切相关的成就,下列说法不正确的是A.华为推出的麒麟9905G芯片成为全球第一款商用5G手机芯片,该芯片的主要成分是晶体硅B.“深海勇士”号载人潜水器使用的锂离子电池是二次电池C.“嫦娥五号”卫星带回的月壤中富含“完美能源”3He,3He与4He互为同素异形体D.中国天宫空间站上的所用的太阳能电池组,可将光能转化为电能
【演练01】【单质硅与半导体材料】《天工开物》被外国学者称它为“中国17世纪的工艺百科全书”,其中有许多关于化学的记载。下列说法不合理的是A.“凡弓弦取食柘叶蚕茧,其丝更坚韧”中的“丝”为蛋白质B.“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”中“瓦”的主要成分为二氧化硅C.“稻以糠为甲,麦以麸为衣”中“糠”的主要成分为纤维素D.“凡火药,硫为纯阳,硝为纯阴”,“硝”指硝酸钾,在反应中表现氧化性
【典例02】【二氧化硅与光导纤维】高纯硅广泛应用于信息技术和新能源技术等领域。从石英砂(主要成分为SiO2)制取高纯硅涉及的主要反应流程如下:
下列说法不正确的是A.反应①中氧化剂和还原剂的物质的量之比为1:2B.流程中HCl和H2可以循环利用C.高纯硅可用于制作光感电池、光导纤维的主要成分是SiO2D.SiO2 属于酸性氧化物,能与水反应生成硅酸
【演练02】【二氧化硅与光导纤维】关于无机非金属材料的说法错误的是A.无机非金属材料都是硅酸盐材料,包括玻璃、水泥、陶瓷B.新型无机非金属材料中有硅、高纯度的SiO2、碳纳米材料等C.新型陶瓷在光学、电学、热学、磁学等方面有新的特性和功能D.Si主要用于太阳能电池和芯片,SiO2主要用于光导纤维
【典例03】【硅酸与硅酸盐】下列说法不正确的是A.陶瓷是以黏土为主要原料,经高温烧结而成B.普通玻璃以纯碱、石灰和石英砂为原料制得C.向水泥中加入适量的石膏可以调节水泥硬化速率D.金刚砂具有类似金刚石的结构,硬度大,可用于制作砂纸和砂轮
【演练03】【硅酸与硅酸盐】下列实验不能达到实验目的的是
A.图1制取并观察Fe(OH)2B.图2验证酸性强弱:H2SO4>H2CO3>H2SiO3C.图3分离溶于CCl4中的溴D.图4验证碳酸钠与碳酸氢钠热稳定性:碳酸钠>碳酸氢钠
【期中复习】2023-2024学年(人教版2019必修第二册)高一化学下册 第五章 化工生产中的重要非金属元素-考点串讲课件: 这是一份【期中复习】2023-2024学年(人教版2019必修第二册)高一化学下册 第五章 化工生产中的重要非金属元素-考点串讲课件,共53页。PPT课件主要包含了无机非金属材料,氮及其化合物,思维导图,硫及其化合物,考点01,二氧化硫,浓硫酸,考点02,自然固氮,人工固氮等内容,欢迎下载使用。
高中化学第六章 化学反应与能量第一节 化学反应与能量变化示范课ppt课件: 这是一份高中化学第六章 化学反应与能量第一节 化学反应与能量变化示范课ppt课件,共14页。PPT课件主要包含了气体的干燥等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册实验活动4 用化学沉淀法去除粗盐中的杂质离子集体备课ppt课件: 这是一份高中化学人教版 (2019)必修 第二册实验活动4 用化学沉淀法去除粗盐中的杂质离子集体备课ppt课件,共16页。












