
第30讲 盐类水解(课件)-2024年高考化学一轮复习(新教材新高考)
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
知识梳理 题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
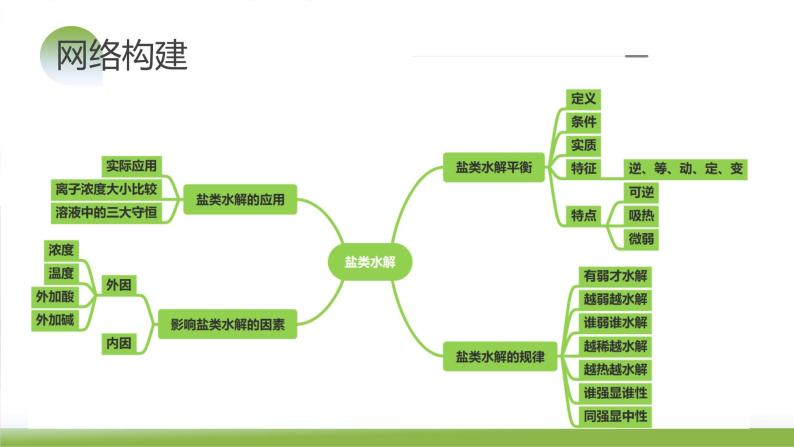
1.定义:在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子
(1)可逆:水解反应是可逆反应;
(2)吸热:水解反应是酸碱中和反应的逆反应;
(3)微弱:水解反应程度很微弱。
1. 盐的分类与盐溶液的酸碱性
知识点2 盐类水解规律
有弱才水解、无弱不水解、
越弱越水解、都弱都水解、
越热越水解、越稀越水解、
谁强显谁性、同强是中性
1.一般要求——水解记三点:
知识点3 盐类水解方程式的书写
③后无沉气出。即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
2.三种类型的盐水解离子方程式的书写
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3水解的离子方程式为Fe3++3H2O Fe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大(即产生沉淀),书写时要用“=”、“↑”、“↓”等。
如Na2S溶液与AlCl3溶液混合水解的离子方程式为2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
考向1 考查盐类的水解及溶液的酸碱性
【思维建模】酸式盐的水溶液的酸碱性判断
(1)强酸的酸式盐只电离,不水解,溶液一定显酸性,如:NaHSO4=Na++H++SO42-。
(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
考向2 考查盐类水解规律及应用
1.内因:形成盐的酸或碱越弱,其盐就越易水解。如水解程度:Na2CO3>Na2SO3,Na2CO3>NaHCO3。
知识点1 影响盐类水解的因素
知识点2 盐类水解的应用
1.盐类水解的重要应用
2.熟记下列因相互促进水解不能大量共存的离子组合
3.盐溶液蒸干灼烧时所得产物的判断
❷酸根离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。
❸考虑盐受热时是否分解。Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干灼烧后分别为Ca(HCO3)2―→CaCO3(CaO);NaHCO3―→Na2CO3;KMnO4―→K2MnO4和MnO2;NH4Cl―→NH3↑+HCl↑。
❹还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
❺弱酸的铵盐蒸干后无固体。如NH4HCO3、(NH4)2CO3。
(1)概念:能够抵御少量外来的酸、碱或稀释,而保持溶液的pH基本不变的溶液叫缓冲溶液。
(2)缓冲溶液的范围:pH=pKa±1 (浓度之比10倍或1/10)。
知识点3 水解常数及应用
2.水解常数与电离常数的关系
2)Kh与Ka(或Kb)、KW的关系
3.意义:水解常数可以表示盐的水解程度的大小,Kh越大,盐类水解程度越大。
4.外界影响因素:水解常数是只是温度的函数,Kh随温度的升高而增大。
(1)计算盐溶液中的c(H+)或c(OH-)
(2)判断水解程度大小、盐溶液的酸碱性
(3)判断水解程度和电离程度大小,盐溶液的酸碱性。
考向1 考查盐类水解的影响因素
考向2 考查盐类水解的应用
考向3 考查水解常数的应用与计算
电解质溶液中,无论存在多少种离子,溶液都呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。如NaHCO3溶液中存在着Na+、H+、HCO3-、CO32-、OH-,存在如下关系:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)。
知识点1 电解质溶液中的三大守恒
电解质溶液中,由于某些离子能够水解,离子种类增多,但元素的原子总是守恒的,或两种原子的数目比是固定的。如NaHCO3溶液中存在着Na+、H+、H2CO3、HCO3、-CO32-、OH-,Na与C比为1:1,故存在如下关系:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)。
①电解质溶液中,分子(或离子)得失质子(H+)的物质的量应相等。如Na2S水溶液中的质子转移情况图示如下:
即给出H+后剩余微粒浓度之和等于得到H+后生成微粒浓度之和,故由图可得Na2S水溶液中质子守恒式:c(H3O+)+2c(H2S)+c(HS-)=c(OH-)或c(H+)+2c(H2S)+c(HS-)=c(OH-)。
②可以通过物料守恒和电荷守恒推出质子守恒表达式。
如NaHCO3溶液中物料守恒:c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)①,
电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)②,
将①代入②中,整理得质子守恒:c(H2CO3)+c(H+)=c(OH-)+c(CO32-)
【易错提醒】混合溶液的质子守恒只能采用第2种方法求得。
1.单一溶液中粒子浓度的比较
(1)多元弱酸溶液:多元弱酸分步电离,电离程度逐级减弱。
知识点2 电解质溶液中粒子浓度大小比较
如H3PO4溶液中:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。
(2)多元弱酸的正盐溶液:多元弱酸的酸根离子分步水解,水解程度逐级减弱。
如在Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)。
(3)多元弱酸酸式盐:分析酸式酸根电离与水解大小。
如NaHCO3溶液中HCO3-水解大于电离,则;c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+)>c(CO32-)。
NaHSO3溶液中HSO3-电离大于水解,则c(Na+)>c(HSO3-)c(H+)>c(SO32-)>c(OH-)>c(H2SO3)。
2.混合溶液中各离子浓度的比较
混合溶液要综合分析电离、水解等因素。如在0.1 ml·L-1 NH4Cl溶液和0.1 ml·L-1的氨水混合溶液中,各离子浓度大小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+)。
3.不同溶液中同一离子浓度的比较
不同溶液要看溶液中其他离子对该离子的影响。如在相同物质的量浓度的下列溶液中:①NH4Cl②CH3COONH4③NH4HSO4,c(NH4+)由大到小的顺序为③>①>②。
4.电解质溶液中粒子浓度大小比较的思维模型
知识点3 水溶液中函数图像分析
(1)同体积、同浓度的盐酸、醋酸加水稀释
(2)同体积、同pH的盐酸、醋酸加水稀释
(3)稀释倍数与pH的线性关系
(1)分布曲线图是指以pH为横坐标,分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标,分布系数与溶液pH之间的关系曲线。弱电解质分布系数图本质上就是酸碱中和滴定过程中粒子含量的变化曲线。分布曲线是指以pH为横坐标、分布系数(即组分的平衡浓度占总浓度的分数)为纵坐标的关系曲线
(2)分布系数图的应用:①能读出电离常数;②能比较在溶液在某一特定pH时离子浓度的大小;能快速判断等浓度的缓冲溶液的酸碱性,由此比较得出电离与水解的大小。
考向1 考查单一溶液中粒子浓度大小比较
考向2 考查混合溶液中粒子浓度大小比较
1.(2023·浙江·高考真题)硫酸铜应用广泛,下列说法不正确的是A.Cu元素位于周期表p区 B.硫酸铜属于强电解质C.硫酸铜溶液呈酸性D.硫酸铜能使蛋白质变性
3.(2022·北京·高考真题)2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是A.醋酸钠是强电解质B.醋酸钠晶体与冰都是离子晶体C.常温下,醋酸钠溶液的pH>7D.该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
第30讲 盐类的水解-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第30讲 盐类的水解-备战2024年高考化学一轮复习精品课件(全国通用),共22页。PPT课件主要包含了盐类的水解的概念,CH3COO-,HCO3-,盐类水解的应用,HX>HY>HZ,H2SO4,带磨口玻璃塞的试剂瓶,颜色变深,颜色变浅,36×10-5等内容,欢迎下载使用。
第55讲 盐类的水解及应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第55讲 盐类的水解及应用-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共52页。PPT课件主要包含了复习目标,盐类水解原理及规律,考点一,必备知识,易错辨析,专项突破,水解常数及应用,考点二等内容,欢迎下载使用。
新高考化学一轮复习课件 第8章 第49讲 盐类的水解: 这是一份新高考化学一轮复习课件 第8章 第49讲 盐类的水解,共60页。PPT课件主要包含了高考化学一轮复习策略,盐类的水解,盐类的水解及其规律,真题演练明确考向,课时精练等内容,欢迎下载使用。