









第32讲 弱电解质的电离平衡及影响因素-【高效备考】2024年高考化学一轮复习讲义+分层练习
展开1.室温下,下列事实不能说明NH3·H2O为弱电解质的是( )
A.0.1 ml·L-1的氨水中c(OH-)<0.1 ml·L-1
B.0.1 ml·L-1的氨水中c(NHeq \\al(+,4))<0.1 ml·L-1
C.相同条件下,浓度均为0.1 ml·L-1的NaOH溶液和氨水,氨水的导电能力弱
D.0.1 ml·L-1的氨水能使无色酚酞溶液变红
2.下列关于强弱电解质的叙述正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.NH3、CH3COOH、BaSO4、H3PO4都是弱电解质
C.CO2溶于水后能部分电离,故CO2是弱电解质
D.纯净的强电解质在液态时,有的导电,有的不导电
3.下列说法不正确的是( )
A.pH 相等的 NaOH 和 Na2CO3 溶液c(NaOH) < c(Na2CO3)
B.稀释 0.1ml/L 醋酸溶液,其电离程度增大,pH 也增大
C.AlBr3 溶液蒸干后得到的固体是 AlBr3
D.分别用等体积的蒸馏水和稀硫酸洗涤 BaSO4 沉淀,用水洗涤造成 BaSO4 的损失量大于用稀硫酸洗涤时的损失量
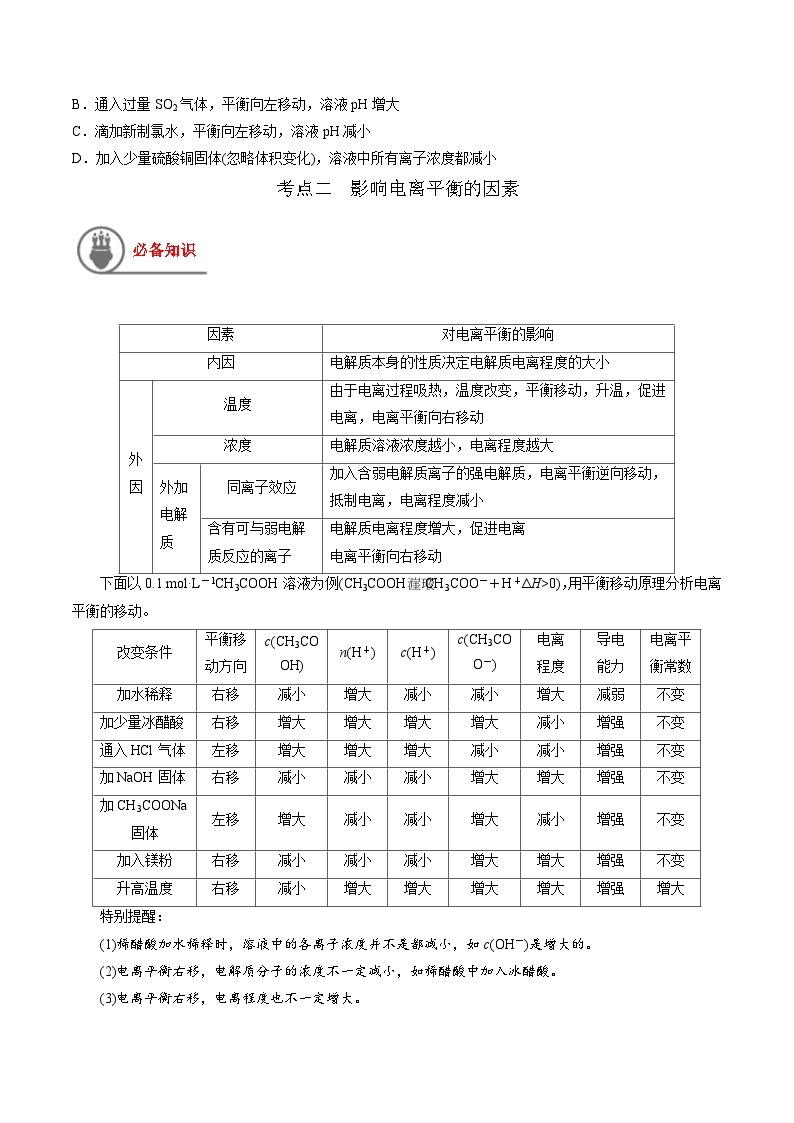
4.已知部分弱酸的电离平衡常数如表:
下列离子方程式正确的是( )
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-═CO+2HClO
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO
C.少量SO2通入Na2CO3溶液中:SO2+H2O+2CO═SO+2HCO
D.相同浓度NaHCO3溶液与醋酸溶液等体积混合:H++HCO═CO2↑+H2O
5.下列事实不能用来判断醋酸为弱电解质的是( )
A.常温下测定醋酸钠溶液的pH
B.比较相同大小的镁条与相同浓度的盐酸与醋酸反应的速率大小
C.比较相同体积、相同浓度的盐酸和醋酸分别与0.1ml∙L-1氢氧化钠溶液反应所消耗的氢氧化钠溶液的体积
D.比较相同浓度的盐酸和醋酸的导电能力
6.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是( )
7.相同温度下,根据三种酸的电离常数,下列判断正确的是( )
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-═HY+Z-能够发生
C.酸根离子结合氢离子的能力强弱关系为:Z->Y->X-
D.相同温度下,1ml/LHX溶液的电离常数大于0.1ml/LHX
8.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是( )
A.a、b、c三点溶液的pH:c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1 ml·L-1NaOH溶液中和,消耗NaOH溶液的体积:c<a<b
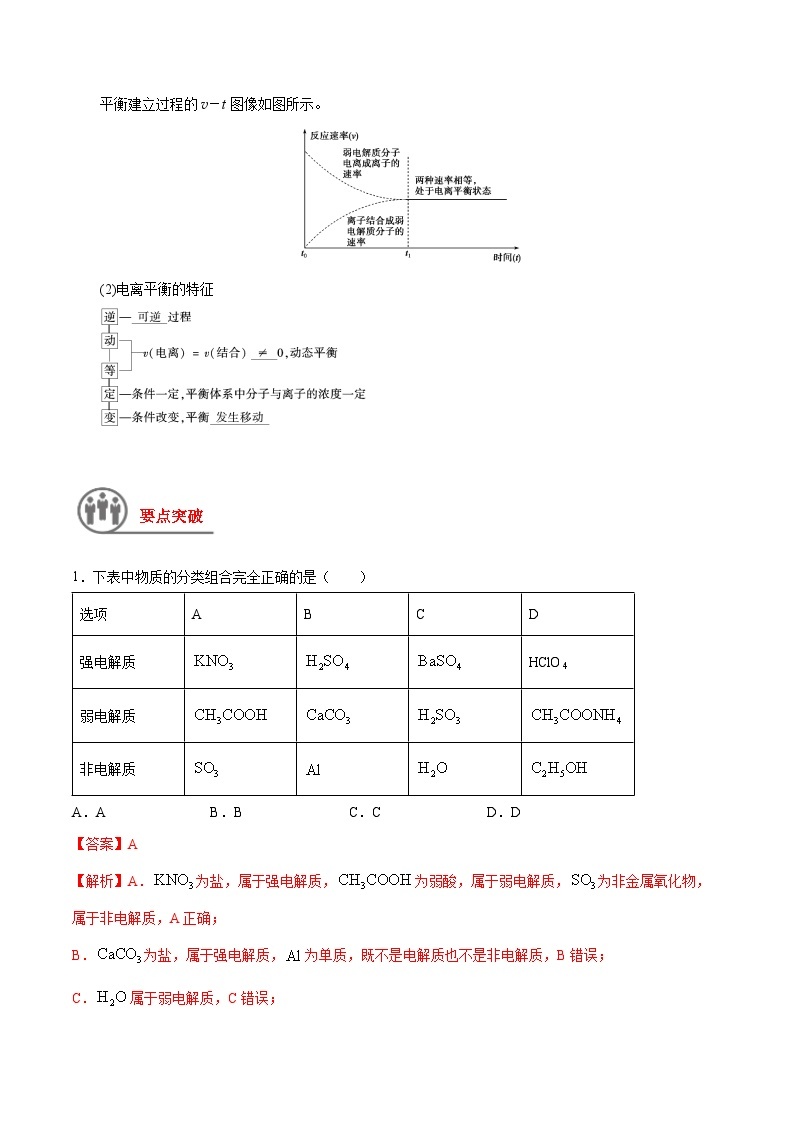
9.已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2OCH3COO-+H3O+ K1=1.75×10-5
CH3COO-+H2OCH3COOH+OH- K2=5.71×10-10
常温下将50 mL 0.2 ml·L-1醋酸与50 mL 0.2 ml·L-1醋酸钠混合制得溶液甲,下列叙述正确的是( )
A.甲溶液的pH>7
B.对甲进行微热,K1增大、K2减小
C.甲溶液中有c(CH3COO-)>c(Na+)>c(CH3COOH)
D.若在甲中加入5 mL 0.1 ml·L-1的盐酸,则溶液中醋酸的K1会变大
10.工业上生产尿素的过程会生成氨基甲酸铵(NH2COONH4)其加热时容易分解。一定温度下,n ml氨基甲酸铵在V L 密闭真空容器中分解:NH2COONH4(s)2NH3(g)+CO2(g)+Q
实验测得不同温度下容器内的平衡总压强如下表:
(1)根据上表判断,反应中Q____0(填写“>”或“<),判断依据是__________。
(2)能说明该反应达到平衡状态的是___________(填序号)。
a. c(NH3)/c(CO2)不再变化
b. v(NH3)=2v(CO2)
c.混合气体的平均分子质量不再变化
d.混合气体的密度不再变化
(3)写出该反应平衡常数的表达式K=_____。25°C时,反应t分钟后固体的物质的量减少一半,t分钟内用NH3表示的化学反应速率v(NH3)=____ ml/(L •min)。
(4)氨基甲酸铵在潮湿空气中可转化为氨水和碳酸氢铵。氨水、碳酸氢铵、氯化铵都是重要的氮肥。
①在含有酚酞的0.1ml·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色将_____
②将浓度为0.1ml·L-1氨水加水不断稀释,下列各量始终保持增大的是_____
A c(OH-) B Kb(NH3·H2O) C D
③25%C时,浓度均为0.01ml/L的氨水与NaOH溶液,下列说法正确的是____
a.两溶液导电能力不同 b.两溶液c(OH-)不同 c.两溶液中水的电离程度不同
④将1.7g NH3溶于水制成1L溶液,此溶液的物质的量浓度为__________,经测定溶液中含NH为1.4×10-3ml/L,此温度下一水合氨的电离常数:Kb=____________,温度升高Kb将____________(填“变大”、“不变”或“变小”)。
1.根据下列实验现象或结果不能证明一元酸HR为弱酸的是 ( )
A.HR溶液中滴加紫色石蕊试液,溶液变红色
B.室温时,NaR溶液的pH大于7
C.HR溶液加入少量NaR固体,溶解后溶液的pH变大
D.室温时,0.01 ml·L-1的HR溶液pH=4
2.由于血液中存在如下平衡过程: CO2(g)CO2(aq)、CO2(aq)+H2O(l)H2CO3(aq)、H2CO3(aq)H+(aq)+HCOeq \\al(-,3)(aq),使血液的pH维持在7.35~7.45。如超出这个范围会造成酸中毒(pH过低)或碱中毒(pH过高),急性中毒时需静脉注射NH4Cl或NaHCO3进行治疗。下列叙述正确的是( )
A.血液中CO2浓度过高会导致酸中毒,使血液中eq \f(cHCO\\al(-,3),cH2CO3)的值增大
B.治疗碱中毒时,患者需降低呼吸频率,以增加血液中CO2浓度
C.急性酸中毒时,救治方式是静脉注射NH4Cl溶液
D.酸或碱中毒时,会导致血液中的酶发生水解
3.常温下,对于0.1 ml·L-1氨水和0.1 ml·L-1醋酸,下列说法正确的是 ( )
A.0.1 ml·L-1氨水的pH=13
B.0.1 ml·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1 ml·L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1 ml·L-1醋酸与0.1 ml·L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
4.下列说法正确的是 ( )
A.CH3COOH溶液加水稀释后,溶液中eq \f(cCH3COOH,cCH3COO-)的值减小
B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V(醋酸)
D.氨水中加入少量NH4Cl晶体,溶液中c(OH-)和c(NHeq \\al(+,4))均增大
5.常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( )
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
B.溶液Ⅱ中的HA的电离度[eq \f(cA-,c总HA)]为eq \f(1,101)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
6. 25 ℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
A.HA溶液的物质的量浓度为0.01 ml·L-1
B.b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C.a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D.25 ℃时,HA的电离平衡常数K约为1.43×10-2
7.某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
A.a点导电能力比b点强
B.b点的Kw值大于c点
C.与盐酸完全反应时,消耗盐酸体积Va>Vc
D.a、c两点c(H+)相等
8.室温下,将10.00 mL 5.0 ml·L-1 HA(弱酸)滴入100.00 mL 蒸馏水中,溶液中c(H+)和温度随着滴入的HA溶液体积变化曲线如图所示,下列有关说法正确的是( )
A.a~b段,HA电离过程为放热过程
B.c~d段,c(H+)增加,HA电离度增加
C.c点时,加入等体积等浓度的NaOH溶液,则
c(Na+)=c(A-)+c(HA)
D.d点时,c(H+)>c(HA)
9.硼酸(H3BO3)的电离方程式为H3BO3+H2OB(OH)eq \\al(-,4)+H+。已知常温下,Ka(H3BO3)=5.4×10-10、Ka(CH3COOH)=1.75×10-5。下列说法错误的是( )
A.H3BO3为一元酸
B.0.01 ml·L-1 H3BO3溶液的pH≈6
C.常温下,等浓度溶液的pH:CH3COONa>NaB(OH)4
D.NaOH溶液溅到皮肤时,可用大量清水冲洗,再涂上硼酸溶液
10.常温下有0.1 ml·L-1的以下几种溶液:①H2SO4溶液 ②NaHSO4溶液 ③CH3COOH溶液 ④HCl溶液 ⑤HCN溶液 ⑥氨水,其中如下几种溶液的电离度(即已经电离的占原来总的百分数)如下表(已知H2SO4的第一步电离是完全的)。
回答下列问题:
(1)常温下,pH相同的表格中的几种溶液,其物质的量浓度由大到小的顺序是____________(填序号,下同)。
(2)常温下,将足量的锌粉投入等体积pH=1的表格中的几种溶液中,产生H2的体积(同温同压下)由大到小的顺序是____________。
(3)在25 ℃时,若用已知浓度的NaOH溶液滴定未知浓度的CH3COOH 溶液应选用__________作指示剂,若终点时溶液pH=a,则由水电离的c(H+)为________。
(4)在25 ℃时,将b ml·L-1的KCN溶液与 0.01 ml·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则b____________0.01(填“>”“<”或“=”);用含b的代数式表示HCN的电离常数Ka=________。
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
酸
HX
HY
HZ
电离常数
9×10-7
9×10-6
10-2
①H2SO4
溶液中HSOeq \\al(-,4)
②NaHSO4
溶液中HSOeq \\al(-,4)
③CH3COOH
溶液
④HCl
溶液
10%
29%
1.33%
100%
第41讲 卤代烃 醇 酚-【高效备考】2024年高考化学一轮复习讲义+分层练习: 这是一份第41讲 卤代烃 醇 酚-【高效备考】2024年高考化学一轮复习讲义+分层练习,文件包含第41讲卤代烃醇酚讲义-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第41讲卤代烃醇酚分层练习-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第41讲卤代烃醇酚分层练习-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx、第41讲卤代烃醇酚讲义-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx等4份试卷配套教学资源,其中试卷共40页, 欢迎下载使用。
第40讲 烃-【高效备考】2024年高考化学一轮复习讲义+分层练习: 这是一份第40讲 烃-【高效备考】2024年高考化学一轮复习讲义+分层练习,文件包含第40讲烃讲义-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第40讲烃分层练习-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第40讲烃分层练习-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx、第40讲烃讲义-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx等4份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
第35讲 盐类的水解-【高效备考】2024年高考化学一轮复习讲义+分层练习: 这是一份第35讲 盐类的水解-【高效备考】2024年高考化学一轮复习讲义+分层练习,文件包含第35讲盐类的水解讲义-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第35讲盐类的水解分层练习-高效备考2024年高考化学一轮复习讲义+分层练习原卷版docx、第35讲盐类的水解讲义-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx、第35讲盐类的水解分层练习-高效备考2024年高考化学一轮复习讲义+分层练习解析版docx等4份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。












