



新高考化学复习讲义+练习+练习 第17讲 元素周期律 元素周期表(讲义)(原卷版+解析)
展开考情分析
网络构建
考点一 元素周期表
【夯基·必备基础知识梳理】
知识点1 元素周期表的结构
知识点2 周期表的应用
【提升·必考题型归纳】
考向1 考查元素周期表的结构
考向2 考查元素周期表的应用
考点二 元素周期律
【夯基·必备基础知识梳理】
知识点1 元素周期律
知识点2 电离能
知识点3 电负性
知识点4 元素周期表中的有关规律
知识点5 元素位—构—性的关系
【提升·必考题型归纳】
考向1 考查金属性和非金属性相关的递变规律
考向2 考查原子半径、离子半径相关的递变规律
考向3 考查第一电离能、电负性相关的递变规律
考点4 考查位、构、性关系的综合推断
真题感悟
考点一 元素周期表
知识点1 元素周期表的结构
1.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
2.编排原则
(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
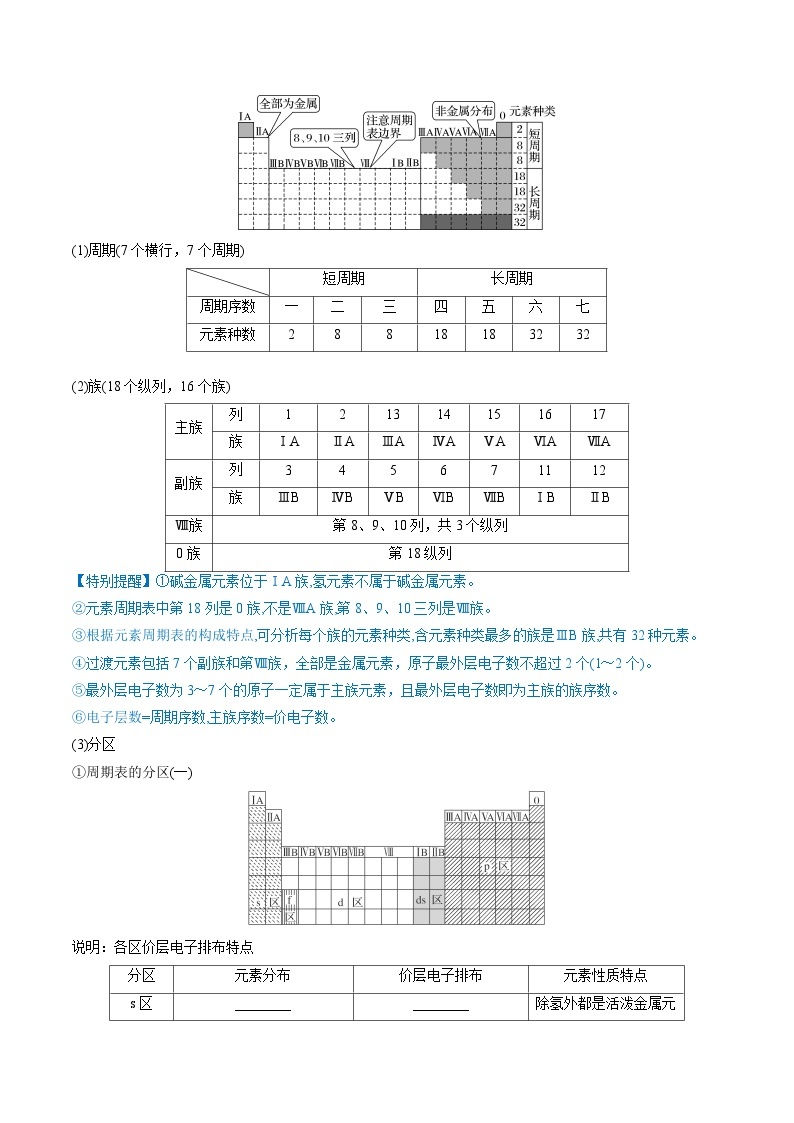
3.元素周期表的结构
1)结构
(1)周期(7个横行,7个周期)
(2)族(18个纵列,16个族)
【特别提醒】①碱金属元素位于ⅠA族,氢元素不属于碱金属元素。
②元素周期表中第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族。
③根据元素周期表的构成特点,可分析每个族的元素种类,含元素种类最多的族是ⅢB族,共有32种元素。
④过渡元素包括7个副族和第Ⅷ族,全部是金属元素,原子最外层电子数不超过2个(1~2个)。
⑤最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
⑥电子层数=周期序数,主族序数=价电子数。
(3)分区
①周期表的分区(一)
说明:各区价层电子排布特点
②周期表的分区(二)
说明:a.分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条线,即为金属元素区和非金属元素区分界线(氢元素除外)。
b.各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。
c.分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(4)元素周期表中的特殊位置
①过渡元素:元素周期表中从ⅢB族到ⅡB族10个纵列元素,都是金属元素。
②镧系:元素周期表第6周期第ⅢB族中,57号元素镧到71号元素镥共15种元素。
③锕系:元素周期表第7周期第ⅢB族中,89号元素锕到103号元素铹共15种元素。
④超铀元素:在锕系元素中,92号元素铀(U)以后的各种元素。
知识点2 周期表的应用
1.根据元素周期表中的位置寻找未知元素
2.预测元素的性质(由递变规律推测)
①比较不同周期、不同主族元素的性质
如:金属性:Mg>Al、Ca>Mg,则碱性:Mg(OH)2>Al(OH)3、Ca(OH)2>Mg(OH)2,则Ca(OH)2>Al(OH)3(填“>”“<”或“=”)。
②推测未知元素的某些性质
如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶;再如:已知卤族元素的性质递变规律,可推知元素砹(At)应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
3.启发人们在一定区域内寻找新物质
①半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。
②农药中常用元素在右上方,如:F、Cl、S、P、As等。
③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
考向1 考查元素周期表的结构
例1.(2023·天津河西·统考二模)已知:用中子轰击原子的核反应:。下列说法正确的是
A.X是金属元素B.Y位于ⅠA族
C.和互为同素异形体D.位于元素周期表的d区
【变式训练】(2023·重庆·重庆南开中学校考三模)白铜是一种延展性好、硬度高、色泽美观、耐腐蚀的合金材料,其主要成分为Cu、Ni、Zn,还含有少量S、P、As等元素。关于上述涉及到的元素,下列说法正确的是
A.基态Ni原子的简化电子排布式为:
B.基态As原子最高能级的轨道形状为哑铃形
C.第一电离能:S>P>Cu
D.S、P为p区元素,Cu、Zn为d区元素
考向2 考查元素周期律、周期表的应用
例2.下列关于元素周期表应用的说法正确的是
A.为元素性质的系统研究提供指导,为新元素的发现提供线索
B.在金属与非金属的交界处,寻找可做催化剂的合金材料
C.在IA、IIA族元素中,寻找制造农药的主要元素
D.在过渡元素中,可以找到半导体材料
【变式训练】下列关于元素周期表应用的说法正确的是( )
A.在过渡元素中,可以找到半导体材料
B.在元素周期表金属和非金属分界线附近可以寻找优良的催化剂
C.为元素性质的系统研究提供指导,为新元素的发现提供线索
D.在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
考点二 元素周期律
知识点1 元素周期律
1.内容:元素的性质随着________的递增而呈周期性变化。
2.实质:元素性质的周期性变化是________________周期性变化的必然结果。
3. 主族元素的周期性变化规律
4.元素金属性和非金属性强弱的判断方法
知识点2 电离能
(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的________。符号:________,单位:________。
(2)规律
①同周期:第一种元素的第一电离能________,最后一种元素的第一电离能________,从左到右总体呈现________的变化趋势。
【易错提醒】与元素金属性、非金属性变化规律并不完全一致,如同一周期,随原子序数的递增,元素金属性减弱,非金属性增强,第一电离能增大,但金属性Mg>Al,本来第一电离能应该是Al>Mg,但实际是Mg>Al,非金属性N
②同族元素:从上到下第一电离能________。
③同种原子:逐级电离能越来越________ (即I1
(1)含义:元素的原子________能力的标度。元素的电负性越大,表示其原子________的能力越强。
(2)标准:以最活泼的非金属元素氟的电负性为________作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
(3)变化规律
金属元素的电负性一般________1.8,非金属元素的电负性一般________1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。
在元素周期表中,同周期从左到右,元素的电负性逐渐________,同主族从上到下,元素的电负性逐渐________。
知识点4 元素周期表中的有关规律
1、原子序数规律
(1)同主族、邻周期元素的原子序数差
(2)同周期第ⅡA族和第ⅢA族元素原子序数差
2、元素化合价规律
(1)主族元素的最高正化合价=它所在的族序数=最外层电子数(即价电子数),但要注意F无正价,O一般不显正价。
(2)只有非金属元素才有负价,非金属元素的最高正价与它的负化合价的绝对值之和等于8。
(3)若某原子的最外层电子数为奇数(m),则正常化合价为奇数,从+1价到+m价,若出现偶数则为非正常化合价,其氧化物为不成盐氧化物,如NO、NO2。
(4)若某原子的最外层电子数为偶数(n),则元素的正常化合价为一系列偶数,例如S-2、S+4、S+6。
3、微粒半径大小比较的一般规律
(1)同周期(除0族外),随原子序数的递增,原子半径由大到小,如Na>Mg>Al;
(2)同主族,随原子序数的递增,原子半径、离子半径由小到大,如Li
(1)周期元素种类:设n为周期序数,每一周期排布元素的数目为:奇数周期为;偶数周期为。如第3周期为种,第4周期为种。
(2)族“m-2” 非金属元素种类判断规律:任何一主族中,非金属元素种类=(族序数-2)的绝对值
5、对角线规律
金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
6、相似规律:
(1)相邻相似:元素周期表中,上下左右相邻的元素性质差别不大,俗称相邻相似规律;
(2)同族相似;由于同族元素的最外层电子数相等,故同族元素性质相似。
(3)对角相似:①沿表中金属与非金属分界线方向(),对角相邻的两主族元素(都是金属或非金属)性质(金属性或非金属性)相近.②元素周期表中左上右下()相邻的两金属元素的离子半径相近.
7、递变规律:
(1)同周递变:同一周期的元素从左到右,随着核电荷数的递增,最外层电子数依次增多,原子半径逐渐减小,原子失电子能力逐渐减弱,得电子能力逐渐增强,所以,元素的金属性逐渐减弱,非金属性逐渐增强。
(2)同族递变:同一主族的元素从上到下,随着核电荷数的递增,电子层数依次增多,原子半径逐渐增大,原子失电子能力逐渐增强,得电子能力逐渐减弱,所以,元素的金属性逐渐增强,非金属性逐渐减弱。
(3)三角递变;所谓“三角递变”,即A、B处于同周期,A、C处于同主族的位置,可排列出三者原子结构、性质方面的递变规律。如:原子序数Z(C)>Z(B)>Z(A);原子半径r(C)>r(A)>r(B);A、B、C若为非金属元素,则非金属性B>A>C,单质的氧化性B>A>C等。
8、“定性”规律:若主族元素族数为m,周期数为n,则:
①<1时为金属,值越小,金属性越强;
②>1时是非金属,越大非金属性越强;
③=1时多为两性元素
知识点5 元素位—构—性的关系
1.元素“位—构—性”综合关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
2.三者的推断关系
(1)结构与位置的互推
①明确四个关系式
a.电子层数=周期序数。
b.质子数=原子序数。
c.最外层电子数=主族序数。
d.主族元素的最高正价=最外层电子数。
最低负价=-|8-最外层电子数|。
②熟悉掌握周期表中的一些特殊规律
a.各周期所能容纳元素种数。
b.稀有气体的原子序数及在周期表中的位置。
c.同族上下相邻元素原子序数的关系。
(2)性质与位置互推
熟悉元素周期表中同周期、同主族元素性质的递变规律,根据元素性质可以推知元素在周期表中的位置,根据元素在周期表中的位置可以推知元素性质。主要包括:
①元素的金属性、非金属性。
②气态氢化物的稳定性。
③最高价氧化物对应水化物的酸碱性。
④金属与H2O或酸反应的难易程度。
(3)结构和性质的互推
①最外层电子数是决定元素原子的氧化性和还原性的主要因素。
②原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
③同主族元素最外层电子数相同,性质相似。
3.应用——元素推断的一般思路
4.推断题要点总结
(1)结构与位置互推是解题的核心
①掌握四个关系式:a.电子层数=周期数;b.质子数=原子序数;c.最外层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外),负价=主族序数-8。
②熟练掌握周期表的结构及周期表中的一些特殊规律
a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类;c.稀有气体的原子序数及在周期表中的位置;d.同主族上下相邻元素原子序数的关系。
(2)熟记常见元素及其化合物的特性
①形成化合物种类最多的元素、单质是自然界中存在的硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素:C。
②空气中含量最多的元素、气态氢化物水溶液呈碱性的元素:N。
③地壳中含量最多的元素:O。
④常见的具有漂白性的物质:氯水、SO2、Na2O2、双氧水等。
⑤单质是最活泼的非金属元素、无正价的元素或无含氧酸的非金属元素、气态氢化物的水溶液可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子还原性最弱的元素:F。
⑥单质密度最小的元素:H;密度最小的金属元素:Li。
⑦常温下单质呈液态的非金属元素:Br;金属元素:Hg。
⑧最高价氧化物及其水化物既能与强酸又能与强碱反应的元素:Al。
⑨元素的气态氢化物和它的最高价氧化物对应的水化物能化合的元素:N;能发生氧化还原反应的元素:S。
⑩元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
考向1 考查金属性和非金属性相关的递变规律
例1.(2023·福建泉州·统考模拟预测)下列实验所涉及的操作或叙述正确的是
【变式训练】(2023秋·吉林长春·高三校考期末)下列各组元素,金属性或非金属性强弱比较正确的是
A.金属性:Na>KB.非金属性:O>SC.金属性:Mg<AlD.非金属性:F<Cl
考向2 考查原子半径、离子半径相关的递变规律
例4.下列粒子半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
【变式训练】下列粒子半径大小比较正确的是
A.Mg>Na>LiB.P>S>O
C.Na+<Mg2+<Al3+D.O2-<F-<Cl-
考向3 考查第一电离能、电负性相关的递变规律
6.(2023·湖南岳阳·统考二模)常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是
A.简单氢化物的稳定性:B.电负性:
C.第一电离能:D.Y原子核外电子有7种空间运动状态
【变式训练】(2023春·广东·高三校联考开学考试)绿柱石()是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
A.第一电离能:Z
B.原子半径:Z>W>Y>X
C.XY是碱性氧化物,是酸性氧化物
D.已知W、Y都可与氢气生成氢化物,电负性Y>W>H
考点4 考查位、构、性关系的综合推断
例4.(2023·福建莆田·统考模拟预测)X、Y、Z、W为原子半径依次减小的短周期主族元素。Z、W为同周期元素,X、Y的最外层电子数之和等于W的最外层电子数,Z的核外电子总数等于Y的最外层电子数,Y的单质常温下为黄色固体且可用于处理泄漏的水银。下列说法正确的是
A.简单离子半径:X>Y
B.最简单氢化物的沸点
C.Z的最高价氧化物对应的水化物为强酸
D.的空间结构为直线形
【变式训练】(2023·四川成都·校联考三模)X、Y、Z、W是原子序数依次递增的短周期主族元素,其最外层电子数之和为21。其中X、W同族,Y、Z相邻,W与X、Y、Z位于不同周期。下列说法正确的是
A.原子半径:W > X > Y > Z
B.简单氢化物的沸点:Y < Z
C.最高价含氧酸的酸性:Z > W
D.X、Y、W在自然界中均存在游离态
1.(2023·浙江·高考真题)硫酸铜应用广泛,下列说法不正确的是
A.元素位于周期表p区B.硫酸铜属于强电解质
C.硫酸铜溶液呈酸性D.硫酸铜能使蛋白质变性
2.(2023·全国·统考高考真题)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子与具有相同的电子结构。下列叙述正确的是
A.X的常见化合价有、B.原子半径大小为
C.YX的水合物具有两性D.W单质只有4种同素异形体
3.(2023·全国·统考高考真题)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是
A.原子半径:B.简单氢化物的沸点:
C.与可形成离子化合物D.的最高价含氧酸是弱酸
4.(2023·全国·统考高考真题)一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是
A.该晶体中存在N-H…O氢键B.基态原子的第一电离能:
C.基态原子未成对电子数:D.晶体中B、N和O原子轨道的杂化类型相同
第17讲 元素周期律 元素周期表
目录
考点要求
考题统计
考情分析
元素周期表
2023浙江1月卷2题,2分
2022湖南卷2题,3分
2021辽宁卷7题,3分
分析近三年全国卷高考试题,高考命题在本讲有以下规律:
1.从考查题型和内容上看,高考命题以选择题呈现,考查内容主要有以下几个方面:
(1)运用元素周期律知识判断元素的金属性、非金属性强弱或比较微粒的半径大小,比较最高价氧化物对应水化物的酸碱性的强弱比较第一电离能、电负性大小等。
(2)根据原子核外电子排布判断元素种类、化学键类型、化合物类型。
2.从命题思路上看,主要以选择题的形式,利用“位-构-性”的关系考查元素、物质的推断,化学键类型和化合物类型,结合元素周期律比较元素的金属性、非金属性强弱或比较微粒的半径大小,比较最高价氧化物对应水化物的酸碱性的强弱、气态氢化物的稳定性,比较第一电离能、电负性大小等。
3.根据高考命题的特点和规律,复习时要注意以下几个方面:
(1)以元素周期表的结构和元素周期律的递变规律为考
查对象的试题,或对一组元素加以比较或对一种元素进行多方面分析,具有一定的综合性。在解答该类试题时先确定该元素在元素周期表中的位置,然后根据该族元素性质的递变规律进行推测判断。
(2)稳打双基,归纳总结原子结构及核外电子排布特性,系统整合元素推断的突破口,规范化学术语的书写(如原子或离子结构示意图的书写、电子式的书写、元素在周期表中的位置)等。
元素周期律
2023全国乙卷10题,6分
2022海南卷11题,2分
2021全国甲卷11题,6分
短周期
长周期
周期序数
一
二
三
四
五
六
七
元素种数
2
8
8
18
18
32
32
主族
列
1
2
13
14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列
3
4
5
6
7
11
12
族
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第8、9、10列,共3个纵列
0族
第18纵列
分区
元素分布
价层电子排布
元素性质特点
s区
________
________
除氢外都是活泼金属元素
p区
ⅢA族~ⅦA族、0族
________ (He除外)
最外层电子参与反应(0族元素一般不考虑)
d区
ⅢB族~Ⅷ族(镧系、锕系除外)
(n-1)d1~9 ns1~2
(Pd除外)
d轨道也不同程度地参与化学键的形成
ds区
________
(n-1)d10 ns1~2
金属元素
f区
镧系、锕系
(n-2)f0~14
(n-1)d0~2ns2
镧系元素化学性质相近,锕系元素化学性质相近
项目
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
逐渐________
逐渐________
电子层数
________
逐渐________
原子半径
逐渐________
逐渐________
离子半径
阳离子逐渐________
阴离子逐渐________
r(阴离子)>r(阳离子)
逐渐________
性质
化合价
最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)
相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性
金属性逐渐________
非金属性逐渐________
金属性逐渐________
非金属性逐渐________
第一电离能
有逐渐________的趋势
逐渐________
电负性
逐渐________
逐渐________
离子的氧化性、还原性
阳离子氧化性逐渐________
阴离子还原性逐渐________
阳离子氧化性逐渐________
阴离子还原性逐渐________
气态氢化物的稳定性
逐渐________
逐渐________
最高价氧化物对应的水化物的酸碱性
碱性逐渐________
酸性逐渐________
碱性逐渐________
酸性逐渐________
三表
元素周期表:金属性“右弱左________,上弱下________,右上弱左下________”;非金属性“左________右强,下________上强,左下________右上强”
金属活动性顺序表:按K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au的顺序,金属性逐渐________ (其中Pb>Sn)
非金属活动性顺序表:按F、O、Cl、Br、I、S的顺序,非金属性逐渐________
三反应
置换反应:强的置换________的,适合金属也适合非金属
与水或非氧化性酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越________
与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越________
氧化性
金属离子的氧化性越弱,对应单质的金属性越________
还原性
非金属氢化物或非金属阴离子的还原性越弱,对应单质的非金属性越________
元素周期表中左侧元素(ⅠA、ⅡA族)
同主族相邻两元素中,Z(下)=Z(上)+上一周期元素所在周期的元素种类数目
元素周期表中右侧元素(ⅢA~ⅦA族)
同主族相邻两元素中,Z(下)=Z(上)+下一周期元素所在周期的元素种类数目
周期序数
1
2
3
4
5
6
7
原子序数差
无
1
1
11
11
25
25
实验
操作或叙述
A
探究C和Si的非金属性强弱
用湿润的pH试纸分别测定Na2CO3溶液和Na2SiO3溶液的pH
B
探究S和P的非金属性强弱
将质量和颗粒大小相同的铁粒,分别投入质量分数均为98%的硫酸和磷酸中
C
探究Na和K的金属性强弱
将切割剩余的金属钠、钾放回试剂瓶
D
探究Mg和Al的金属性强弱
利用Al2(SO4)3溶液与过量NaOH溶液反应制备Al(OH)3
考情分析
网络构建
考点一 元素周期表
【夯基·必备基础知识梳理】
知识点1 元素周期表的结构
知识点2 周期表的应用
【提升·必考题型归纳】
考向1 考查元素周期表的结构
考向2 考查元素周期表的应用
考点二 元素周期律
【夯基·必备基础知识梳理】
知识点1 元素周期律
知识点2 电离能
知识点3 电负性
知识点4 元素周期表中的有关规律
知识点5 元素位—构—性的关系
【提升·必考题型归纳】
考向1 考查金属性和非金属性相关的递变规律
考向2 考查原子半径、离子半径相关的递变规律
考向3 考查第一电离能、电负性相关的递变规律
考点4 考查位、构、性关系的综合推断
真题感悟
考点一 元素周期表
知识点1 元素周期表的结构
1.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
2.编排原则
(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
3.元素周期表的结构
1)结构
(1)周期(7个横行,7个周期)
(2)族(18个纵列,16个族)
【特别提醒】①碱金属元素位于ⅠA族,氢元素不属于碱金属元素。
②元素周期表中第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族。
③根据元素周期表的构成特点,可分析每个族的元素种类,含元素种类最多的族是ⅢB族,共有32种元素。
④过渡元素包括7个副族和第Ⅷ族,全部是金属元素,原子最外层电子数不超过2个(1~2个)。
⑤最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
⑥电子层数=周期序数,主族序数=价电子数。
(3)分区
①周期表的分区(一)
说明:各区价层电子排布特点
②周期表的分区(二)
说明:a.分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条线,即为金属元素区和非金属元素区分界线(氢元素除外)。
b.各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。
c.分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
(4)元素周期表中的特殊位置
①过渡元素:元素周期表中从ⅢB族到ⅡB族10个纵列元素,都是金属元素。
②镧系:元素周期表第6周期第ⅢB族中,57号元素镧到71号元素镥共15种元素。
③锕系:元素周期表第7周期第ⅢB族中,89号元素锕到103号元素铹共15种元素。
④超铀元素:在锕系元素中,92号元素铀(U)以后的各种元素。
知识点2 周期表的应用
1.根据元素周期表中的位置寻找未知元素
2.预测元素的性质(由递变规律推测)
①比较不同周期、不同主族元素的性质
如:金属性:Mg>Al、Ca>Mg,则碱性:Mg(OH)2>Al(OH)3、Ca(OH)2>Mg(OH)2,则Ca(OH)2>Al(OH)3(填“>”“<”或“=”)。
②推测未知元素的某些性质
如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶;再如:已知卤族元素的性质递变规律,可推知元素砹(At)应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
3.启发人们在一定区域内寻找新物质
①半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。
②农药中常用元素在右上方,如:F、Cl、S、P、As等。
③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
考向1 考查元素周期表的结构
例1.(2023·天津河西·统考二模)已知:用中子轰击原子的核反应:。下列说法正确的是
A.X是金属元素B.Y位于ⅠA族
C.和互为同素异形体D.位于元素周期表的d区
【分析】根据粒子守恒可得:N+1=7+4,N=10;Z+0=3+2,Z=5。可知X为B,Y为Li。
【解析】A.X为B,为非金属元素,故A错误;B.Y为Li,位于第二周期ⅠA族,故B正确;C.和为同种元素的不同原子,互为同位素,故C错误;D.为零族元素,位于p区,故D错误;故选:B。
【答案】B
【变式训练】(2023·重庆·重庆南开中学校考三模)白铜是一种延展性好、硬度高、色泽美观、耐腐蚀的合金材料,其主要成分为Cu、Ni、Zn,还含有少量S、P、As等元素。关于上述涉及到的元素,下列说法正确的是
A.基态Ni原子的简化电子排布式为:
B.基态As原子最高能级的轨道形状为哑铃形
C.第一电离能:S>P>Cu
D.S、P为p区元素,Cu、Zn为d区元素
【解析】A.基态Ni原子的简化电子排布式为:[Ar],故A错误;B.基态As原子最高能级为4p,其轨道为哑铃形,故B正确;C.第一电离能:P>S>Cu,故C错误;D.S、P为p区元素,Cu、Zn为ds区元素,故D错误;故答案选:B。
【答案】B
【方法技巧】元素周期表结构巧记口诀
横行叫周期,现有一至七,四长三个短,全部已填满。
纵列称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明:①指ⅠA族、ⅡA族、ⅢB族、ⅣB族、ⅤB族、ⅥB族、ⅦB族、Ⅷ族;
②指ⅠB族、ⅡB族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族、0族。
考向2 考查元素周期律、周期表的应用
例2.下列关于元素周期表应用的说法正确的是
A.为元素性质的系统研究提供指导,为新元素的发现提供线索
B.在金属与非金属的交界处,寻找可做催化剂的合金材料
C.在IA、IIA族元素中,寻找制造农药的主要元素
D.在过渡元素中,可以找到半导体材料
【解析】A.元素周期表是元素周期律的具体表现形式,它反映元素原子的内部结构和它们之间相互联系的规律。为元素性质的系统研究提供指导,为新元素的发现及预测它们的原子结构和性质提供线索,故A正确;B.在周期表中金属和非金属的分界处可以找到半导体材料,故B错误;C.通常制造农药的主要元素有F、Cl、S、P等元素,并不在IA、IIA族元素中,故C错误;D.在过渡元素中寻找耐高温、耐腐蚀的合金材料,并不是半导体材料,故D错误;答案选A。
【答案】A
【变式训练】下列关于元素周期表应用的说法正确的是( )
A.在过渡元素中,可以找到半导体材料
B.在元素周期表金属和非金属分界线附近可以寻找优良的催化剂
C.为元素性质的系统研究提供指导,为新元素的发现提供线索
D.在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
【解析】A.优良的催化剂含过渡金属元素,则在过渡元素中寻找优良的催化剂,而半导体材料应在金属与非金属分界处寻找,故A错误;B.在元素周期表的金属和非金属分界线附近寻找半导体材料,催化剂材料在过渡元素中寻找,故B错误;C.同周期、同族元素性质具有一定相似性、递变性,位置靠近的元素性质相似,为新元素的发现和预测它们的原子结构和性质提供线索,故C正确;D.在金属与非金属的交界处,是找到半导体材料,而不是耐高温、耐腐蚀的合金材料,故D错误;故答案为C。
【答案】C
【名师归纳】元素周期表在生产方面的应用表现在以下几个方面:
①农药多数是含Cl、P、S、N、As等元素的化合物。
②半导体材料都是周期表里金属与非金属交接界处的元素,如Ge、Si、Ga、Se等。
③催化剂的选择:人们在长期的生产实践中,已发现过渡元素对许多化学反应有良好的催化性能。
④耐高温、耐腐蚀的特种合金材料的制取:在周期表里从ⅢB到ⅣB的过渡元素,如钛、钽、钼、钨、铬,具有耐高温、耐腐蚀等特点。它们是制作特种合金的优良材料,是制造火箭、导弹、宇宙飞船、飞机、坦克等的不可缺少的金属。
⑤矿物的寻找:地球上化学元素的分布跟它们在元素周期表里的位置有密切的联系。科学实验发现如下规律:相对原子质量较小的元素在地壳中含量较多,相对原子质量较大的元素在地壳中含量较少;偶数原子序数的元素较多,奇数原子序数的元素较少。处于地球表面的元素多数呈现高价,处于岩石深处的元素多数呈现低价;碱金属一般是强烈的亲石元素,主要富集于岩石圈的最上部;熔点、离子半径、电负性大小相近的元素往往共生在一起,同处于一种矿石中。
考点二 元素周期律
知识点1 元素周期律
1.内容:元素的性质随着原子序数的递增而呈周期性变化。
2.实质:元素性质的周期性变化是核外电子排布周期性变化的必然结果。
3. 主族元素的周期性变化规律
4.元素金属性和非金属性强弱的判断方法
知识点2 电离能
(1)第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。符号:I1,单位:kJ·ml-1。
(2)规律
①同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,从左到右总体呈现逐渐增大的变化趋势。
【易错提醒】与元素金属性、非金属性变化规律并不完全一致,如同一周期,随原子序数的递增,元素金属性减弱,非金属性增强,第一电离能增大,但金属性Mg>Al,本来第一电离能应该是Al>Mg,但实际是Mg>Al,非金属性N
②同族元素:从上到下第一电离能变小。
③同种原子:逐级电离能越来越大(即I1
(1)含义:元素的原子吸引键合电子能力的标度。元素的电负性越大,表示其原子吸引键合电子的能力越强。
(2)标准:以最活泼的非金属元素氟的电负性为4.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
(3)变化规律
金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。
在元素周期表中,同周期从左到右,元素的电负性逐渐变大,同主族从上到下,元素的电负性逐渐变小。
知识点4 元素周期表中的有关规律
1、原子序数规律
(1)同主族、邻周期元素的原子序数差
(2)同周期第ⅡA族和第ⅢA族元素原子序数差
2、元素化合价规律
(1)主族元素的最高正化合价=它所在的族序数=最外层电子数(即价电子数),但要注意F无正价,O一般不显正价。
(2)只有非金属元素才有负价,非金属元素的最高正价与它的负化合价的绝对值之和等于8。
(3)若某原子的最外层电子数为奇数(m),则正常化合价为奇数,从+1价到+m价,若出现偶数则为非正常化合价,其氧化物为不成盐氧化物,如NO、NO2。
(4)若某原子的最外层电子数为偶数(n),则元素的正常化合价为一系列偶数,例如S-2、S+4、S+6。
3、微粒半径大小比较的一般规律
(1)同周期(除0族外),随原子序数的递增,原子半径由大到小,如Na>Mg>Al;
(2)同主族,随原子序数的递增,原子半径、离子半径由小到大,如Li
(1)周期元素种类:设n为周期序数,每一周期排布元素的数目为:奇数周期为;偶数周期为。如第3周期为种,第4周期为种。
(2)族“m-2” 非金属元素种类判断规律:任何一主族中,非金属元素种类=(族序数-2)的绝对值
5、对角线规律
金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第2、3周期(如Li和Mg、Be和Al、B和Si)。
6、相似规律:
(1)相邻相似:元素周期表中,上下左右相邻的元素性质差别不大,俗称相邻相似规律;
(2)同族相似;由于同族元素的最外层电子数相等,故同族元素性质相似。
(3)对角相似:①沿表中金属与非金属分界线方向(),对角相邻的两主族元素(都是金属或非金属)性质(金属性或非金属性)相近.②元素周期表中左上右下()相邻的两金属元素的离子半径相近.
7、递变规律:
(1)同周递变:同一周期的元素从左到右,随着核电荷数的递增,最外层电子数依次增多,原子半径逐渐减小,原子失电子能力逐渐减弱,得电子能力逐渐增强,所以,元素的金属性逐渐减弱,非金属性逐渐增强。
(2)同族递变:同一主族的元素从上到下,随着核电荷数的递增,电子层数依次增多,原子半径逐渐增大,原子失电子能力逐渐增强,得电子能力逐渐减弱,所以,元素的金属性逐渐增强,非金属性逐渐减弱。
(3)三角递变;所谓“三角递变”,即A、B处于同周期,A、C处于同主族的位置,可排列出三者原子结构、性质方面的递变规律。如:原子序数Z(C)>Z(B)>Z(A);原子半径r(C)>r(A)>r(B);A、B、C若为非金属元素,则非金属性B>A>C,单质的氧化性B>A>C等。
8、“定性”规律:若主族元素族数为m,周期数为n,则:
①<1时为金属,值越小,金属性越强;
②>1时是非金属,越大非金属性越强;
③=1时多为两性元素
知识点5 元素位—构—性的关系
1.元素“位—构—性”综合关系
元素的原子结构决定了元素在周期表中的位置和元素的主要性质,元素在周期表中的位置反映了元素的原子结构和元素的主要性质,故三者之间可相互推断。
2.三者的推断关系
(1)结构与位置的互推
①明确四个关系式
a.电子层数=周期序数。
b.质子数=原子序数。
c.最外层电子数=主族序数。
d.主族元素的最高正价=最外层电子数。
最低负价=-|8-最外层电子数|。
②熟悉掌握周期表中的一些特殊规律
a.各周期所能容纳元素种数。
b.稀有气体的原子序数及在周期表中的位置。
c.同族上下相邻元素原子序数的关系。
(2)性质与位置互推
熟悉元素周期表中同周期、同主族元素性质的递变规律,根据元素性质可以推知元素在周期表中的位置,根据元素在周期表中的位置可以推知元素性质。主要包括:
①元素的金属性、非金属性。
②气态氢化物的稳定性。
③最高价氧化物对应水化物的酸碱性。
④金属与H2O或酸反应的难易程度。
(3)结构和性质的互推
①最外层电子数是决定元素原子的氧化性和还原性的主要因素。
②原子半径决定了元素单质的性质;离子半径决定了元素组成化合物的性质。
③同主族元素最外层电子数相同,性质相似。
3.应用——元素推断的一般思路
4.推断题要点总结
(1)结构与位置互推是解题的核心
①掌握四个关系式:a.电子层数=周期数;b.质子数=原子序数;c.最外层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外),负价=主族序数-8。
②熟练掌握周期表的结构及周期表中的一些特殊规律
a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类;c.稀有气体的原子序数及在周期表中的位置;d.同主族上下相邻元素原子序数的关系。
(2)熟记常见元素及其化合物的特性
①形成化合物种类最多的元素、单质是自然界中存在的硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素:C。
②空气中含量最多的元素、气态氢化物水溶液呈碱性的元素:N。
③地壳中含量最多的元素:O。
④常见的具有漂白性的物质:氯水、SO2、Na2O2、双氧水等。
⑤单质是最活泼的非金属元素、无正价的元素或无含氧酸的非金属元素、气态氢化物的水溶液可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子还原性最弱的元素:F。
⑥单质密度最小的元素:H;密度最小的金属元素:Li。
⑦常温下单质呈液态的非金属元素:Br;金属元素:Hg。
⑧最高价氧化物及其水化物既能与强酸又能与强碱反应的元素:Al。
⑨元素的气态氢化物和它的最高价氧化物对应的水化物能化合的元素:N;能发生氧化还原反应的元素:S。
⑩元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
考向1 考查金属性和非金属性相关的递变规律
例1.(2023·福建泉州·统考模拟预测)下列实验所涉及的操作或叙述正确的是
【解析】A.不能用润湿的pH试纸测量溶液的pH,且应该测量等浓度的溶液的pH,故A错误;B.常温下,铁遇到浓硫酸会钝化,故B错误;C.金属Na和K容易与空气中的氧气以及水蒸气发生反应,为防止其氧化变质,用小刀切割金属钠后,剩余的钠、钾应及时放回煤油中保存,C正确;D.Al2(SO4)3溶液与过量NaOH溶液反应生成偏铝酸钠,不会生成氢氧化铝沉淀,故D错误;故选C。
【答案】C
【变式训练】(2023秋·吉林长春·高三校考期末)下列各组元素,金属性或非金属性强弱比较正确的是
A.金属性:Na>KB.非金属性:O>SC.金属性:Mg<AlD.非金属性:F<Cl
【解析】A、同主族元素从上而下金属性逐渐增强,故金属性:Na<K,选项A错误;B、同主族元素从上而下非金属性逐渐减弱,故非金属性:O>S,选项B正确;C、同周期元素从左而右金属性逐渐减弱,故金属性:Mg>Al,选项C错误;D、同主族元素从上而下非金属性逐渐减弱,故非金属性:F>Cl,选项D错误。答案选B。
【答案】B
【易错提醒】规避金属性和非金属性判断中的易错点:(1)关注关键词“最高价”,根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物的水化物。(2)关注关键词“难易”,判断元素非金属性或金属性的强弱,依据是元素原子在化学反应中得失电子的难易而不是得失电子的多少。
考向2 考查原子半径、离子半径相关的递变规律
例4.下列粒子半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
【解析】电子层数相同,原子序数越大,半径越小;电子层数不相同,电子层数越多,半径越大;当电子层数和核电荷数相同时,核外电子数越多,半径越大。A.微粒半径大小关系为:Al3+<Mg2+<Na+<O2-,A错误;B.微粒半径大小关系为:S2->Cl->Na+>Al3+,B正确;C.微粒半径大小关系为:S<Al<Mg<Na,C错误;D.微粒半径大小关系为:Cs>Rb>K>Na,D错误;答案为B。
【答案】B
【变式训练】下列粒子半径大小比较正确的是
A.Mg>Na>LiB.P>S>O
C.Na+<Mg2+<Al3+D.O2-<F-<Cl-
【解析】A.同周期主族元素自左至右原子半径依次减小,所以半径Mg<Na,A错误;B.同周期主族元素自左至右原子半径依次减小,所以半径P>S,同主族自上而下原子半径依次增大,所以半径S>O,即原子半径P>S>O,B正确;C.电子层数相同时,核电荷数越小,离子半径越大,所以半径Na+>Mg2+>Al3+,C错误;D.电子层数相同时,核电荷数越小,离子半径越大,所以半径O2->F-,D错误;综上所述答案为B。
【答案】B
【思维建模】微粒半径大小的比较规律:①层数相同,核大半径小。即电子层数相同时,结构相似的微粒中核电荷数大的微粒半径小;②层异,层大半径大。即当微粒的电子层数不同时,结构相似的微粒中,电子层数大的微粒半径大;③核同,价高半径小。即对同一种元素形成的不同的简单微粒中,化合价高的微粒的半径小;④电子层结构相同,核电荷数大,则半径小。
考向3 考查第一电离能、电负性相关的递变规律
6.(2023·湖南岳阳·统考二模)常用作沉淀滴定分析试剂。X是原子半径最小的元素,Y的基态原子中单电子与成对电子个数比为3∶4,Z元素的电负性仅次于氟元素,W原子电子总数与Z原子的最外层电子数相同。下列说法正确的是
A.简单氢化物的稳定性:B.电负性:
C.第一电离能:D.Y原子核外电子有7种空间运动状态
【分析】由题干信息可知,化合物(YX4)2W2Z4常用作沉淀滴定分析试剂,X是原子半径最小的元素,则X为H,Y的基态原子成单电子与成对电子个数比为3:4,即电子排布式为:1s22s22p3,则Y为N,Z元素的电负性仅次于氟元素,则Z为O,W原子电子总数与Z原子的最外层电子数相同,则W为C,化合物(YX4)2W2Z4为(NH4)2C2O4。
【解析】A.由分析可知,Y、Z分别为:N、O,由于O的非金属性强于N的,简单氢化物的稳定性:H2O>NH3即Y
【答案】B
【变式训练】(2023春·广东·高三校联考开学考试)绿柱石()是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,和的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
A.第一电离能:Z
B.原子半径:Z>W>Y>X
C.XY是碱性氧化物,是酸性氧化物
D.已知W、Y都可与氢气生成氢化物,电负性Y>W>H
【分析】X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,根据“和的电荷与半径之比相近,导致两元素性质相似”。可知,X为Be,Z为Al,W为Si,因X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,设Y的价电子数为y,则2+3+4+y=15,则y=6,根据位置关系可知。
【解析】由上述分析可知,X为Be,Y为O,Z为Al,W为Si,则:
A.同一周期,第一电离能从左到右呈现增大趋势,所以第一电离能:Al<Si,两者失去一个电子后,Al+处于稳定结构,较难再失电子,所以第二电离能:Al>Si,A正确;B.同一周期原子半径从左到右依次减弱,同一主族原子半径从上到下依次增大,则上述元素原子半径:Z(Al)>W(Si)>X(Be)>Y(O),B错误;C.Be与Al两者性质相似,所以BeO属于两性氧化物,SiO2与碱发生反应生成硅酸盐和水,所以属于酸性氧化物,C错误;D.Si与O分别与H元素形成的氢化物中,Si为+4价,O为-2价,则电负性:W(O)>Y(Si)>H,D错误;故选A。
【答案】A
【易错提醒】与元素金属性、非金属性变化规律并不完全一致,如同一周期,随原子序数的递增,元素金属性减弱,非金属性增强,第一电离能增大,但金属性Mg>Al,本来第一电离能应该是Al>Mg,但实际是Mg>Al,非金属性N
考点4 考查位、构、性关系的综合推断
例4.(2023·福建莆田·统考模拟预测)X、Y、Z、W为原子半径依次减小的短周期主族元素。Z、W为同周期元素,X、Y的最外层电子数之和等于W的最外层电子数,Z的核外电子总数等于Y的最外层电子数,Y的单质常温下为黄色固体且可用于处理泄漏的水银。下列说法正确的是
A.简单离子半径:X>Y
B.最简单氢化物的沸点
C.Z的最高价氧化物对应的水化物为强酸
D.的空间结构为直线形
【分析】X、Y、Z、W为原子半径依次减小的短周期主族元素。Y的单质常温为下黄色固体且可用于处理泄漏的汞,Y是S元素; Z的核外电子总数等于Y的最外层电子数,Z是C元素;X、Y的最外层电子数之和等于W的最外层电子数,X为Na、W为F。
【解析】A.同主族时电子层数越多半径越大,电子层结构相同时核电荷数大的离子半径小,简单离子半径:S2->O2->Na+,则简单离子半径:Y>X,故A错误;
B.HF分子间存在氢键,H2S分子间存在范德华力,则最简单氢化物的沸点,故B错误;C.Z即碳元素最高价氧化物对应的水化物为H2CO3,H2CO3是弱酸,故C错误;D. 即CS2的中心碳原子价层电子对数目为2、无孤电子对,故为直线形分子,故D正确;选D。
【答案】D
【变式训练】(2023·四川成都·校联考三模)X、Y、Z、W是原子序数依次递增的短周期主族元素,其最外层电子数之和为21。其中X、W同族,Y、Z相邻,W与X、Y、Z位于不同周期。下列说法正确的是
A.原子半径:W > X > Y > Z
B.简单氢化物的沸点:Y < Z
C.最高价含氧酸的酸性:Z > W
D.X、Y、W在自然界中均存在游离态
【分析】X、Y、Z、W是原子序数依次递增的短周期主族元素,其最外层电子数之和为21,而X、W同族,可知X、W不能处于IA族,因为若处于IA族,Y、Z的最外层电子数平均为=9.5>7,而Y、Z相邻,且W与X、Y、Z位于不同周期,结合原子序数可知四种元素在周期表中位置关系如图所示:,设X、W最外层电子数为a,Y的最外层电子数为b,可知Z原子最外层电子数为b+1,则有2a+b+b+1=21,整理可得a+b=10,只能是a=4,b=6,可知X为C元素、W为Si元素、Y为O元素、Z为F元素。
【解析】A.同周期主族元素自左而右原子半径减小,同主族自上而下原子半径增大,则原子半径:Si>C>O>F,故A正确;B.Y、Z的简单氢化物依次为H2O、HF,常温下水是液体,而HF是气体,则沸点:H2O>HF,故B错误;C.Z是氟元素,不存在最高价含氧酸,故C错误;D.硅是亲氧元素,自然界中没有游离态的硅,以化合态形式存在,故D错误;故选A。
【答案】A
【思维建模】1.直接相邻的“┳”型、“┻”型、“╋”型原子序数关系
(1)
(2)
(3)
(4)
2.由稀有气体元素的原子序数确定元素在周期表中位置
①原子序数-最邻近的稀有气体元素的原子序数=ΔZ。
②若ΔZ<0,则与稀有气体元素同周期,族序数为8-|ΔZ|;
③若ΔZ>0,则在稀有气体元素下一周期,族序数为ΔZ。
1.(2023·浙江·高考真题)硫酸铜应用广泛,下列说法不正确的是
A.元素位于周期表p区B.硫酸铜属于强电解质
C.硫酸铜溶液呈酸性D.硫酸铜能使蛋白质变性
【答案】A
【解析】A.Cu为29号元素,位于IB族,属于ds区元素,故A错误;B.硫酸铜属于盐类,在水溶液中能完全电离,属于强电解质,故B正确;C.硫酸铜为强酸弱碱盐,铜离子水解使溶液呈酸性,故C正确;D.铜离子为重金属离子,能使蛋白质变性,故D正确;故选:A。
2.(2023·全国·统考高考真题)一种矿物由短周期元素W、X、Y组成,溶于稀盐酸有无色无味气体生成。W、X、Y原子序数依次增大。简单离子与具有相同的电子结构。下列叙述正确的是
A.X的常见化合价有、B.原子半径大小为
C.YX的水合物具有两性D.W单质只有4种同素异形体
【答案】A
【分析】W、X、Y为短周期元素,原子序数依次增大,简单离子X2-与Y2+具有相同的电子结构,则它们均为10电子微粒, X为O,Y为Mg,W、X、Y组成的物质能溶于稀盐酸有无色无味的气体产生,则W为C,产生的气体为二氧化碳。
【解析】A.X为O,氧的常见价态有-1价和-2价,如H2O2和H2O,A正确;B.W为C,X为O,Y为Mg,同主族时电子层数越多,原子半径越大,电子层数相同时,原子序数越小,原子半径越大,所以原子半径大小为:Y>W>X,B错误;C.Y为Mg,X为O,他们可形成MgO,水合物为Mg(OH)2,Mg(OH)2只能与酸反应生成盐和水,不能与碱反应,所以YX的水合物没有两性,C错误;D.W为C,碳的同素异形体有:金刚石、石墨、石墨烯、富勒烯、碳纳米管等,种类不止四种,D错误;故选A。
3.(2023·全国·统考高考真题)W、X、Y、Z为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,WX2是形成酸雨的物质之一。下列说法正确的是
A.原子半径:B.简单氢化物的沸点:
C.与可形成离子化合物D.的最高价含氧酸是弱酸
【答案】C
【分析】W、X、Y、Z为短周期主族元素,原子序数依次增大,WX2是形成酸雨的物质之一,根据原子序数的规律,则W为N,X为O,Y的最外层电子数与其K层电子数相等,又因为Y的原子序数大于氧的,则Y电子层为3层,最外层电子数为2,所以Y为Mg,四种元素最外层电子数之和为19,则Z的最外层电子数为6,Z为S。
【解析】A.X为O,W为N,同周期从左往右,原子半径依次减小,所以半径大小为W>X,A错误;B.X为O,Z为S,X的简单氢化物为H2O,含有分子间氢键,Z的简单氢化物为H2S,没有氢键,所以简单氢化物的沸点为X>Z,B错误;C.Y为Mg,X为O,他们可形成MgO,为离子化合物,C正确;D.Z为S,硫的最高价含氧酸为硫酸,是强酸,D错误;故选C。
4.(2023·全国·统考高考真题)一种可吸附甲醇的材料,其化学式为,部分晶体结构如下图所示,其中为平面结构。
下列说法正确的是
A.该晶体中存在N-H…O氢键B.基态原子的第一电离能:
C.基态原子未成对电子数:D.晶体中B、N和O原子轨道的杂化类型相同
【答案】A
【解析】A.由晶体结构图可知,中的的与中的形成氢键,因此,该晶体中存在氢键,A说法正确;B.同一周期元素原子的第一电离能呈递增趋势,但是第ⅡA、ⅤA元素的原子结构比较稳定,其第一电离能高于同周期的相邻元素的原子,因此,基态原子的第一电离能从小到大的顺序为C< O < N,B说法不正确;C.B、C、O、N的未成对电子数分别为1、2、2、3,因此,基态原子未成对电子数B
考题统计
考情分析
元素周期表
2023浙江1月卷2题,2分
2022湖南卷2题,3分
2021辽宁卷7题,3分
分析近三年全国卷高考试题,高考命题在本讲有以下规律:
1.从考查题型和内容上看,高考命题以选择题呈现,考查内容主要有以下几个方面:
(1)运用元素周期律知识判断元素的金属性、非金属性强弱或比较微粒的半径大小,比较最高价氧化物对应水化物的酸碱性的强弱比较第一电离能、电负性大小等。
(2)根据原子核外电子排布判断元素种类、化学键类型、化合物类型。
2.从命题思路上看,主要以选择题的形式,利用“位-构-性”的关系考查元素、物质的推断,化学键类型和化合物类型,结合元素周期律比较元素的金属性、非金属性强弱或比较微粒的半径大小,比较最高价氧化物对应水化物的酸碱性的强弱、气态氢化物的稳定性,比较第一电离能、电负性大小等。
3.根据高考命题的特点和规律,复习时要注意以下几个方面:
(1)以元素周期表的结构和元素周期律的递变规律为考
查对象的试题,或对一组元素加以比较或对一种元素进行多方面分析,具有一定的综合性。在解答该类试题时先确定该元素在元素周期表中的位置,然后根据该族元素性质的递变规律进行推测判断。
(2)稳打双基,归纳总结原子结构及核外电子排布特性,系统整合元素推断的突破口,规范化学术语的书写(如原子或离子结构示意图的书写、电子式的书写、元素在周期表中的位置)等。
元素周期律
2023全国乙卷10题,6分
2022海南卷11题,2分
2021全国甲卷11题,6分
短周期
长周期
周期序数
一
二
三
四
五
六
七
元素种数
2
8
8
18
18
32
32
主族
列
1
2
13
14
15
16
17
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
副族
列
3
4
5
6
7
11
12
族
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
ⅠB
ⅡB
Ⅷ族
第8、9、10列,共3个纵列
0族
第18纵列
分区
元素分布
价层电子排布
元素性质特点
s区
ⅠA族、ⅡA族
ns1~2
除氢外都是活泼金属元素
p区
ⅢA族~ⅦA族、0族
ns2np1~6(He除外)
最外层电子参与反应(0族元素一般不考虑)
d区
ⅢB族~Ⅷ族(镧系、锕系除外)
(n-1)d1~9 ns1~2
(Pd除外)
d轨道也不同程度地参与化学键的形成
ds区
ⅠB族、ⅡB族
(n-1)d10 ns1~2
金属元素
f区
镧系、锕系
(n-2)f0~14
(n-1)d0~2ns2
镧系元素化学性质相近,锕系元素化学性质相近
项目
同周期(左→右)
同主族(上→下)
原子结构
核电荷数
逐渐增大
逐渐增大
电子层数
相同
逐渐增多
原子半径
逐渐减小
逐渐增大
离子半径
阳离子逐渐减小
阴离子逐渐减小
r(阴离子)>r(阳离子)
逐渐增大
性质
化合价
最高正化合价由+1→+7(O、F除外)负化合价=-(8-主族序数)
相同,最高正化合价=主族序数(O、F除外)
元素的金属性和非金属性
金属性逐渐减弱
非金属性逐渐增强
金属性逐渐增强
非金属性逐渐减弱
第一电离能
有逐渐增大的趋势
逐渐减小
电负性
逐渐增强
逐渐减弱
离子的氧化性、还原性
阳离子氧化性逐渐增强
阴离子还原性逐渐减弱
阳离子氧化性逐渐减弱
阴离子还原性逐渐增强
气态氢化物的稳定性
逐渐增强
逐渐减弱
最高价氧化物对应的水化物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
三表
元素周期表:金属性“右弱左强,上弱下强,右上弱左下强”;非金属性“左弱右强,下弱上强,左下弱右上强”
金属活动性顺序表:按K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、Cu、Hg、Ag、Pt、Au的顺序,金属性逐渐减弱(其中Pb>Sn)
非金属活动性顺序表:按F、O、Cl、Br、I、S的顺序,非金属性逐渐减弱
三反应
置换反应:强的置换弱的,适合金属也适合非金属
与水或非氧化性酸反应越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强
与氢气反应越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应水化物的酸性越强,则非金属性越强
氧化性
金属离子的氧化性越弱,对应单质的金属性越强
还原性
非金属氢化物或非金属阴离子的还原性越弱,对应单质的非金属性越强
元素周期表中左侧元素(ⅠA、ⅡA族)
同主族相邻两元素中,Z(下)=Z(上)+上一周期元素所在周期的元素种类数目
元素周期表中右侧元素(ⅢA~ⅦA族)
同主族相邻两元素中,Z(下)=Z(上)+下一周期元素所在周期的元素种类数目
周期序数
1
2
3
4
5
6
7
原子序数差
无
1
1
11
11
25
25
实验
操作或叙述
A
探究C和Si的非金属性强弱
用湿润的pH试纸分别测定Na2CO3溶液和Na2SiO3溶液的pH
B
探究S和P的非金属性强弱
将质量和颗粒大小相同的铁粒,分别投入质量分数均为98%的硫酸和磷酸中
C
探究Na和K的金属性强弱
将切割剩余的金属钠、钾放回试剂瓶
D
探究Mg和Al的金属性强弱
利用Al2(SO4)3溶液与过量NaOH溶液反应制备Al(OH)3
新高考化学复习讲义+练习 第07讲 氧化还原反应(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第07讲 氧化还原反应(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第07讲氧化还原反应讲义原卷版+解析docx、新高考化学复习讲义+练习第07讲氧化还原反应练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共72页, 欢迎下载使用。
新高考化学复习讲义+练习 第04讲 物质的组成、性质和分类(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第04讲 物质的组成、性质和分类(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第04讲物质的组成性质和分类讲义原卷版+解析docx、新高考化学复习讲义+练习第04讲物质的组成性质和分类练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共56页, 欢迎下载使用。
新高考化学复习讲义+练习 第03讲 化学计算的常用方法(讲义+练习)(原卷版+解析): 这是一份新高考化学复习讲义+练习 第03讲 化学计算的常用方法(讲义+练习)(原卷版+解析),文件包含新高考化学复习讲义+练习第03讲化学计算的常用方法讲义原卷版+解析docx、新高考化学复习讲义+练习第03讲化学计算的常用方法练习原卷版+解析docx等2份试卷配套教学资源,其中试卷共45页, 欢迎下载使用。