福建省漳州市十校联盟2023-2024学年高三上学期期中质量检测联考化学试卷含答案
展开相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Ca-40 Cu-64 Sr-88 Ba-137
一、单选题(每小题只有一个正确选项,每题4分,共40分)
1.科技是第一生产力,我国科学家在诸多领域取得新突破,下列说法错误的是( )
A.利用CO2合成了脂肪酸:实现了无机小分子向有机高分子的转变
B.发现了月壤中的“嫦娥石[(Ca8Y)Fe(PO4)7]”:其成分属于无机盐
C.研制了高效率钙钛矿太阳能电池,其能量转化形式:太阳能→电能
D.革新了海水原位电解制氢工艺:其关键材料多孔聚四氟乙烯耐腐蚀
2.向饱和氯水中加入少量Na2SO3固体,下列说法正确的是( )
A.溶液颜色变深 B.溶液pH减小
C.溶液漂白性增强 D.溶液导电性减弱
3.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.3.6 g D2O和3.6 g H2O中含有的质子数均为2NA
B.含 2 ml H2SO4的浓硫酸和足量Cu在加热的条件下反应可生成NA个SO2分子
C.常温常压下,22.4 L甲醛(HCHO)含有的原子数目为 4NA
D.过氧化钠与水反应时,生成0.1 ml 氧气转移的电子数为 0.2NA
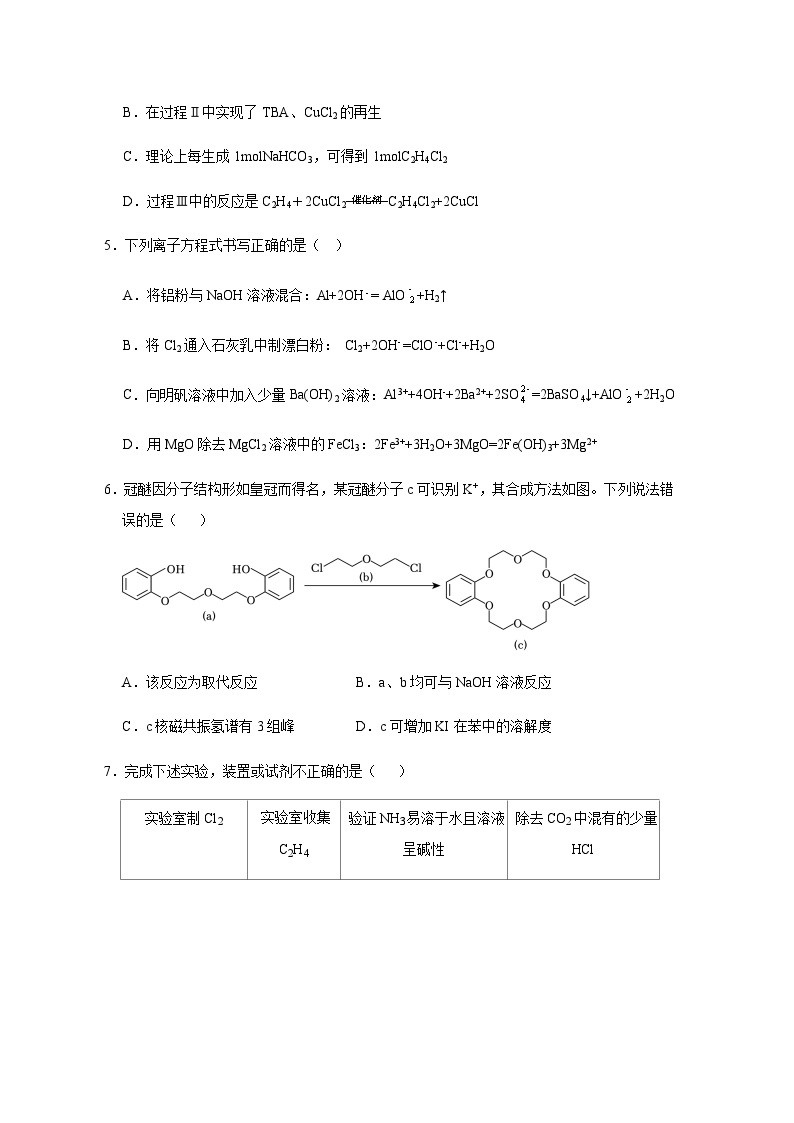
4.工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
A.过程I中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.理论上每生成1mlNaHCO3,可得到1mlC2H4Cl2
D.过程Ⅲ中的反应是C2H4+2CuCl2 eq \\ac(———,———,催化剂)C2H4Cl2+2CuCl
5.下列离子方程式书写正确的是( )
A.将铝粉与NaOH溶液混合:Al+2OH- = AlO+H2↑
B.将Cl2通入石灰乳中制漂白粉: Cl2+2OH- =ClO-+Cl-+H2O
C.向明矾溶液中加入少量Ba(OH)2溶液:Al3++4OH-+2Ba2++2SO=2BaSO4↓+AlO+2H2O
D.用MgO除去MgCl2溶液中的FeCl3:2Fe3++3H2O+3MgO=2Fe(OH)3+3Mg2+
6.冠醚因分子结构形如皇冠而得名,某冠醚分子c可识别K+,其合成方法如图。下列说法错误的是( )
A.该反应为取代反应 B.a、b均可与NaOH溶液反应
C.c核磁共振氢谱有3组峰 D.c可增加KI在苯中的溶解度
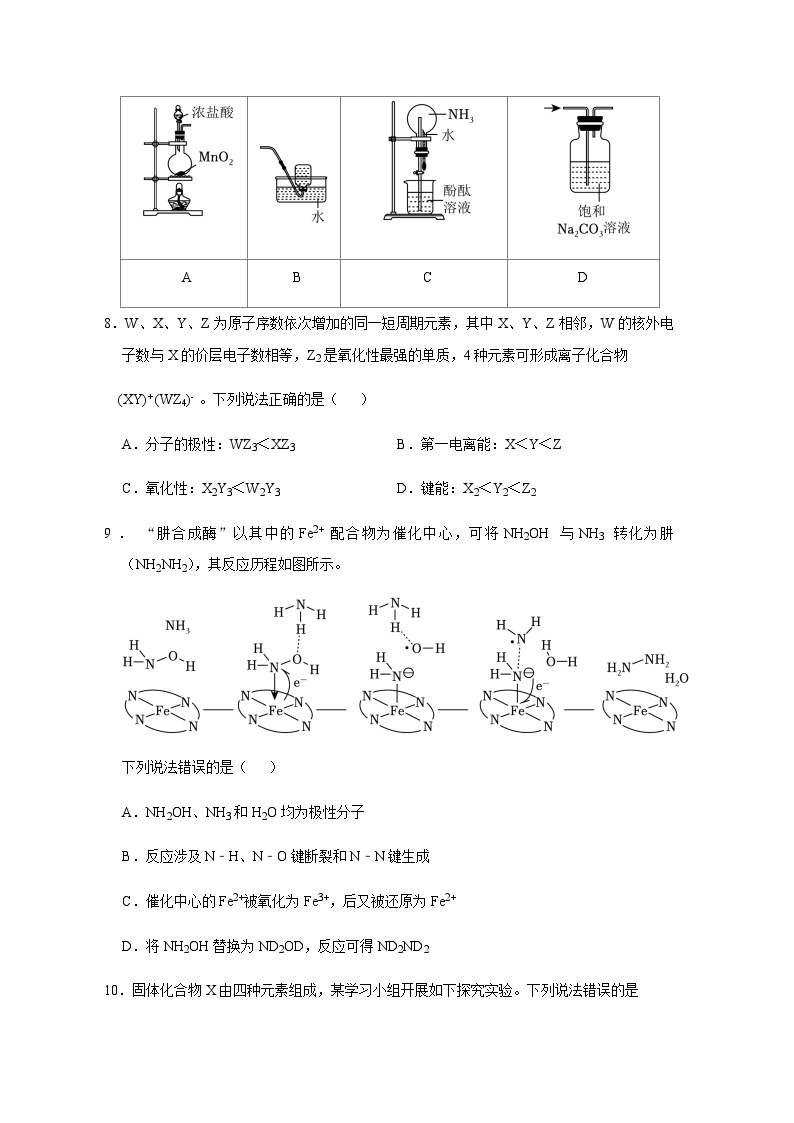
7.完成下述实验,装置或试剂不正确的是( )
8.W、X、Y、Z为原子序数依次增加的同一短周期元素,其中X、Y、Z相邻,W的核外电子数与X的价层电子数相等,Z2是氧化性最强的单质,4种元素可形成离子化合物
(XY)+ (WZ4)- 。下列说法正确的是( )
A.分子的极性:WZ3<XZ3B.第一电离能:X<Y<Z
C.氧化性:X2Y3<W2Y3D.键能:X2<Y2<Z2
9. “肼合成酶”以其中的Fe2+配合物为催化中心,可将NH2OH与NH3转化为肼(NH2NH2),其反应历程如图所示。
下列说法错误的是( )
A.NH2OH、NH3和H2O均为极性分子
B.反应涉及N﹣H、N﹣O键断裂和N﹣N键生成
C.催化中心的Fe2+被氧化为Fe3+,后又被还原为Fe2+
D.将NH2OH替换为ND2OD,反应可得ND2ND2
10.固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族
B.固体化合物X为Cu2(OH)2CO3
C.黑色化合物隔绝空气分解的过程中,生成1 ml砖红色化合物,转移2 ml电子
D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体
二、非选择题(包括4小题,共60分)
11.(14分)某学习小组为了验证SO2的还原性并测定产生SO2的质量,组装了下图装置。回答下列问题:(已知:K3[Fe(CN)6]可检验亚铁离子,生成蓝色沉淀)
(1)C中发生反应的化学方程式是 ,关于该套装置说法正确的是 (填标号)。
a. 组装仪器、加入药品后检查气密性
b. 实验开始和最后时均需要通入空气
c. 利用A、B装置是为了减小实验误差
d. F、G中的碱石灰可以换为无水CaCl2
(2)甲同学认为很快可以看到D装置的现象,他的依据是 (用离子方程式表示)。乙同学做实验时发现和甲同学预测的现象不一样,先出现棕红色,经过一段时间后变为浅绿色。于是查阅资料发现反应分为两步:
第一步:Fe3++SO2+H2O = Fe(HSO3)2+(棕红色)+H+ (快反应)
第二步:Fe3++ Fe(HSO3)2+ +H2O=SO42-+2Fe2++3H+ (慢反应)
如果需要验证第一步反应是快反应,可以事先在D装置中滴加数滴 试剂,相应的实验现象是 。
(3)学习小组通过实验后D和F装置中的数据来计算SO2的质量。D中加入足量的BaCl2溶液充分反应,经过 操作,测得沉淀为m1g,F的质量差为m2g,C中产生SO2的体积(标准状况下)为 L。
12.(15分)一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如下:
(1)锶与钙元素同主族。金属锶应保存在 中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为 。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是 。
(4)“重结晶”时蒸馏水用量(以质量比mH2O:mSrO表示)对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为 ,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是 。
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式 。
(6)将精制氢氧化锶完全溶于水,与氯化镁溶液在90℃时反应一段时间,下列判断MgCl2是否反应完全的最简易可行的方法是 (填标号)。
A. 反应器中沉淀量不再增加 B. 测定不同时间反应液pH
C. 测定Sr2+浓度变化 D. 向反应器中滴加AgNO3溶液观察是否有沉淀
(7)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·ml-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为 。
13.(15分)钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)钛和锆的价层电子结构相似,基态锆原子的价电子排布式为 。
(2)Ti(BH4)2是一种储氢材料。BH4- QUOTE 4- 的空间构型是 ,H、B、Ti的电负性由大到小的顺序为 。
(3)ZrCl4可以与乙二胺形成配合物[ZrCl4(H2NCH2CH2NH2)],其中Zr原子配位数为6。
①1ml [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为 ml。
②H2NCH2CH2NH2形成[ZrCl4(H2NCH2CH2NH2)]后,H-N-H键角将 (填“变大”“变小”或“不变”),原因是 。
(4)已知TiO2晶胞中Ti4+位于O2−所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2−所构成的立方体的体心,其晶胞结构如图所示:
①TiO2晶胞中O2−的配位数是 。
②已知ZrO2晶胞的密度为ρ g·cm−3,则晶体中Zr原子和O原子之间的最短距离 pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/ml)。
14.(16分)阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)
已知:R﹣COOHR﹣COClR﹣CONH2
回答下列问题:
(1)A的化学名称是 。
(2)由A生成B的化学方程式为 。
(3)反应条件D应选择 (填标号)。
a. HNO3/H2SO4 b. Fe/HCl c. NaOH/C2H5OH d. AgNO3/NH3
(4)C中官能团的名称是 。
(5)H生成I的反应类型为 。
(6)化合物J的结构简式为 。
(7)具有相同官能团的B的芳香同分异构体还有 种(不考虑立体异构)。
其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为 。
漳州市十校联盟2023-2024 学年高三上学期期中质量检测联考
化学答案
11.(14分) Na2SO3+H2SO4=Na2SO4+SO2↑+H2O bc 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 铁氰化钾或K3[Fe(CN)6] 溶液出现棕红色时没有生成蓝色沉淀 过滤、洗涤;干燥、称量 m1233+m264×22.4
12.(15分)煤油 SrSO4+4CSrS+4CO↑ Ca(OH)2,MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+= SrSO4↓ B SrCl2·H2O
13.(15分)(1)4d25s2
(2) 正四面体 Ti<B<H
(3) 17 变大 游离态H2NCH2CH2NH2与Zr结合后,孤电子对变成了σ键电子对,排斥力减小,因此H-N-H键之间的夹角会增大
(4) 3 34×34MρNA×1010pm
14. (16分)
(1) 邻硝基甲苯(或2﹣硝基甲苯), 。
(2)
(3) b
(4) 羧基、硝基、碳氯键 (5) 消去反应(消除反应) (6)
(7) 16 种
部分题解析
8【解答】解:A.依据分析可知,WZ3为BF3,为非极性分子,XZ3是NF3为极性分子,则分子的极性:WZ3<XZ3,故A正确;
B.第一电离能:O<N<F,即第一电离能:Y<X<Z,故B错误;
C.N2O3中N元素化合价为+3价,同亚硝酸盐中氮元素的价态相同,具有较强的氧化性,B2O3则性质相对稳定,故氧化性:N2O3>B2O3,故C错误;
D.氮气分子中是氮氮三键,氧气分子中是氧氧双键,氟气分子中是单键,则键能:N2>O2>F2,故D错误;
故选:A。
9.【解答】解:A.NH2OH,NH3,H2O的电荷分布都不均匀,不对称,为极性分子,故A正确;
B.由反应历程可知,有N﹣H,N﹣O键断裂,还有N﹣N键的生成,故B正确;
C.由反应历程可知,反应过程中,Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子生成Fe2+,故C正确;
D.由反应历程可知,反应过程中,生成的NH2NH2有两个氢来源于NH3,所以将NH2OH替换为ND2OD,不可能得到ND2ND2,得到ND2NH2和HDO,故D错误;
故选:D。
11.(15分) Na2SO3+H2SO4=Na2SO4+SO2↑+H2O bc 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 铁氰化钾或K3[Fe(CN)6] 溶液出现棕红色时没有生成蓝色沉淀 过滤、洗涤;干燥、称量 m1233+m264×22.4 C溶液中溶解的SO2未被充分排除或空气除氧不彻底
【分析】本实验验证SO2的还原性并测定产生SO2的质量,C装置是发生装置,制备SO2,A处通入空气,实验之前通空气是排除装置中的空气,实验之后通入空气是使C中的SO2进入D、F装置充分反应,则A、B装置是排除空气中的酸性气体和氧气,防止干扰试验;F装置通过碱石灰吸收SO2测其含量;SO2具有还原性,三价铁具有氧化性,发生氧化还原反应,溶液变成浅绿色;若要验证第一步Fe3++SO2+H2O=Fe(HSO3)2+(棕红色)+H+是快反应,可以检测是否立即生成Fe2+;溶液中有沉淀生成通过过滤、洗涤、干燥、称量得到沉淀质量;通过S元素守恒可求出C中产生的SO2的体积;据此分析。
【详解】(1)C装置是发生装置,制备SO2,发生反应的化学方程式是Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;B装置是吸收空气中的酸性气体,名称是洗气瓶或广口瓶;组装好仪器,加入药品之前检查气密性,a错误;实验开始和最后时均需要通入空气,实验之前通空气是排除装置中的空气,实验之后通入空气是使C中的SO2进入D、F装置充分反应,b正确;A、B装置是排除空气中的酸性气体和氧气,防止干扰实验,利用A、B装置是为了减小实验误差,c正确;F是吸收SO2,SO2与无水CaCl2不反应,d错误;答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;洗气瓶或广口瓶;bc;
(2)D装置中三价铁具有氧化性,SO2具有还原性,发生氧化还原反应,溶液变成浅绿色,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;若要验证第一步Fe3++SO2+H2O=Fe(HSO3)2+(棕红色)+H+是快反应,可以检测是否立即生成Fe2+,则实验前滴加几滴铁氰化钾或K3[Fe(CN)6],当溶液出现棕红色时没有生成蓝色沉淀即可说明;答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;铁氰化钾或K3[Fe(CN)6];溶液出现棕红色时没有生成蓝色沉淀;
(3)D中加入足量的BaCl2溶液充分反应,生成BaSO4沉淀,经过过滤、洗涤、干燥、称量操作,测得沉淀为m1g,F的质量差为m2g,说明剩余的SO2的质量为m2g,根据前后S原子守恒,n(SO2)=n(BaSO4)+n(剩余SO2)=m1233+m264ml,标准状况下的体积为m1233+m264×22.4L,该实验的设计中,仍然存在系统误差的可能原因是C溶液中溶解的SO2未被充分排除或空气除氧不彻底;答案为:过滤、洗涤、干燥、称量;m1233+m264×22.4;
12.煤油 SrSO4+4CSrS+4CO↑ Ca(OH)2,MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+= SrSO4↓ B SrCl2·H2O
【分析】流程图可知:工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质,高温煅烧生成对应的氧化物SrO、CaO、MgO、BaO,SrO与水反应生成Sr(OH)2,CaO与水反应生成Ca(OH)2,微溶于水,BaO与水反应生成Ba(OH)2,MgO难溶于水;过滤后滤渣的主要成分为Ca(OH)2,MgO;锶与钙元素同主族,均活泼,所以保存在煤油中;SrSO4与过量焦炭隔绝空气微波加热还原为硫化锶和CO;SrCl2除SO42-杂质利用的是沉淀法;氢氧化锶完全溶于水,与氯化镁反应后生成氯化锶和氢氧化镁,由于溶液pH变化明显,最简单的方法是测定不同时间反应液的pH;根据脱水失重的比例计算出失水的物质的量,进而求出化学式。据此分析。
【详解】(1)锶与钙元素同主族,且锶的金属性大于钙,易与水、乙醇等物质反应,故金属锶应保存在煤油中;答案为:煤油;
(2)根据氧化还原反应原理可知SrSO4与过量焦炭隔绝空气微波加热还原为硫化锶和CO,化学方程式为SrSO4+4CSrS+4CO↑;答案为:SrSO4+4CSrS+4CO↑;
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质,高温煅烧生成对应的氧化物CaO、MgO、BaO,CaO与水反应生成Ca(OH)2,微溶于水,BaO与水反应生成Ba(OH)2,MgO难溶于水;过滤后滤渣的主要成分为Ca(OH)2,MgO;答案为:Ca(OH)2,MgO;
(4)根据图表信息得质量比为8:1时Sr(OH)2·8H2O的纯度和产率均相对较高;当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小;答案为:8:1;随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小;
(5)“净化”过程中常使用SrCl2除SO42-杂质,以生成沉淀的方式除杂,离子方程式为SO42-+Sr2+= SrSO4↓;答案为:SO42-+Sr2+= SrSO4↓;
(6)氢氧化锶完全溶于水,与氯化镁反应后生成氯化锶和氢氧化镁,由于溶液pH变化明显,最简单的方法是测定不同时间反应液的pH;答案为:B;
(7)SrCl2·6H2O(M=267g·ml-1)脱水过程采用烘干法在170℃下预脱水,失重达33.7%,失重为H2O的质量。假设SrCl2·6H2O的物质的量1ml,质量为267g,在170℃下预脱水,失重33.7%,失重的质量为267g×33.7%=90g,则失水的物质的量为5ml,则此时产物的化学式为SrCl2·H2O;答案为:SrCl2·H2O;
13.(1)4d25s2
(2) 正四面体 Ti<B<H
(3) 17 变大 游离态H2NCH2CH2NH2与Zr结合后,孤电子对变成了σ键电子对,排斥力减小,因此H-N-H键之间的夹角会增大
(4) 3 34×34MρNA×1010pm
【详解】(1)Ti的原子序数为22,核外电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为:3d24s2,钛和锆的价层电子结构相同,基态锆原子的价电子排布式为4d25s2。故答案为:4d25s2;
(2)BH4-与CH4具有相同的原子数目和相同的价电子数目,两者互为等电子体,空间构型相似,甲烷为正四面体形,BH4-的空间构型是正四面体形,金属元素的电负性小于非金属元素,H元素在非金属元素中电负性之比B大,所以H、B、Ti的电负性由小到大的顺序为:Ti<B<H。故答案为:正四面体;Ti<B<H;
(3)①1 个[ZrCl4(H2NCH2CH2NH2)]中含有Zr←Cl配位键4个,Zr←N配位键2个,配位键属于σ键,共6个,H2NCH2CH2NH2中含有N-H键4个、C-H键4个、N-C键2个、C-C键1个,共11个共价键,属于σ键,所以总共有17个共价键,1ml [ZrCl4(H2NCH2CH2NH2)]中含有σ键的物质的量为17ml。故答案为:17;
②游离态 H2NCH2CH2NH2中N原子有一对孤对电子,配合物中N原子提供一对孤对电子与Zr形成配位键,孤电子对之间的斥力>孤电子与成键电子之间的斥力>成键电子对之间的斥力,与Zr形成配位键,孤电子对变成了σ键电子对,即成键电子对,排斥力减小,因此H-N-H之间的夹角会增大。故答案为:变大;游离态H2NCH2CH2NH2与Zr结合后,孤电子对变成了σ键电子对,排斥力减小,因此H-N-H键之间的夹角会增大;
(4)①TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,Ti4+的配位数为6,晶胞中Ti4+的数目为:1+8×18=2,O2-的数目为:2+4×12=4,则TiO2晶胞中O2-的配位数是3,故答案为:3;
②已知二氧化锆晶胞的密度为ρ g•cm-3,则晶体中Zr原子和O原子之间的最短距离,晶胞体对角线长度等于棱长的3 倍,两原子核之间的距离为apm,则晶胞的棱长为:4a3×10-10cm,晶胞中黑色球数目为8,白色球数目为4,即O原子数目为8,Zr原子数目为4,晶胞质量为:4MNAg=(4a3×10-10cm)3×ρg/cm3,解得:a=34×34MρNA×1010pm,故答案为:34×34MρNA×1010。
14.阿佐塞米(化合物L)是一种可用于治疗心脏、肝脏和肾脏病引起的水肿的药物。L的一种合成路线如图(部分试剂和条件略去)
已知:R﹣COOHR﹣COClR﹣CONH2
回答下列问题:
(1)A的化学名称是 邻硝基甲苯(或2﹣硝基甲苯), 。
(2)由A生成B的化学方程式为 。
(3)反应条件D应选择 b (填标号)。
a.HNO3/H2SO4
b.Fe/HCl
c.NaOH/C2H5OH
d.AgNO3/NH3
(4)F中含氧官能团的名称是 羧基 。
(5)H生成I的反应类型为 消去反应(消除反应) 。
(6)化合物J的结构简式为 。
(7)具有相同官能团的B的芳香同分异构体还有 d 种(不考虑立体异构,填标号)。
a.10
b.12
c.14
d.16
其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为 。
【解答】解:(1)根据分析可知,A为,A的化学名称是邻硝基甲苯(或2﹣硝基甲苯),
故答案为:邻硝基甲苯(或2﹣硝基甲苯);
(2)根据分析可知,由A生成B的化学方程式为,
故答案为;
(3)根据分析可知,反应条件D应选择Fe/HCl,
故答案为:b;
(4)根据流程中F的结构可知,F中含氧官能团的名称是羧基,
故答案为:羧基;
(5)根据分析可知,H生成I的反应类型是消去反应(或消除反应),
故答案为:消去反应(或消除反应);
(6)根据分析,结合I和K的结构可知,J的结构为,
故答案为;
(7)甲基和硝基处于邻位时,Cl原子还有如图所示的三种,若甲基和硝基处于间位时,Cl原子有四种位置,若甲基和硝基处于对位时,Cl原子有2种位置,此时共有(3+4+2)=9种结构,若苯环上只有2个取代基,①取代基为﹣CH2NO2、﹣Cl,﹣Cl处于邻、间、对,有3种结构,②取代基为﹣CH2Cl、﹣NO2,﹣NO2处于邻、间、对,有3种结构,若苯环上只有1个取代基时,即取代基为﹣CHNO2Cl,此时只有1种结构,所以总共有(9+3+3+1)=16种,其中,核磁共振氢谱显示4组峰,且峰面积比为2:2:1:1的同分异构体结构为,
故答案为:d。
实验室制Cl2
实验室收集C2H4
验证NH3易溶于水且溶液呈碱性
除去CO2中混有的少量HCl
A
B
C
D
质量mH2O:mSrO
4:1
5:1
6:1
7:1
8:1
9:1
10:1
Sr(OH)2·8H2O纯度%
98.64
98.68
98.65
98.64
98.63
98.63
98.65
Sr(OH)2·8H2O产率%
17.91
53.36
63.50
72.66
92.17
89.65
88.93
1 A
2 B
3 D
4 C
5 D
6 C
7 D
8 A
9 D
10 B
福建省漳州市多校2023-2024学年高一上学期期中联考化学试题含答案: 这是一份福建省漳州市多校2023-2024学年高一上学期期中联考化学试题含答案,共11页。试卷主要包含了本试卷分为第Ⅰ卷和第Ⅱ卷两部分,本试卷可能用到的相对原子质量,下列仪器与名称不对应的是,设,为阿伏加德罗常数的值等内容,欢迎下载使用。
福建省漳州市十校联盟2023-2024学年高二上学期期中质量检测联考化学试卷: 这是一份福建省漳州市十校联盟2023-2024学年高二上学期期中质量检测联考化学试卷,共8页。
福建省漳州市2023-2024学年高一上学期十校联盟期中质量检测化学试题: 这是一份福建省漳州市2023-2024学年高一上学期十校联盟期中质量检测化学试题,共6页。