

第01讲硫和二氧化硫(讲义)-【寒假自学课】2024年高一化学寒假精品课(人教版2019必修第二册
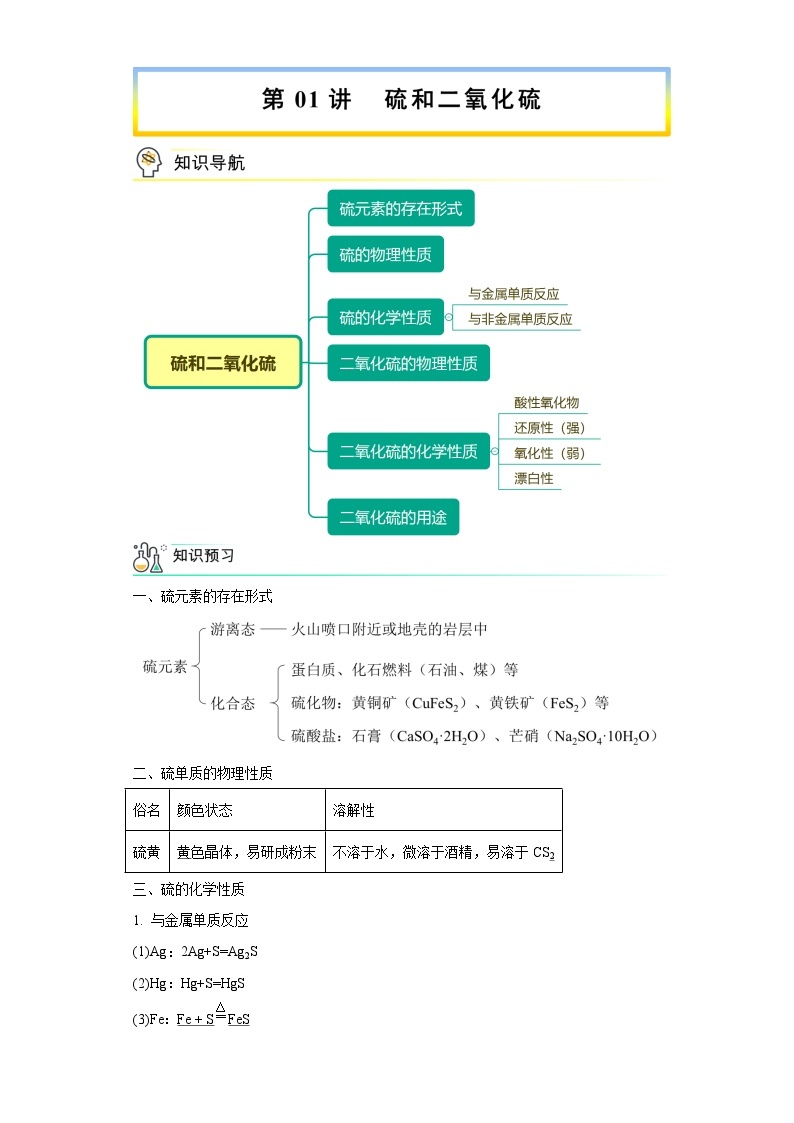
展开一、硫元素的存在形式
二、硫单质的物理性质
三、硫的化学性质
1. 与金属单质反应
(1)Ag:2Ag+S=Ag2S
(2)Hg:Hg+S=HgS
(3)Fe:Fe + SFeS
(4)Cu:2Cu + S Cu2S
2. 与非金属单质反应
(1)H2:S+H2 H2S
(2)O2:S + O2 SO2
实验探究——SO2溶于水
四、二氧化硫的物理性质
五、二氧化硫的化学性质
1.具有酸性氧化物的通性
(1)与水反应(可逆反应):SO2 + H2O⇌ H2SO3
(2)与碱性氧化物反应(如CaO):SO2 + CaO = CaSO3
(3)与碱反应:a. 少量SO2 + 澄清石灰水:Ca(OH)2 + SO2 = CaSO3↓ + H2O(现象:变浑浊)
b. 过量SO2 + 澄清石灰水:Ca(OH)2 + 2SO2 =Ca(HSO3)2(现象:先浑浊,后澄清)
2.SO2的还原性(强)
SO2具有较强的还原性,可被氧化剂(O2﹑H2O2、KMnO4、Cl2﹑Fe3+等)氧化。
(1)O2:2SO2 + O22SO3
(2)H2O2:SO2 + H2O2 = H2SO4
(3)KMnO4: 5SO2 + 2 + 2H2O = 5 + 2Mn2+ + 4H+
(4)Cl2:Cl2 + SO2 + 2H2O = 4H+ + 2Cl- +
(5)Fe3+:2Fe3+ + SO2 + 2H2O = 4H+ + 2Fe2+ +
3.SO2的氧化性(弱)
SO2的氧化性较弱,可与H2S反应:SO2 + 2H2S = 3S + 2H2O。
4.SO2的漂白性
(1)SO2具有漂白作用,能使品红溶液褪色,但不能使酸碱指示剂褪色。
(2)漂白原理:SO2与有色物质结合生成了不稳定的无色物质,加热(或见光、长久放置)后,不稳定的无色物质又会发生分解,恢复到原来的颜色。
六、二氧化硫的用途
1. 工业上常用SO2来漂白纸浆、毛、丝等;
2. SO2可用于杀菌消毒,还是一种食品添加剂。
题型一:硫的存在与性质
1.下列说法中,不正确的是
A.硫是一种淡黄色的能溶于水的固体B.硫在自然界中仅以化合态存在
C.硫与铁反应生成硫化亚铁D.硫在空气中的燃烧产物是二氧化硫
2.下列说法正确的是
A.硫质脆,微溶于酒精和二硫化碳
B.硫与氢气反应,体现了硫的还原性
C.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物
D.从硫的化合价角度分析,硫单质既可作氧化剂又可作还原剂
题型二:二氧化硫的性质
3.下列有关SO2的说法错误的是
A.SO2能与NaOH溶液反应,说明SO2是酸性氧化物
B.SO2通入溴水,溴水褪色,说明SO2有还原性
C.SO2通入H2S溶液中有浅黄色沉淀生成,说明SO2有氧化性
D.SO2气体能使酸性高锰酸钾溶液褪色,说明SO2有漂白性
4.下列离子方程式正确的是( )
A.向NaOH溶液中通入少量的SO2:SO2+OH-===
B.向新制氯水中通入少量的SO2:Cl2+SO2+2H2O===4H++2Cl-+
C.将SO2通入饱和NaHCO3溶液:2H++===H2O+CO2↑
D.将SO2通入BaCl2溶液:SO2+H2O+Ba2+===BaSO3↓+2H+
5.实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)判断铜与浓硫酸反应有二氧化硫生成所依据的现象是 。
(2)甲装置中发生的主要反应的化学方程式是 ,浓硫酸表现的性质是 。
(3)装置乙中试管口放有一团浸有饱和碳酸钠溶液或氢氧化钠溶液的棉花,请写出二氧化硫与氢氧化钠溶液反应的离子方程式: 。
(4)该反应中若有3.2 g铜参加反应,则被还原的硫酸的物质的量为 ,起酸的作用的硫酸的物质的量为 。
(5)含有0.2 ml硫酸的浓硫酸,在加热时能否溶解6.4 g铜,结论和理由是 。
6.大气污染物SO2是一种无色刺激性气味气体,A装置可产生SO2,某学习小组利用如图所示装置探究SO2的相关性质(装置A加热装置略):
回答下列问题:
(1)实验开始时,先打开分液漏斗的 (填“玻璃塞a”或“活塞b”,下同),再打开 ,逐滴加入浓硫酸;
(2)一段时间后,装置B中出现的现象是 ,可证明SO2具有 (填“氧化性”或“还原性”);
(3)充分反应后取装置C中溶液,加热出现的现象是 。
(4)装置D中发生反应的离子方程式是 。
7.下列关于硫的说法不正确的是
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在纯氧气中的燃烧产物是三氧化硫
8.下列物质中,不能由单质直接化合生成的是
①CuS ②FeS ③SO3 ④H2S ⑤FeCl2
A.①③⑤B.①②③⑤C.①②④⑤D.全部
9.下列关于二氧化硫的说法不正确的是( )
A.能使某些有色物质褪色B.无色、有刺激性气味、无毒
C.既有氧化性、又有还原性D.既可溶于水、又可与水反应
10.如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是
A.AB.BC.CD.D
11.如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、蘸有KMnO4溶液的滤纸均褪色证明了SO2具有漂白性
C.湿润淀粉KI试纸变蓝
D.NaOH溶液可用于除去实验中多余的SO2
12.下列关于SO2性质的说法正确的是( )
A.二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加
B.氯气和二氧化硫都有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色布条,可以观察到有色布条先褪色,后复原
C.将少量SO2气体通入BaCl2和FeCl3的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,该白色沉淀是BaSO3
D.向SO2水溶液中通入H2S气体,有淡黄色沉淀产生,说明SO2水溶液具有还原性
13.如图是实验室制取SO2并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验),A装置可制取SO2,请回答下列问题:
(1)①中的实验现象为紫色石蕊溶液 。
②中的实验现象为 ,写出此化学反应方程式 。
③中的实验现象是 。
⑥中的实验现象是 。
④中的实验现象是 ,写出此化学反应方程式 。
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为 。
(2)能体现出SO2还原性的实验序号是 。
(3)实验结束后需要通入N2,其目的是 。
14.某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图装置:
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质 ;
(2)反应开始后,发现B、D两个广口瓶中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ,D ;
(3)装置C的作用是 ;
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验:
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的: 。
②试分析甲同学实验过程中,品红溶液不褪色的原因是: 。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的? 。
俗名
颜色状态
溶解性
硫黄
黄色晶体,易研成粉末
不溶于水,微溶于酒精,易溶于CS2
实验操作
把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞。
实验现象
试管内液面上升
实验结论
SO2可溶于水
颜色
气味
状态
密度
溶解性
沸点
无色
刺激性
气体
比空气大
易溶于水,1体积水能溶解40体积SO2
较低,易液化
选项
试剂
现象
结论
A
酸性KMnO4溶液
溶液褪色
SO2有氧化性
B
品红溶液
溶液褪色
SO2有漂白性
C
NaOH溶液
无明显现象
SO2与NaOH溶液不反应
D
硫化氢水溶液
溶液变浑浊
SO2有还原性
参考答案:
1.AB
【详解】A.硫是一种淡黄色固体,难溶于水,微溶于乙醇,易溶于CS2,A错误;
B.硫在自然界中既有游离态又有化合态,B错误;
C.硫与铁反应生成硫化亚铁,Fe+SFeS,C正确;
D.硫在空气中的燃烧生成二氧化硫,S+O2SO2,D正确;
故选AB。
2.D
【详解】A.硫质脆,微溶于酒精,易溶于二硫化碳,A错误;
B.硫与氢气反应生成硫化氢,其中硫的化合价降低,表现氧化性,B错误;
C.硫与铁粉和铜粉反应分别生成FeS和Cu2S,C错误;
D.硫单质中S为0价,在反应中既可以作氧化剂,化合价降低到价,也可以作还原剂,化合价升高到、价,D正确;
答案选D。
3.D
【详解】A、SO2能与NaOH发生生成Na2SO3或NaHSO3,说明SO2的酸性氧化物,故A说法正确;
B、SO2与溴水发生SO2+Br2+2H2O=H2SO4+2HBr,体现SO2的还原性,故B说法正确;
C、SO2与H2S发生SO2+2H2S=3S↓+2H2O,体现SO2的氧化性,故C说法正确;
D、SO2能使酸性高锰酸钾溶液褪色,说明SO2的还原性,故D说法错误;
答案选D。
【点睛】SO2的漂白性实验,主要体现在SO2能使品红溶液褪色,而使溴水、酸性高锰酸钾溶液褪色,则体现SO2的还原性,这是学生容易混淆的地方。
4.B
【详解】A.向NaOH溶液中通入少量的SO2,离子方程式:SO2+2OH-===SO32-+H2O,故A错误;
B.向氯水中通入少量的SO2,离子方程式:Cl2+SO2+2H2O===4H++2Cl-+SO,所以B选项是正确的;
C. 将SO2通入饱和NaHCO3溶液中,离子方程式:SO2+2HCO3-=H2O+CO2+SO32-,故C错误;
D. 将SO2通入BaCl2溶液中不发生反应,故D错误。
所以B选项是正确的。
5.(1)乙中品红溶液褪色
(2) Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O 强氧化性、酸性
(3)2OH-+SO2=SO+H2O
(4) 0.05 ml 0.05 ml
(5)溶解铜的质量小于6.4 g,因为随反应的进行,浓硫酸的浓度减小,变为稀硫酸就不再与铜反应了
【详解】(1)二氧化硫具有漂白性,能使品红溶液褪色,所以若乙中品红溶液红色褪去,证明有二氧化硫产生;
(2)甲装置中铜和浓硫酸在加热条件下发生反应生成二氧化硫、硫酸铜和水,化学反应方程式:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;该反应中浓硫酸被还原,且同时有盐和水生成,所以体现浓硫酸的强氧化性和酸性;
(3)二氧化硫和氢氧化钠溶液反应生成亚硫酸钠,离子反应方程式为:2OH-+SO2=SO+H2O;
(4)根据反应方程式可知被还原的硫酸的物质的量=参与反应的铜的物质的量,3.2 g 铜的物质的量==0.05ml,被还原的硫酸的物质的量=0.05ml;生成0.05ml硫酸铜,所以起酸的作用的硫酸的物质的量为0.05ml;
(5)根据反应方程式可知,0.2ml硫酸若完全反应则可以消耗0.1mlCu,即6.4gCu,但随铜与浓硫酸反应的进行,浓硫酸的浓度减小,变为稀硫酸不再与铜反应,反应中实际溶解铜的质量小于6.4 g。
6.(1) 玻璃塞a 活塞b
(2) 有白色沉淀产生 还原性
(3)又出现红色
(4)SO2+2OH- = SO+H2O
【分析】A装置为气体制备装置,B验证SO2还原性 ,C验证SO2漂白性,D尾气处理装置;
【详解】(1)为了保证浓硫酸液体能顺利流下,需要维持内外压强平衡,所以需要下打开分液漏斗a,让内外流通保持压强平衡,再打开b,让硫酸顺利流下;故答案为:玻璃塞a;玻璃塞b;
(2)二氧化硫与双氧水生成硫酸,二氧化硫作还原剂,体现还原性,硫酸与氯化钡生成白色沉淀硫酸钡;故答案为:有白色沉淀产生;还原性;
(3)SO2有漂白性,使品红溶液褪色,其漂白性具有可逆性,受热后品红复色;故答案为:又出现红色。
(4)D装置为尾气回收装置,发生的反应;故答案为:。
7.D
【详解】A.硫易溶于二硫化碳,试管内壁附着的硫可用二硫化碳溶解除去,故A正确;
B.游离态的硫存在于火山喷口附近或地壳的岩层里,故B正确;
C.硫单质中硫为0价,为硫的中间价态,既有氧化性又有还原性,故C正确;
D.硫在空气中或纯氧中燃烧只能生成二氧化硫,与氧气是否过量无关,故D错误;
答案选D。
【点睛】处于最低价态的物质具有还原性,具有最高价态的物质具有氧化性,处于中间价态的物质既具有氧化性又有还原性。
8.A
【详解】试题分析:①S单质的氧化性较弱,Cu与S单质加热发生反应变为Cu2S,错误;②Fe与S混合加热发生反应产生FeS,正确;③S点燃与氧气发生反应产生SO2,错误;④氢气与硫单质在高温下发生化合反应产生H2S,正确;⑤由于氯气的氧化性很强,因此Fe与氯气发生反应产生FeCl3,错误。不能由单质直接化合生成的是①③⑤,选项A符合题意。
考点:考查物质制备方法正误判断的知识。
9.B
【详解】A.二氧化硫具有漂白性,可使品红溶液(有机色质)褪色,选项A正确;
B.二氧化硫是无色、有刺激性气味的有毒气体,选项B错误;
C.二氧化硫中S元素的化合价为+4价,为中间价态,则既有氧化性,又有还原性,选项C正确;
D.二氧化硫可与水反应生成亚硫酸,为酸性氧化物,选项D正确;
答案选B。
【点睛】本题考查二氧化硫的性质,把握二氧化硫的漂白性、毒性、氧化性和还原性、酸性氧化物的性质为解答的关键,侧重化学性质的考查,题目难度不大。
10.B
【详解】A.酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子,是酸性高锰酸钾的氧化性的体现,这里体现的是二氧化硫的还原性,A错误;
B.使品红溶液褪色是特征反应,化合生成不稳定的化合物加热后又恢复为原来的红色,体现了二氧化硫的漂白性,B正确;
C.二氧化硫为酸性氧化物,能跟氢氧化钠反应生成亚硫酸钠和水,但无明显现象,C错误;
D.二氧化硫能与H2S反应生成S和H2O,体现SO2的氧化性,D错误;
答案选B。
【点睛】本题考查二氧化硫的性质,主要性质为:二氧化硫为酸性氧化物,具有酸性氧化物的通性,二氧化硫还具有漂白性、强还原性、弱氧化性,注意二氧化硫的漂白具有选择性,与次氯酸等强氧化性漂白性的区别。
11.D
【分析】吸入浓硫酸,浓硫酸和亚硫酸钠反应产生二氧化硫。
【详解】A .SO2不能漂白指示剂,只能使蓝色石蕊试纸只变红,不褪色,A错误;
B. SO2把KMnO4还原而使之褪色,体现二氧化硫还原性,B错误;
C. SO2氧化性比I2弱,不能将I-氧化成I2,C错误;
D. SO2有毒,可用NaOH溶液吸收,D正确;
故答案为:D。
12.A
【详解】A. 二氧化硫具有还原性,可抑制酒类中细菌生长,因此可在葡萄酒中微量添加,A正确;
B. 氯气和二氧化硫都有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色布条,二者会发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,产生的两种物质都没有漂白性,因此可以观察到有色布条不褪色,B错误;
C. 将少量SO2气体通入BaCl2和FeCl3的混合溶液中,会发生反应:2FeCl3+SO2+2H2O=2FeCl2+H2SO4+2HCl,H2SO4+BaCl2=BaSO4↓+2HCl,因此会看到溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,该白色沉淀是BaSO4,C错误;
D. 向SO2水溶液中通入H2S气体,发生反应:SO2+2H2S=3S↓+2H2O,有淡黄色沉淀S单质产生,说明SO2水溶液具有氧化性,D错误;
故合理选项是A。
13.(1) 变红 出现黄色沉淀 2H2S+SO2=3S↓+2H2O 氯水的黄绿色褪去 KMnO4酸性溶液褪色 出现白色沉淀 H2O2+SO2+BaCl2=BaSO4↓+2HCl 3Fe3++SO2+2H2O=2Fe2++SO+4H+
(2)③④⑤⑥
(3)使装置内SO2全部排入NaOH溶液中,避免环境污染
【分析】Cu与浓硫酸在加热条件下反应,生成SO2,SO2为酸性氧化物,能使紫色石蕊溶液变红;SO2具有为氧化性,能与氢硫酸反应,生成黄色沉淀;SO2具有为还原性,能与氧化性物质反应;SO2对环境有害,实验时要用NaOH进行尾气处理。
【详解】(1)①中生成SO2为酸性氧化物,能使紫色石蕊溶液变红;
故答案为:变红;
②中为氢硫酸溶液,SO2具有为氧化性,能与氢硫酸反应,生成黄色沉淀,反应为SO2+2H2S=3S+2H2O;
故答案为:生成黄色沉淀;SO2+2H2S=3S+2H2O;
③中为氯水,SO2具有为还原性,能使氯水褪色;
故答案为:氯水的黄绿色褪去;
⑥中为高锰酸钾酸性溶液,SO2具有为还原性,能使高锰酸钾酸性溶液褪色;
故答案为:高锰酸钾酸性溶液褪色;
④中为双氧水和氯化钡,H2O2将SO2氧化为硫酸根,硫酸根与钡离子结合,产生硫酸钡的白色沉淀,反应为SO2+H2O2+BaCl2=BaSO4+2HCI;
故答案为:出现白色沉淀;H2O2+SO2+BaCl2=BaSO4+2HCI;
⑤中为氯化铁溶液,通入二氧化硫,溶液由黄色变为浅绿色,体现氯化铁氧化性,离子方程式为;
故答案为:。
(2)③④⑤⑥中装有的都是强氧化性物质,能与SO2发生氧化还原反应,且SO2为还原剂;
故答案为:③④⑤⑥。
(3)SO2对环境有害,实验时要用NaOH处理干净;
故答案为:使装置内SO2全部排入NaOH溶液中,避免环境污染。
14.(1)酸性、还原性
(2) B溶液恢复红色 D溶液仍无色
(3)吸收多余的SO2或Cl2,防止污染环境
(4) 使SO2和Cl2混合均匀,通过观察气泡控制气体的流速 控制SO2和Cl2按物质的量之比1︰1进气,二者发生反应,生成无漂白性的H2SO4和HCl,SO2+Cl2+2H2O=SO+2Cl-+4H+ 控制SO2和Cl2进气的物质的量,使之不相等
【分析】A中制取二氧化硫气体,E中制取氯气,用B、D中的品红检验二氧化硫和氯气的漂白性,氢氧化钠溶液吸收尾气,防止污染空气。
【详解】(1)实验室常用加热制取氯气的反应为二氧化锰和浓盐酸反应,反应中盐酸表现了还原性与酸性;
(2)B中二氧化硫能使品红褪色,加热后能恢复红色,D中氯气能使品红褪色,但是加热后不能恢复;
(3)氢氧化钠能吸收氯气和二氧化硫,防止污染;
(4)①先将SO2和Cl2通过浓硫酸中的目的是使SO2和Cl2混合均匀,通过观察气泡控制气体的流速;
②氯气能和二氧化硫反应生成硫酸和盐酸,没有漂白性,方程式为:SO2+Cl2+2H2O=SO+2Cl-+4H+;
③可以让其中一种气体过量,即氯气或二氧化硫之一过量即可,胡答案为:控制SO2和Cl2进气的物质的量,使之不相等。
化学必修 第二册第五章 化工生产中的重要非金属元素第一节 硫及其化合物优秀学案设计: 这是一份化学必修 第二册<a href="/hx/tb_c4000033_t4/?tag_id=42" target="_blank">第五章 化工生产中的重要非金属元素第一节 硫及其化合物优秀学案设计</a>,文件包含人教版1019高中化学必修2同步讲义第01讲硫和二氧化硫教师版docx、人教版1019高中化学必修2同步讲义第01讲硫和二氧化硫学生版docx等2份学案配套教学资源,其中学案共22页, 欢迎下载使用。
高中人教版 (2019)第一节 硫及其化合物导学案: 这是一份高中人教版 (2019)第一节 硫及其化合物导学案,共20页。学案主要包含了新知学习,知识进阶,问题探究,知识归纳总结,效果检测等内容,欢迎下载使用。
第01讲 物质的分类-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册): 这是一份第01讲 物质的分类-【暑假自学课】2022年新高一化学暑假精品课(苏教版2019必修第一册),文件包含第01讲物质的分类-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册解析版docx、第01讲物质的分类-暑假自学课2022年新高一化学暑假精品课苏教版2019必修第一册原卷版docx等2份学案配套教学资源,其中学案共15页, 欢迎下载使用。