

鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第3节 沉淀溶解平衡精练
展开1.下列对沉淀溶解平衡的描述正确的是( )
A.开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀速率和溶解速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,再加入该沉淀,将促进溶解
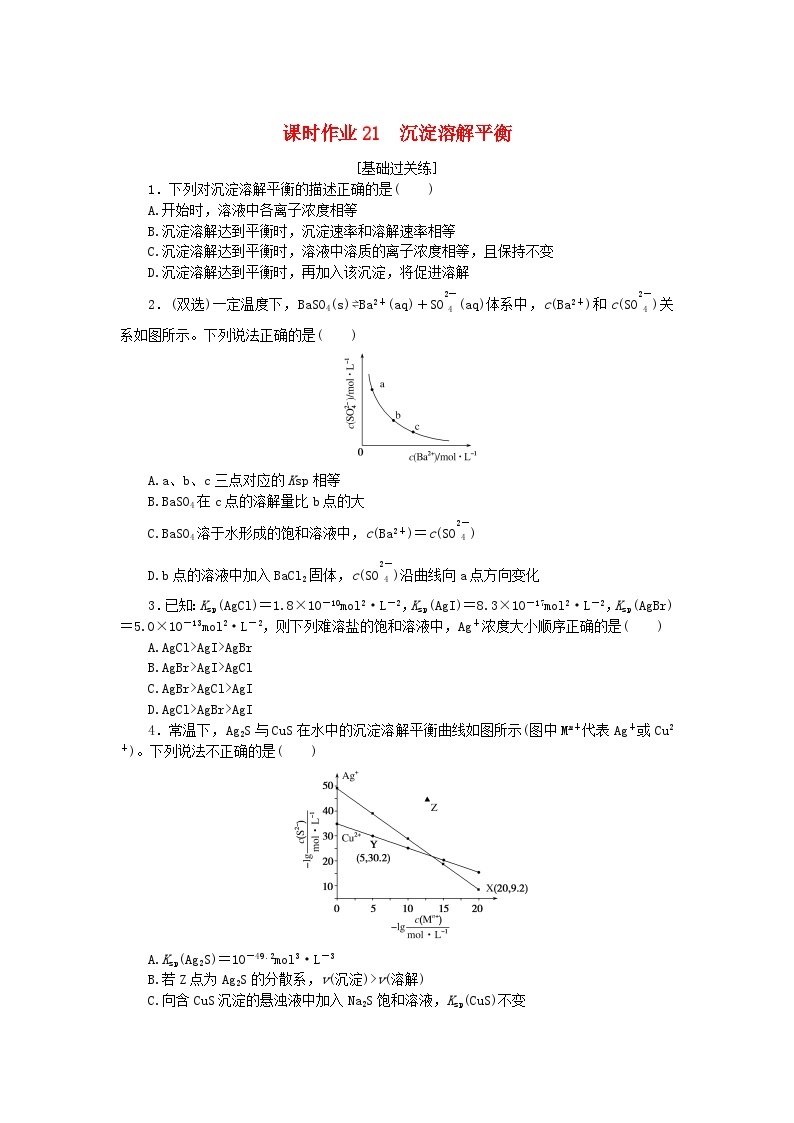
2.(双选)一定温度下,BaSO4(s)⇌Ba2+(aq)+SO eq \\al(\s\up1(2-),\s\d1(4)) (aq)体系中,c(Ba2+)和c(SO eq \\al(\s\up1(2-),\s\d1(4)) )关系如图所示。下列说法正确的是( )
A.a、b、c三点对应的Ksp相等
B.BaSO4在c点的溶解量比b点的大
C.BaSO4溶于水形成的饱和溶液中,c(Ba2+)=c(SO eq \\al(\s\up1(2-),\s\d1(4)) )
D.b点的溶液中加入BaCl2固体,c(SO eq \\al(\s\up1(2-),\s\d1(4)) )沿曲线向a点方向变化
3.已知:Ksp(AgCl)=1.8×10-10ml2·L-2,Ksp(AgI)=8.3×10-17ml2·L-2,Ksp(AgBr)=5.0×10-13ml2·L-2,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>AgBr
B.AgBr>AgI>AgCl
C.AgBr>AgCl>AgI
D.AgCl>AgBr>AgI
4.常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示(图中Mn+代表Ag+或Cu2+)。下列说法不正确的是( )
A.Ksp(Ag2S)=10-49.2ml3·L-3
B.若Z点为Ag2S的分散系,v(沉淀)>v(溶解)
C.向含CuS沉淀的悬浊液中加入Na2S饱和溶液,Ksp(CuS)不变
D.CuS(s)+2Ag+(aq)===Ag2S(s)+Cu2+(aq)反应趋于完全
5.已知25℃时FeS、CuS的Ksp分别为6.3×10-18ml2·L-2、1.3×10-36ml2·L-2,H2S的电离平衡常数Ka1=9.1×10-8ml·L-1、Ka2=1.1×10-12ml·L-1。下列有关说法正确的是( )
A.除去工业废水中的Cu2+可以选用FeS作沉淀剂
B.将足量CuSO4固体溶解在0.1ml·L-1H2S溶液中,Cu2+的最大浓度为1.3×10-35ml·L-1
C.因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生
D.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强
6.要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与SO eq \\al(\s\up1(2-),\s\d1(4)) 、CO eq \\al(\s\up1(2-),\s\d1(3)) 、S2-形成的化合物的溶解度如下:
由上述数据可知,选用的沉淀剂最好为( )
A.硫化物B.硫酸盐
C.碳酸盐D.以上沉淀剂均可
7.已知25℃时,Ksp(AgCl)=1.8×10-10ml2·L-2,Ksp(Ag2CrO4)=2.0×10-12ml3·L-3。下列有关说法正确的是(溶解度以ml·L-1表示)( )
A.25℃时,在c(Cl-)=c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=0.001ml·L-1的溶液中逐滴加入AgNO3溶液,首先生成Ag2CrO4黄色沉淀
B.25℃时,AgCl的溶解度小于Ag2CrO4的溶解度
C.在AgCl中加入稀K2CrO4溶液,搅拌,转化为Ag2CrO4黄色沉淀
D.25℃时,与水中相比,AgCl在AgNO3溶液中的溶解度、Ksp均要小
8.(双选)工业上常选用MnO2为原料制得MnCl2溶液,通过添加过量难溶电解质MnS,使含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,最后经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实判断,下列分析正确的是( )
A.MnS的Ksp小于CuS、PbS、CdS等硫化物的Ksp
B.除杂试剂MnS也可用FeS代替
C.MnS与Cu2+反应的离子方程式是Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)
D.整个过程中涉及的反应类型有复分解反应和氧化还原反应
[能力提升练]
9.绚丽多彩的无机颜料的应用创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.CdS在T1℃下的溶解度为aml·L-1,在T2℃下的溶解度为bml·L-1
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
10.室温下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,则下列判断错误的是( )
A.Ksp[Fe(OH)3]
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
11.下表是3种物质的溶解度(20℃),下列说法中正确的是( )
A.已知MgCO3的Ksp=6.82×10-6ml2·L-2,则所有含有MgCO3固体的溶液中,都有c(Mg2+)=c(CO eq \\al(\s\up1(2-),\s\d1(3)) ),且c(Mg2+)·c(CO eq \\al(\s\up1(2-),\s\d1(3)) )=6.82×10-6ml2·L-2
B.除去粗盐中含有的MgCl2杂质,最佳除杂试剂为Na2CO3溶液
C.将表中三种物质与水混合,加热、灼烧,最终所得固体相同
D.用石灰水处理含有Mg2+和HCO eq \\al(\s\up1(-),\s\d1(3)) 的硬水,反应的离子方程式为Mg2++2HCO eq \\al(\s\up1(-),\s\d1(3)) +Ca2++2OH-===CaCO3↓+MgCO3↓+2H2O
12.已知:25℃时,Ksp[Mg(OH)2]=5.61×10-12ml3·L-3,Ksp[MgF2]=7.42×10-11ml3·L-3。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL0.01ml·L-1氨水中的Ksp比在20mL0.01ml·L-1NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
13.(1)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中eq \f(c(CO eq \\al(\s\up1(2-),\s\d1(3)) ),c(SO eq \\al(\s\up1(2-),\s\d1(4)) ))=________(保留三位有效数字)。已知:Ksp(BaCO3)=2.6×10-9ml2·L-2,Ksp(BaSO4)=1.1×10-10ml2·L-2。
(2)已知室温下,Ksp[Mg(OH)2]=4.0×10-11ml3·L-3。在0.1ml·L-1的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是________(已知lg2=0.3)。
14.某科研小组设计出利用工业废酸(10%H2SO4溶液)来堆浸某废弃的氧化铜锌矿,提取锌、铜元素,实现废物综合利用,方案如图所示:
已知该工艺方案条件下,各离子常温下开始沉淀及完全沉淀时的pH如表所示:
请回答下列问题:
(1)加入A物质的目的是__________________________________________,物质A可使用下列物质中的________(填序号)。
A.KMnO4B.O2
C.H2O2D.Cl2
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下Ksp(CuS)________(填“>”“<”或“=”)Ksp(ZnS)。
(3)反应生成海绵铜的离子方程式:________________________________________。
(4)除铁过程中加入氨水的目的是调节溶液的pH,常温下pH应控制在________。
(5)写出NH4HCO3与Zn2+反应生成Zn2(OH)2CO3的离子方程式:________________________________________。
(6)物质B可用作生产化肥,其化学式是________________________________。
15.已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO eq \\al(\s\up1(2-),\s\d1(4)) (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。
①计算T1时Ksp(CaWO4)=________________________________。
②T1________T2(填“>”“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表:
①该反应平衡常数K的表达式为________。
②该反应的ΔH________0(填“>”“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5ml·L-1]中加入过量Ca(OH)2(s),反应达到平衡后WO eq \\al(\s\up1(2-),\s\d1(4)) 的沉淀率为60%,此时WO eq \\al(\s\up1(2-),\s\d1(4)) 的平衡浓度为________ml·L-1,实验测得的平衡常数为________(保留小数点后两位)。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,其作用是____________________________________________。
课时作业21 沉淀溶解平衡
1.解析:开始时,溶液中各离子的浓度没有必然的关系,A项错误;沉淀溶解达到平衡时,溶液中溶质的离子浓度保持不变,但不一定相等,C项错误;沉淀溶解达到平衡时,再加入该沉淀,平衡不发生移动,D项错误。
答案:B
2.解析:a、b、c三点均为曲线上的点,温度不变,则三点对应的Ksp相等,A项正确;溶液中存在沉淀溶解平衡BaSO4(s)⇌Ba2+(aq)+SO eq \\al(\s\up1(2-),\s\d1(4)) (aq),c点相当于在b点的基础上增大Ba2+浓度,则平衡逆向移动,有BaSO4固体从溶液中析出,BaSO4的溶解量减小,B项错误;BaSO4溶于水形成的饱和溶液中,c(Ba2+)=c(SO eq \\al(\s\up1(2-),\s\d1(4)) ),C项正确;b点的溶液中加入BaCl2固体,溶液中c(Ba2+)增大,则c(SO eq \\al(\s\up1(2-),\s\d1(4)) )沿曲线向c点方向变化,D项错误。
答案:AC
3.解析:Ksp(AgCl)=1.8×10-10ml2·L-2,Ksp(AgI)=8.3×10-17ml2·L-2,Ksp(AgBr)=5.0×10-13ml2·L-2,AgCl、AgI、AgBr三种化合物的类型相同,c平(Ag+)=eq \r(Ksp),则三种难溶盐的饱和溶液中银离子浓度:AgCl>AgBr>AgI,D项正确。
答案:D
4.解析:由X点可知,c(S2-)=10-9.2ml·L-1,c(Ag+)=10-20ml·L-1,Ksp(Ag2S)=c eq \\al(\s\up1(2),\s\d1(平)) (Ag+)×c平(S2-)=10-40ml2·L-2×10-9.2ml·L-1=10-49.2ml3·L-3,故A正确;若Z点为Ag2S的分散系,Z点位于Ag2S的沉淀溶解平衡曲线的上方,Q
5.解析:CuS比FeS难溶,除去工业废水中的Cu2+可以选用FeS作沉淀剂,A项正确;H2S是弱酸,硫离子的浓度小于0.1ml·L-1,CuS的溶度积常数Ksp为1.3×10-36ml2·L-2,所以溶液中Cu2+的浓度大于1.3×10-35ml·L-1,B项错误;CuS是不溶于酸的难溶物,所以反应CuSO4+H2S===CuS↓+H2SO4能发生,这是弱酸制备强酸的特例,C项错误;H2S与SO2反应生成硫单质和水,溶液酸性减弱,D项错误。
答案:A
6.解析:要将Pb2+沉淀,就要形成溶解度更小的物质,由题表中数据可知,PbS的溶解度最小,故选用的沉淀剂最好为硫化物。
答案:A
7.解析:25℃时,在c(Cl-)=c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=0.001ml·L-1的溶液中逐滴加入AgNO3溶液,Cl-开始沉淀时c(Ag+)=eq \f(Ksp(AgCl),c(Cl-))=eq \f(1.8×10-10ml2·L-2,0.001ml·L-1)=1.8×10-7ml·L-1,CrO eq \\al(\s\up1(2-),\s\d1(4)) 开始沉淀时c(Ag+)=eq \r(\f(Ksp(Ag2CrO4),c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )))=eq \r(\f(2.0×10-12ml3·L-3,0.001ml·L-1))≈4.47×10-5ml·L-1,所以首先生成AgCl白色沉淀,故A错误;比较AgCl与Ag2CrO4的溶解度的大小,可比较对应饱和溶液中阴离子浓度的大小,c(Cl-)=eq \r(1.8×10-10)ml·L-1≈1.34×10-5ml·L-1,c(CrO eq \\al(\s\up1(2-),\s\d1(4)) )=eq \r(3,\f(2.0×10-12,4))ml·L-1=7.9×10-5ml·L-1,所以AgCl的溶解度小于Ag2CrO4的溶解度,故B正确;2AgCl(s)+K2CrO4(aq)⇌2KCl(aq)+Ag2CrO4(s)的平衡常数K=eq \f(c eq \\al(\s\up1(2),\s\d1(平)) (Cl-),c平(CrO eq \\al(\s\up1(2-),\s\d1(4)) ))=eq \f(K eq \\al(\s\up1(2),\s\d1(sp)) (AgCl),Ksp(Ag2CrO4))=1.62×10-8ml·L-1,平衡常数很小,则在AgCl中加入稀K2CrO4溶液,搅拌,不能转化为Ag2CrO4黄色沉淀,故C错误;Ksp只受温度的影响,温度不变,Ksp不变,故D错误。
答案:B
8.解析:通过添加过量难溶电解质MnS,使含有的Cu2+、Pb2+、Cd2+等金属离子形成硫化物沉淀,属于沉淀的转化,由难溶的物质转化为更难溶的物质,所以MnS的Ksp大于CuS、PbS、CdS等硫化物的Ksp,A项错误;除杂试剂MnS如用FeS代替,会引入新的杂质,B项错误;MnS与Cu2+反应的离子方程式为Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq),C项正确;以MnO2为原料制得MnCl2溶液,Mn元素的化合价发生变化,发生了氧化还原反应,沉淀的转化属于复分解反应,D项正确。
答案:CD
9.解析:由图可知,CdS在T1℃下的Ksp=c平(Cd2+)·c平(S2-)=aml·L-1×aml·L-1=a2ml2·L-2,A项正确;m、p、n为同一温度下的CdS的沉淀溶解平衡状态,三点的Ksp相等,B项错误;向m点的溶液中加入Na2S,S2-浓度增大,但Ksp不变,则溶液组成由m沿T1℃时的沉淀溶解平衡曲线向p方向移动,C项正确;温度降低,Ksp减小,q点的饱和溶液的组成由q沿qp线向p方向移动,D项正确。
答案:B
10.解析:由b、c两点对应数据可比较出Ksp[Fe(OH)3]与Ksp[Cu(OH)2]的大小,Ksp[Fe(OH)3]=c平(Fe3+)·c eq \\al(\s\up1(3),\s\d1(平)) (OH-)=c平(Fe3+)·(10-12.7)3,Ksp[Cu(OH)2]=c平(Cu2+)·c eq \\al(\s\up1(2),\s\d1(平)) (OH-)=c平(Cu2+)·(10-9.6)2,而c平(Fe3+)=c平(Cu2+),则Ksp[Fe(OH)3]
11.解析:根据MgCO3的Ksp=6.82×10-6ml2·L-2,则c平(Mg2+)·c平(CO eq \\al(\s\up1(2-),\s\d1(3)) )=6.82×10-6ml2·L-2,若向Na2CO3溶液中加入MgCO3固体,则溶液中c平(Mg2+)
12.解析:由Ksp[Mg(OH)2]=5.61×10-12ml3·L-3、Ksp(MgF2)=7.42×10-11ml3·L-3可知,MgF2的Ksp大于Mg(OH)2的Ksp,则饱和MgF2溶液中的镁离子浓度较大,故A错误;氯化铵固体溶于水后,由于NH eq \\al(\s\up1(+),\s\d1(4)) 和氢氧根离子反应,使溶液中氢氧根离子浓度减小,促进Mg(OH)2沉淀溶解平衡正向移动,镁离子浓度增大,故B正确;Ksp只与温度有关,温度不变,Ksp不变,故C错误;Ksp[Mg(OH)2]、Ksp[MgF2]相差不多,在Mg(OH)2悬浊液中加入NaF溶液后,只要使c(Mg2+)×c2(F-)>Ksp(MgF2),能实现Mg(OH)2转化为MgF2,故D错误。
答案:B
13.解析:(1)eq \f(c(CO eq \\al(\s\up1(2-),\s\d1(3)) ),c(SO eq \\al(\s\up1(2-),\s\d1(4)) ))=eq \f(Ksp(BaCO3),Ksp(BaSO4))=eq \f(2.6×10-9ml2·L-2,1.1×10-10ml2·L-2)≈23.6。(2)c(MgCl2)=0.1ml·L-1,逐滴加入NaOH溶液,当Mg2+完全沉淀时,c(Mg2+)≤1.0×10-5ml·L-1,c平(OH-)=eq \r(\f(4.0×10-11,1.0×10-5))ml·L-1=2×10-3ml·L-1,c平(H+)=eq \f(1.0×10-14,2×10-3)ml·L-1=eq \f(1,2)×10-11ml·L-1,pH=-lgc平(H+)=-lgeq \b\lc\(\rc\)(\a\vs4\al\c1(\f(1,2)×10-11))=11.3。
答案:(1)23.6 (2)11.3
14.解析:(1)根据题表中数据可知三价铁离子易沉淀除去,所以除铁过程中加入A和氨水,要将Fe2+氧化成Fe3+,Fe3+转化为Fe(OH)3沉淀而除去,A应为氧化剂,且不引入新的杂质,应选B、C。(2)相同条件下,同一类型的电解质,Ksp越大,溶解度越大,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下Ksp(CuS)
(2)<
(3)Fe+Cu2+===Fe2++Cu
(4)3.2≤pH<6.2(或3.2~6.2)
(5)2Zn2++4HCO eq \\al(\s\up1(-),\s\d1(3)) ===Zn2(OH)2CO3↓+H2O+3CO2↑
(6)(NH4)2SO4
15.解析:(1)①T1时Ksp(CaWO4)=c平(Ca2+)·c平(WO eq \\al(\s\up1(2-),\s\d1(4)) )=1×10-5ml·L-1×1×10-5ml·L-1=1×10-10ml2·L-2,②Ca(OH)2和CaWO4的溶解度均随温度升高而减小,根据图像可知T1
WO eq \\al(\s\up1(2-),\s\d1(4)) (aq)+Ca(OH)2(s)⇌CaWO4(s)+2OH-(aq)
eq \a\vs4\al(起始浓度,(ml·L-1))0.5 0.5
eq \a\vs4\al(转化浓度,(ml·L-1))0.5×60%=0.30.6
eq \a\vs4\al(平衡浓度,(ml·L-1))0.21.1
所以K=eq \f(c eq \\al(\s\up1(2),\s\d1(平)) (OH-),c平(WO eq \\al(\s\up1(2-),\s\d1(4)) ))=eq \f(1.12,0.2)ml·L-1=6.05ml·L-1。(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,可以提高WO eq \\al(\s\up1(2-),\s\d1(4)) 的沉淀率。
答案:(1)①1×10-10ml2·L-2 ②<
(2)①K=eq \f(c eq \\al(\s\up1(2),\s\d1(平)) (OH-),c平(WO eq \\al(\s\up1(2-),\s\d1(4)) )) ②> ③0.2 6.05ml·L-1
(3)加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO eq \\al(\s\up1(2-),\s\d1(4)) 的沉淀率
化合物
PbSO4
PbCO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
物质
MgCl2
Mg(OH)2
MgCO3
溶解度(g)
74
0.00084
0.01
离子
开始沉淀时的pH
完全沉淀时的pH
Fe2+
6.34
9.7
Fe3+
1.48
3.2
Zn2+
6.2
8.0
温度/℃
25
50
90
100
K/ml·L-1
79.96
208.06
222.88
258.05
高中化学鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解课后练习题: 这是一份高中化学鲁科版 (2019)选择性必修1第3节 电能转化为化学能——电解课后练习题,共8页。
高中鲁科版 (2019)第3节 沉淀溶解平衡课后复习题: 这是一份高中鲁科版 (2019)第3节 沉淀溶解平衡课后复习题,共13页。试卷主要包含了下列说法正确的是,用0,已知物质的溶度积常数等内容,欢迎下载使用。
化学选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡习题: 这是一份化学选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡习题,共8页。试卷主要包含了解析等内容,欢迎下载使用。