

专题十二 电化学基础五年高考化学真题分类训练(2019-2023)Word版含解析
展开1. [2022浙江1月选考,2分]pH 计是一种采用原电池原理测量溶液pH 的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl 溶液,并插入Ag−AgCl 电极)和另一Ag−AgCl 电极插入待测溶液中组成电池,pH 与电池的电动势E 存在关系:pH= (E− 常数)/0.059 。下列说法正确的是( C )
A. 如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCls+e−Ags+Cl−0.1ml⋅L−1
B. 玻璃膜内外氢离子浓度的差异不会引起电动势的变化
C. 分别测定含已知pH 的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH
D. pH 计工作时,电能转化为化学能
[解析]电势低的电极为负极,负极失去电子,电极反应式为Ag−e−+Cl−AgCls ,A 项错误;pH 与H+ 浓度有关,根据pH= (E− 常数)/0.059 可知,玻璃膜内外的H+ 浓度差异会引起电动势的变化,B 项错误;通过测定含已知pH 的标准溶液的电池的E 可以得出题给公式中常数的值,然后测定含未知溶液的电池的E 就可以计算出未知溶液的pH ,C 项正确;因为pH 计利用的是原电池原理,故其工作时是化学能转化为电能,D 项错误。
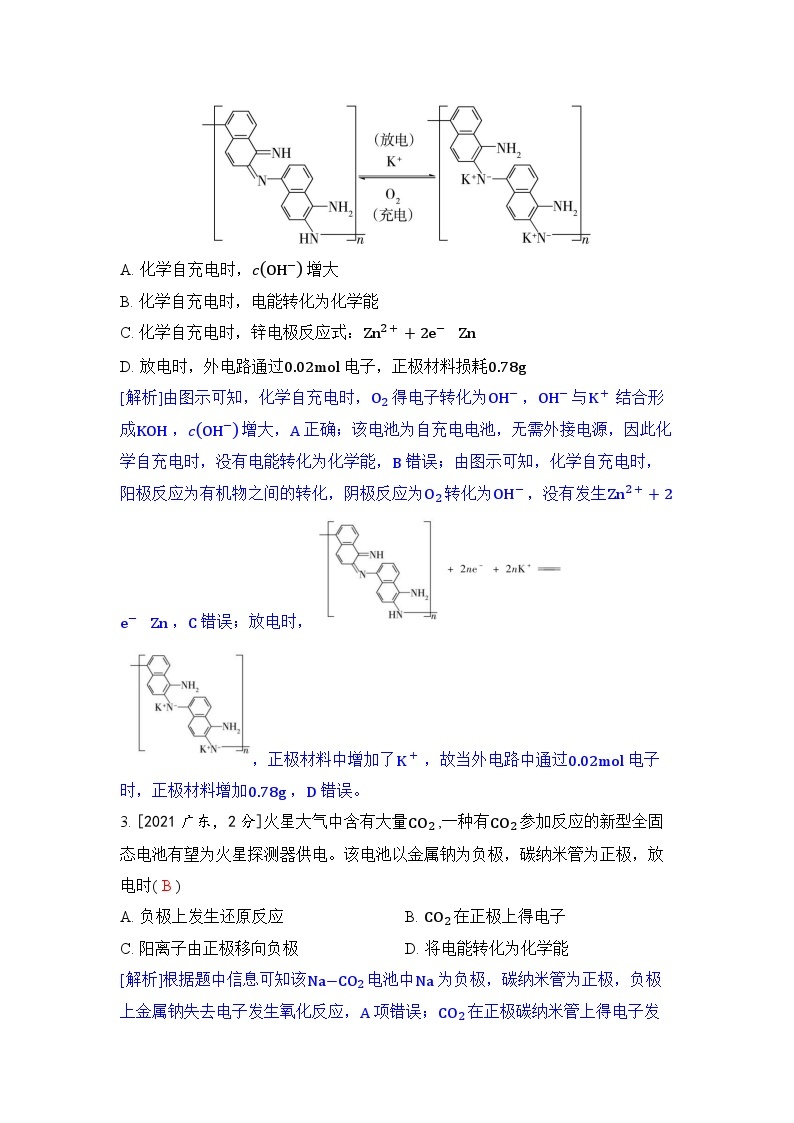
2. [2022福建,4分]一种化学“自充电”的锌-有机物电池,电解质为KOH 和ZnCH3COO2 水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如图所示。下列说法正确的是( A )
A. 化学自充电时,cOH− 增大
B. 化学自充电时,电能转化为化学能
C. 化学自充电时,锌电极反应式:Zn2++2e−Zn
D. 放电时,外电路通过0.02ml 电子,正极材料损耗0.78g
[解析]由图示可知,化学自充电时,O2 得电子转化为OH− ,OH− 与K+ 结合形成KOH ,cOH− 增大,A 正确;该电池为自充电电池,无需外接电源,因此化学自充电时,没有电能转化为化学能,B 错误;由图示可知,化学自充电时,阳极反应为有机物之间的转化,阴极反应为O2 转化为OH− ,没有发生Zn2++2e−Zn ,C 错误;放电时,,正极材料中增加了K+ ,故当外电路中通过0.02ml 电子时,正极材料增加0.78g ,D 错误。
3. [2021广东,2分]火星大气中含有大量CO2 ,一种有CO2 参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( B )
A. 负极上发生还原反应B. CO2 在正极上得电子
C. 阳离子由正极移向负极D. 将电能转化为化学能
[解析]根据题中信息可知该Na−CO2 电池中Na 为负极,碳纳米管为正极,负极上金属钠失去电子发生氧化反应,A 项错误;CO2 在正极碳纳米管上得电子发生还原反应生成单质碳,B 项正确;原电池工作时,阳离子从负极向正极移动,C 项错误;该原电池将化学能转化为电能,D 项错误。
【技巧点拨】 原电池离子移动方向:正正负负(带正电荷离子移向正极,带负电荷离子移向负极)。电解池离子移动方向:阴向阳(阴离子移向阳极),阳向阴(阳离子移向阴极)。
4. [2021山东,2分]以KOH 溶液为离子导体,分别组成CH3OH−O2 、N2H4−O2 、CH32NNH2−O2 清洁燃料电池,下列说法正确的是( C )
A. 放电过程中,K+ 均向负极移动
B. 放电过程中,KOH 物质的量均减小
C. 消耗等质量燃料,CH32NNH2−O2 燃料电池的理论放电量最大
D. 消耗1mlO2 时,理论上N2H4−O2 燃料电池气体产物的体积在标准状况下为11.2L
[解析]燃料电池工作时,阳离子向正极移动,则K+ 向正极移动,A 项错误;N2H4−O2 燃料电池的总反应为N2H4+O2N2+2H2O ,因此放电过程中,KOH 的物质的量不变,B 项错误;根据CH3OH→CO32− 失6e− ,N2H4→N2 失4e− ,CH32NNH2→2CO32−+N2 失16e− ,知消耗1g 燃料时,转移电子的物质的量分别为132×6ml 、132×4ml 、160×16ml ,显然CH32NNH2 转移电子最多,放电量最大,C 项正确;根据N2H4+O2N2+2H2O ,知消耗1mlO2 ,理论上N2H4−O2 燃料电池气体产物N2 为1ml ,其在标准状况下的体积为22.4L ,D 项错误。
5. [2020天津,3分]熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为2Na+xS⇌充电放电Na2Sx (x=5∼3 ,难溶于熔融硫)。下列说法错误的是( C )
A. Na2S4 的电子式为
B. 放电时正极反应为xS+2Na++2e−Na2Sx
C. Na 和Na2Sx 分别为电池的负极和正极
D. 该电池是以Na−β−Al2O3 为隔膜的二次电池
[解析]Na2S4 中S42− 中硫原子间以非极性键结合,每个硫原子最外层均达到8电子稳定结构,A 项正确;放电时正极上S 发生还原反应,正极反应为xS+2Na++2e−Na2Sx ,B 项正确;熔融钠为负极,熔融硫(含碳粉)为正极,C 项错误;由题图可知,D 项正确。
6. [2020山东,2分]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl 溶液模拟海水,采用惰性电极,用下图装置处理有机废水(以含CH3COO− 的溶液为例)。下列说法错误的是( B )
A. 负极反应为CH3COO−+2H2O−8e−2CO2↑+7H+
B. 隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C. 当电路中转移1ml 电子时,模拟海水理论上除盐58.5g
D. 电池工作一段时间后,正、负极产生气体的物质的量之比为2:1
[解析]根据题图分析可知,a 极为负极,电极反应为CH3COO−+2H2O−8e−2CO2↑+7H+ ,b 极为正极,电极反应为2H++2e−H2↑ ,A 项正确;该电池工作时,Cl− 向a 极移动,Na+ 向b 极移动,即隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,B 项错误;电路中转移1ml 电子时,向a 极和b 极分别移动1mlCl− 和1mlNa+ ,则模拟海水理论上可除盐58.5g ,C 项正确;电池工作时负极产生CO2 ,正极产生H2 ,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之比为2:1 ,D 项正确。
【技巧点拨】
7. [2019浙江4月选考,2分]化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( A )
A. 甲:Zn2+ 向Cu 电极方向移动,Cu 电极附近溶液中H+ 浓度增加
B. 乙:正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
[解析]铜锌原电池(电解质溶液为硫酸)中铜作正极,电极反应为2H++2e−H2↑ ,故铜电极附近H+ 浓度降低,A 项错误。
8. [2019全国卷Ⅲ,6分]为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn3D−Zn 可以高效沉积ZnO 的特点,设计了采用强碱性电解质的3D−Zn−NiOOH 二次电池,结构如图所示。电池反应为Zns+2NiOOHs+H2Ol⇌充电放电ZnOs+2NiOH2s 。
下列说法错误的是( D )
A. 三维多孔海绵状Zn 具有较高的表面积,所沉积的ZnO 分散度高
B. 充电时阳极反应为NiOH2s+OH−aq−e−NiOOHs+H2Ol
C. 放电时负极反应为Zns+2OH−aq−2e−ZnOs+H2Ol
D. 放电过程中OH− 通过隔膜从负极区移向正极区
[解析]该电池采用的三维多孔海绵状Zn 具有较大的表面积,可以高效沉积ZnO ,且所沉积的ZnO 分散度高,A 正确;根据题干中总反应可知该电池充电时,NiOH2 在阳极发生氧化反应生成NiOOH ,其电极反应式为NiOH2s+OH−aq−e−NiOOHs+H2Ol ,B 正确;放电时Zn 在负极发生氧化反应生成ZnO ,电极反应式为Zns+2OH−aq−2e−ZnOs+H2Ol ,C 正确;电池放电过程中,OH− 等阴离子通过隔膜从正极区移向负极区,D 错误。
题组二
1. [2022全国甲卷,6分]一种水性电解液Zn−MnO2 离子选择双隔膜电池如图所示[KOH 溶液中,Zn2+ 以ZnOH42− 存在]。电池放电时,下列叙述错误的是( A )
A. Ⅱ区的K+ 通过隔膜向Ⅲ区迁移
B. Ⅰ区的SO42− 通过隔膜向Ⅱ区迁移
C. MnO2 电极反应:MnO2+4H++2e−Mn2++2H2O
D. 电池总反应:Zn+4OH−+MnO2+4H+ZnOH42−+Mn2++2H2O
[解析]
MnO2 电极为正极,Zn 电极为负极,电池放电时,电解质溶液中阴离子向负极移动,阳离子向正极移动,A 项错误;Ⅰ区中的SO42− 通过隔膜向Ⅱ区迁移,B 项正确;MnO2 电极为正极,电极反应为MnO2+2e−+4H+Mn2++2H2O ,C 项正确;根据正负两极的电极反应可得电池总反应,D 项正确。
2. [2022湖南,3分]海水电池在海洋能源领域备受关注,一种锂−海水 电池构造示意图如下,下列说法错误的是( B )
A. 海水起电解质溶液作用
B. N 极仅发生的电极反应:2H2O+2e−2OH−+H2↑
C. 玻璃陶瓷具有传导离子和防水的功能
D. 该锂-海水电池属于一次电池
[解析]
Li 是活泼金属,作负极,则N 极是正极,正极上海水中溶解的O2 、CO2 等均能放电,B 项错误;由于Li 易与水反应,故玻璃陶瓷应具有良好的防水功能,同时为形成闭合回路,也应具有传导离子的功能,C 项正确;该电池属于一次电池,D 项正确。
3. [2021全国乙卷,6分]沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( D )
A. 阳极发生将海水中的Cl− 氧化生成Cl2 的反应
B. 管道中可以生成氧化灭杀附着生物的NaClO
C. 阴极生成的H2 应及时通风稀释安全地排入大气
D. 阳极表面形成的MgOH2 等积垢需要定期清理
[解析]海水中含有较大浓度的Cl− ,通电后Cl− 能在阳极上发生失电子的氧化反应生成Cl2 ,A 项正确;电解过程中阴极区有NaOH 生成,阳极上生成的Cl2 与阴极区生成的NaOH 反应可得到NaClO ,NaClO 可以灭杀附着生物,B 项正确;根据电解池分析可知阴极生成H2 ,H2 具有可燃性,故应及时排入大气,以免出现意外,C 项正确;阴极的电极反应式为2H2O+2e−2OH−+H2↑ ,生成的OH− 与海水中的Mg2+ 结合形成MgOH2 ,故MgOH2 主要在阴极上形成,D 项错误。
4. [2021河北,3分]K−O2 电池结构如图,a 和b 为两个电极,其中之一为单质钾片。关于该电池,下列说法错误的是( D )
A. 隔膜允许K+ 通过,不允许O2 通过
B. 放电时,电流由b 电极沿导线流向a 电极;充电时,b 电极为阳极
C. 产生1Ah 电量时,生成KO2 的质量与消耗O2 的质量比值约为2.22
D. 用此电池为铅酸蓄电池充电,消耗3.9g 钾时,铅酸蓄电池消耗0.9g 水
[解析]由题图右侧室内O2→KO2 可知,b 电极上发生还原反应,为正极,电极反应式为O2+e−+K+KO2 ,则a 电极为负极,K 失电子生成K+ ,且若氧气通过隔膜,会与钾反应,故隔膜只允许K+ 通过,不允许O2 通过,A 项正确;放电时电流由正极流向负极,即由b 电极沿导线流向a 电极,充电时b 电极失电子发生氧化反应,作阳极,B 项正确;由氧原子守恒可知,生成的KO2 和消耗的O2 的质量比为71:32≈2.22 ,C 项正确;铅酸蓄电池充电时的总反应为2PbSO4+2H2OPb+PbO2+2H2SO4 ,消耗1ml 水,转移1ml 电子,而K−O2 电池中,消耗 ,转移0.1ml 电子,由转移电子数相等可知,铅酸蓄电池消耗的水为0.1ml ,即消耗1.8g 水,D 项错误。
5. [2020全国卷Ⅲ,6分]一种高性能的碱性硼化钒VB2− 空气电池如图所示,其中在VB2 电极发生反应:VB2+16OH−−11e−VO43−+2BOH4−+4H2O 。该电池工作时,下列说法错误的是( B )
A. 负载通过0.04ml 电子时,有0.224L (标准状况)O2 参与反应
B. 正极区溶液的pH 降低、负极区溶液的pH 升高
C. 电池总反应为4VB2+11O2+20OH−+6H2O8BOH4−+4VO43−
D. 电流由复合碳电极经负载、VB2 电极、KOH 溶液回到复合碳电极
[解析]由题给信息知VB2 电极上发生失电子的氧化反应,则VB2 电极为负极,复合碳电极为正极,正极发生还原反应,电极反应式为O2+4e−+2H2O4OH− ,电池总反应为4VB2+11O2+20OH−+6H2O8BOH4−+4VO43− 。由上述分析知,电路中通过0.04mle− 时,正极有0.01mlO2 参加反应,其在标准状况下的体积为0.224L ,A 项正确;由正、负极的电极反应式可知,该电池工作时,负极区溶液的pH 降低,正极区溶液的pH 升高,B 项错误;由上述分析知,该电池的总反应为4VB2+11O2+20OH−+6H2O8BOH4−+4VO43− ,C 项正确;电流从正极(复合碳电极)出发,沿负载流向负极(VB2 电极),再经过溶液最终回到正极,D 项正确。
6. [2020全国卷Ⅰ,6分]科学家近年发明了一种新型Zn−CO2 水介质电池。电池示意图如下,电极为金属锌和选择性催化材料。放电时,温室气体CO2 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( D )
A. 放电时,负极反应为Zn−2e−+4OH−ZnOH42−
B. 放电时,1mlCO2 转化为HCOOH ,转移的电子数为2ml
C. 充电时,电池总反应为2ZnOH42−2Zn+O2↑+4OH−+2H2O
D. 充电时,正极溶液中OH− 浓度升高
[解析]由题给装置图可知,放电时负极锌失去电子后结合OH− 生成ZnOH42− ,负极反应为Zn−2e−+4OH−ZnOH42− ,A 项正确;放电时,正极上CO2 得电子生成HCOOH ,CO2 中C 的化合价为+4 ,HCOOH 中C 的化合价可看作+2 ,1mlCO2 转化为1mlHCOOH ,得到2ml 电子,B 项正确;充电时阴极上ZnOH42− 参与反应得到锌,阳极上H2O 参与反应得到氧气,电池总反应为2ZnOH42−2Zn+O2↑+4OH−+2H2O ,C 项正确;充电时,阳极上发生失电子的氧化反应:2H2O−4e−O2↑+4H+ ,正极溶液中氢氧根离子浓度降低,D 项错误。
【技巧点拨】 离子交换膜具有选择性。阳离子交换膜只允许阳离子通过;阴离子交换膜只允许阴离子通过;质子交换膜只允许H+ 通过;双极膜BP 是阴、阳复合膜,能解离出H+ 和OH− 。
7. [2020全国卷Ⅱ,6分]电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+ 注入到无色WO3 薄膜中,生成AgxWO3 ,器件呈现蓝色,对于该变化过程,下列叙述错误的是( C )
A. Ag 为阳极B. Ag+ 由银电极向变色层迁移
C. W 元素的化合价升高D. 总反应为WO3+xAgAgxWO3
[解析]根据题图可知,该装置为电解池,由通电时Ag+ 注入到无色WO3 薄膜中,生成AgxWO3 ,可知Ag 为该电解池的阳极,透明导电层为该电解池的阴极,结合题给信息可写出阳极和阴极的电极反应式分别为Ag−e−Ag+ 和xAg++WO3+xe−AgxWO3 。根据上述分析可知Ag 为阳极,A 项正确;电解池工作时,Ag+ 向阴极移动,即Ag+ 由银电极向变色层迁移,B 项正确;结合上述分析可知WO3 在阴极发生还原反应,即W 元素的化合价降低,C 项错误;结合阳极和阴极的电极反应式可写出总反应为WO3+xAgAgxWO3 ,D 项正确。
8. [2020浙江1月选考,2分]在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( D )
A. 电极A为阳极,发生氧化反应生成氯气
B. 离子交换膜为阳离子交换膜
C. 饱和NaCl 溶液从a 处进,NaOH 溶液从d 处出
D. OH− 迁移的数量等于导线上通过电子的数量
[解析]电极A 上产生氯气,说明电极A 上的电极反应为氯离子失去电子生成氯气,该反应是氧化反应,故电极A 为阳极,A 正确;电极B 上的电极反应为2H2O+2e−H2↑+2OH− ,为了避免氯气和生成的OH− 发生反应,需要选择阳离子交换膜,B 正确;阳极消耗氯离子,所以饱和氯化钠溶液从a 处进,电极B 为阴极,阴极区产生氢氧化钠,所以NaOH 溶液从d 处出,C 正确;电解过程中发生迁移的离子是Na+ ,不是OH− ,D 错误。
题组三
1. [2023全国甲卷,6分]用可再生能源电还原CO2 时,采用高浓度的K+ 抑制酸性电解液中的析氢反应可提高多碳产物(乙烯、乙醇等)的生成率,装置如图所示。下列说法正确的是( C )
A. 析氢反应发生在IrOx−Ti 电极上
B. Cl− 从Cu 电极迁移到IrOx−Ti 电极
C. 阴极发生的反应有:2CO2+12H++12e−C2H4+4H2O
D. 每转移1ml 电子,阳极生成11.2L 气体(标准状况)
[解析]IrOx−Ti 电极接电源正极,为阳极,发生失电子的氧化反应,故电极反应为2H2O−4e−4H++O2↑ ,A 错误;质子交换膜只允许H+ 通过,故左室H+ 从IrOx−Ti 电极向Cu 电极迁移,B 错误;Cu 电极接电源负极,为阴极,发生得电子的还原反应,根据图中物质转化关系知CO2 可发生反应2CO2+12H++12e−C2H4+4H2O ,C 正确;由A 可知每转移1ml 电子,阳极生成0.25ml 即5.6L (标准状况)O2 ,D 错误。
【技巧点拨】 电解池电极反应口诀(“丢羊找羊”): 阳极(丢羊)“还、升(剩)、失(十)、氧(羊)”;阴极(找羊)“氧(羊)、降(将)、得、还”。
2. [2022湖北,3分]含磷有机物应用广泛。电解法可实现由白磷直接制备Li[PCN2] ,过程如图所示(Me 为甲基)。下列说法正确的是( D )
A. 生成1mlLi[PCN2] ,理论上外电路需要转移2ml 电子
B. 阴极上的电极反应为P4+8CN−−4e−4[PCN2]−
C. 在电解过程中CN− 向铂电极移动
D. 电解产生的H2 中的氢元素来自于LiOH
[解析]由题图可知,石墨电极上发生反应P4+8CN−−4e−4[PCN2]− ,石墨电极作阳极,当生成1mlLi[PCN2] 时,外电路转移1ml 电子,A 、B 项错误;在电解过程中CN− 向阳极移动,即向石墨电极移动,C 项错误;由2Me3SiCN+LiOHOSiMe32+LiCN+HCN ,可知HCN 中的H 来自于LiOH ,电解过程中HCN 在铂电极上放电产生H2 ,D 项正确。
3. [2022辽宁,3分]如图,c 管为上端封口的量气管,为测定乙酸溶液浓度,量取10.00mL 待测样品加入b 容器中,接通电源,进行实验。下列说法正确的是( A )
A. 左侧电极反应:2H2O−4e−O2↑+4H+
B. 实验结束时,b 中溶液红色恰好褪去
C. 若c 中收集气体11.20mL ,则样品中乙酸浓度为0.1ml⋅L−1
D. 把盐桥换为U 形铜导线,不影响测定结果
[解析]根据题意结合图示知,通过测量b 容器中溶液变为红色时c 管内收集的气体的体积,结合各电极上转移的电子数相等可计算乙酸溶液的浓度,则右侧Pt 电极为阴极,CH3COOH 放电,左侧Pt 电极为阳极,H2O 放电。具体分析如下:
由以上分析知,A 项正确;实验结束时,b 中CH3COOH 被完全消耗生成CH3COO− ,CH3COO− 水解使溶液显碱性,故溶液为红色,B 项错误;未指明气体所处的状况,不能根据体积计算其物质的量,C 项错误;盐桥起传递离子使溶液呈电中性的作用,铜导线不能传递离子,D 项错误。
4. [2022广东,2分]以熔融盐为电解液,以含Cu 、Mg 和Si 等的铝合金废料为阳极进行电解,实现Al 的再生。该过程中( C )
A. 阴极发生的反应为Mg−2e−Mg2+ B. 阴极上Al 被氧化
C. 在电解槽底部产生含Cu 的阳极泥D. 阳极和阴极的质量变化相等
[解析]阴极得电子,发生还原反应,Al 被还原,A 、B 项错误;由金属活动性顺序可知,Mg 、Al 在阳极失电子,离子进入电解液,Cu 金属活动性弱,则阳极泥主要含Si 、Cu ,C 项正确;阴极Al3+ 得电子生成Al 单质,阳极上Mg 、Al 均失电子变成离子进入电解液中,故阳极和阴极的质量变化不相等,D 项错误。
5. [2021江苏,3分]通过下列方法可分别获得H2 和O2:① 通过电解获得NiOOH 和H2 (装置如图所示);②在90℃ 将NiOOH 与H2O 反应生成NiOH2 并获得O2 。下列说法正确的是( B )
A. 电解后KOH 溶液的物质的量浓度减小
B. 电解时阳极电极反应式:NiOH2+OH−−e−NiOOH+H2O
C. 电解的总反应方程式:2H2O通电2H2↑+O2↑
D. 电解过程中转移4ml 电子,理论上可获得22.4LO2
[解析]由题图中物质转化关系知,电解时,阴极反应式为2H2O+2e−H2↑+2OH− ,阳极反应式为NiOH2+OH−−e−NiOOH+H2O ,则电解时的总反应为2NiOH2通电2NiOOH+H2↑ ,故电解后KOH 溶液的物质的量浓度不变,A 、C 项错误,B 项正确;未指明是标准状况下,无法计算生成的O2 的体积,D 项错误。
6. [2021湖北,3分]Na2Cr2O7 的酸性水溶液随着H+ 浓度的增大会转化为CrO3 。电解法制备CrO3 的原理如图所示。下列说法错误的是( A )
A. 电解时只允许H+ 通过离子交换膜
B. 生成O2 和H2 的质量比为8:1
C. 电解一段时间后阴极区溶液OH− 的浓度增大
D. CrO3 的生成反应为:Cr2O72−+2H+2CrO3+H2O
[解析]根据左侧电极上生成O2 ,右侧电极上生成H2 ,知左侧电极为阳极,发生反应:2H2O−4e−4H++O2↑ ,右侧电极为阴极,发生反应:2H2O+2e−2OH−+H2↑ ;由题意知,左室中Na2Cr2O7 随着H+ 浓度增大转化为CrO3:Cr2O72−+2H+2CrO3+H2O ,因此阳极生成的H+ 不能通过离子交换膜。由以上分析知,电解时通过离子交换膜的是Na+ ,A 项错误;根据各电极上转移电子数相同,由阳极反应和阴极反应,知生成O2 和H2 的物质的量之比为1:2 ,则质量比为8:1 ,B 项正确;根据阴极反应,知电解一段时间后阴极区溶液OH− 的浓度增大,C 项正确;电解过程中阳极区H+ 的浓度增大,Na2Cr2O7 转化为CrO3:Cr2O72−+2H+2CrO3+H2O ,D 项正确。
7. [2021全国甲卷,6分]乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O 解离为H+ 和OH− ,并在直流电场作用下分别向两极迁移。下列说法正确的是( D )
A. KBr 在上述电化学合成过程中只起电解质的作用
B. 阳极上的反应式为
C. 制得2ml 乙醛酸,理论上外电路中迁移了1ml 电子
D. 双极膜中间层中的H+ 在外电场作用下向铅电极方向迁移
[解析]根据图示知,石墨电极一侧发生反应2Br−−2e−Br2 、OHC—CHO+Br2+H2O→HOOC—CHO+2HBr ,总反应为OHC—CHO−2e−+H2OHOOC—CHO+2H+ ,因此石墨电极为阳极,KBr 不只是起到电解质的作用,A 、B 项错误;根据阳极总反应OHC—CHO−2e−+H2OHOOC—CHO+2H+ 、阴极反应HOOC—COOH+2e−+2H+HOOC—CHO+H2O ,可得总反应式为OHC—CHO+HOOC—COOH2HOOC—CHO ,故制得2ml 乙醛酸,理论上外电路中迁移了2ml 电子,C 项错误;根据阴极(铅电极)反应,双极膜中间层中的H+ 在外电场作用下向阴极(铅电极)迁移,D 项正确。
8. [2021广东,4分]钴C 的合金材料广泛应用于航空航天、机械制造等领域。水溶液中电解制备金属钴的装置如图所示。下列说法正确的是( D )
A. 工作时,Ⅰ室和Ⅱ室溶液的pH 均增大
B. 生成1mlC ,Ⅰ室溶液质量理论上减少16g
C. 移除两交换膜后,石墨电极上发生的反应不变
D. 电解总反应:2C2++2H2O通电2C+O2↑+4H+
[解析]题图所示装置为电解池,根据外接电源可确定石墨电极为阳极,C 电极为阴极,其电极反应为:
结合阳极反应式可知电解时Ⅰ室产生H+ ,Ⅰ室中的H+ 通过阳离子交换膜进入Ⅱ室,Ⅱ室溶液的pH 降低,A 项错误;生成1mlC 时电路中转移2ml 电子,阳极产生0.5mlO2 ,且有2mlH+ 从Ⅰ室进入Ⅱ室,故生成1mlC 时,Ⅰ室溶液质量理论上减少18g ,B 项错误;若移除两交换膜,Cl− 在阳极发生反应生成Cl2 ,C 项错误;结合表格中阳极和阴极反应知,电解时的总反应为2C2++2H2O通电2C+O2↑+4H+ ,D 项正确。
【易错警示】 求电解质溶液质量的减少或增多时,切勿忽略离子(如H+ )的迁移对电解质溶液质量的影响。
9. [2020浙江7月选考,2分]电解高浓度RCOONa (羧酸钠)的NaOH 溶液,在阳极RCOO− 放电可得到R—R (烷烃)。下列说法不正确的是( A )
A. 电解总反应方程式:2RCOONa+2H2O通电R—R+2CO2↑+H2↑+2NaOH
B. RCOO− 在阳极放电,发生氧化反应
C. 阴极的电极反应:2H2O+2e−2OH−+H2↑
D. 电解CH3COONa 、CH3CH2COONa 和NaOH 混合溶液可得到乙烷、丙烷和丁烷
[解析]CO2 可与NaOH 反应,故电解后不能得到CO2 ,A 项错误;阳极发生失电子的氧化反应,B 项正确;阴极得电子,电极反应为2H2O+2e−2OH−+H2↑ ,C 项正确;根据电解RCOONa 的NaOH 溶液生成R—R 可知,电解CH3COONa 、CH3CH2COONa 和NaOH 的混合溶液,CH3— 、CH3CH2— 可结合成乙烷、丙烷、丁烷,D 项正确。
10. [2020山东,4分]采用惰性电极,以去离子水和氧气为原料通过电解法制备双氧水的装置如图所示。忽略温度变化的影响,下列说法错误的是( D )
A. 阳极反应为2H2O−4e−4H++O2↑
B. 电解一段时间后,阳极室的pH 未变
C. 电解过程中,H+ 由a 极区向b 极区迁移
D. 电解一段时间后,a 极生成的O2 与b 极反应的O2 等量
[解析]结合题图,可知a 极上产生O2 ,发生的反应为水被氧化生成O2 的反应,即a 极为阳极,b 极为阴极,则阳极的电极反应式为2H2O−4e−4H++O2↑ ,阴极的电极反应式为2H++O2+2e−H2O2 。结合上述分析可知,A 项正确;电解一段时间后,溶液中H+ 浓度未变,即阳极室的pH 未变,B 项正确;电解过程中H+ 通过质子交换膜,从a 极区向b 极区迁移,C 项正确;由阴、阳极的电极反应式,可知电解一段时间后,b 极消耗O2 的量是a 极生成O2 的量的2倍,即a 极生成的O2 与b 极反应的O2 的量不相等,D 项错误。
题组四
1. [2023湖北,3分]我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2 生成且KOH 溶液的浓度不变,电解生成氢气的速率为xml⋅h−1 。下列说法错误的是( D )
A. b 电极反应式为2H2O+2e−H2↑+2OH−
B. 离子交换膜为阴离子交换膜
C. 电解时海水中动能高的水分子可穿过PTFE 膜
D. 海水为电解池补水的速率为2xml⋅h−1
[解析]根据图示,b 电极与电源负极相连,为阴极,结合题干信息可知,阴极反应式为2H2O+2e−2OH−+H2↑ ,A 正确;该装置工作时阳极无氯气产生,则阳极反应式为4OH−−4e−2H2O+O2↑ ,又阳极KOH 溶液的浓度不变,则需要OH− 由阴极移向阳极,故离子交换膜为阴离子交换膜,B 正确;动能高的水分子可以穿过PTFE 膜,C 正确;由阴、阳极反应式可知,电解总反应式为2H2O通电2H2↑+O2↑ ,已知电解生成氢气的速率为xml⋅h−1 ,则海水为电解池补水的速率也为xml⋅h−1 ,D 错误。
2. [2023全国乙卷,6分]室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。一种室温钠-硫电池的结构如图所示。将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。 工作时,在硫电极发生反应:
12S8+e−→12S82− ,12S82−+e−→S42− ,2Na++x4S42−+21−x4e−→Na2Sx
下列叙述错误的是( A )
A. 充电时Na+ 从钠电极向硫电极迁移
B. 放电时外电路电子流动的方向是a→b
C. 放电时正极反应为:2Na++x8S8+2e−→Na2Sx
D. 炭化纤维素纸的作用是增强硫电极导电性能
[解析]
充电时,阳离子Na+ 应向阴极钠电极迁移,A 错误;放电时,Na 失去的电子经外电路流向正极,即电子流向是a→b ,B 正确;将题给硫电极发生的反应依次标号为①②③ ,由x4×①+x4×②+③ 可得正极总反应,C 正确;炭化纤维素纸具有良好的导电性,D 正确。
3. [2022海南,4分]一种采用H2Og 和N2g 为原料制备NH3g 的装置示意图如图。下列有关说法正确的是( A )
A. 在b 电极上,N2 被还原
B. 金属Ag 可作为a 电极的材料
C. 改变工作电源电压,反应速率不变
D. 电解过程中,固体氧化物电解质中O2− 不断减少
[解析]b 电极上N2 转化为NH3 ,氮元素由0价降低为−3 价,N2 被还原,b 电极为阴极,A 项正确;a 电极上O2− 转化为O2 ,为阳极,若用金属Ag 作为电极材料,则阳极反应为Ag−e−Ag+ ,B 项错误;改变工作电源电压,反应速率发生改变,C 项错误;电解总反应为2N2+6H2O通电4NH3+3O2 ,固体氧化物电解质不参与总反应,因此电解质中O2− 不变,D 项错误。
4. [2022重庆,3分]硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是( C )
A. 惰性电极2为阳极
B. 反应前后WO42−/WO52− 数量不变
C. 消耗1ml 氧气,可得到1ml 硝酮
D. 外电路通过1ml 电子,可得到1ml 水
[解析]阳极区反应为2Br−−2e−Br2 、;阴极区反应为O2+2e−+2H+H2O2 、H2O2+WO42−H2O+WO52− ,;制备硝酮的总反应为。惰性电极2上Br− 转化为Br2 ,发生氧化反应,为阳极,A 项正确;由总反应可知,反应前后WO42−/WO52− 数量不变,B 项正确;根据总反应知,消耗1ml 氧气,可得到2ml 硝酮,C 项错误;根据阴极区反应知,外电路通过1ml 电子,可得到1ml 水,D 项正确。
5. [2022辽宁,3分]某储能电池原理如图。下列说法正确的是( A )
A. 放电时负极反应:Na3Ti2PO43−2e−NaTi2PO43+2Na+
B. 放电时Cl− 透过多孔活性炭电极向CCl4 中迁移
C. 放电时每转移1ml 电子,理论上CCl4 吸收0.5mlCl2
D. 充电过程中,NaCl 溶液浓度增大
[解析]
由上述分析可知,A 项正确;放电时,阴离子移向负极,所以Cl− 透过多孔活性炭电极向NaCl/H2O 中迁移,B 项错误;结合电极反应可知,放电时每转移1ml 电子,理论上消耗0.5mlCl2 ,C 项错误;充电过程中阳极消耗氯离子,阴极消耗钠离子,NaCl 溶液浓度减小,D 项错误。
6. [2022全国乙卷,6分]Li−O2 电池比能量高,在汽车、航天等领域具有良好应用前景。近年来,科学家研究了一种光照充电Li−O2 电池(如图所示)。光照时,光催化电极产生电子e− 和空穴h+ ,驱动阴极反应Li++e−Li 和阳极反应Li2O2+2h+2Li++O2 对电池进行充电。下列叙述错误的是( C )
A. 充电时,电池的总反应Li2O22Li+O2
B. 充电效率与光照产生的电子和空穴量有关
C. 放电时,Li+ 从正极穿过离子交换膜向负极迁移
D. 放电时,正极发生反应O2+2Li++2e−Li2O2
[解析]由题图可知该装置为二次电池,放电时O2→Li2O2 ,Li→Li+ ;充电时Li2O2→O2 ,Li+→Li ,由此写出的电极反应式如下:
充电时为电解池,由题目信息知,光照时,光催化电极产生电子e− 和空穴h+ ,电子通过外电路转移到锂电极发生反应Li++e−Li ,光催化电极上发生反应Li2O2+2h+2Li++O2 ,总反应为Li2O22Li+O2 ,因此充电效率与光照产生的电子和空穴量有关,A 、B 项正确;放电时,阳离子移向正极,因此放电时,Li+ 从负极穿过离子交换膜向正极迁移,C 项错误;放电时,正极发生还原反应,其电极反应式为O2+2e−+2Li+Li2O2 ,D 项正确。
7. [2021浙江1月选考,2分]镍镉电池是二次电池,其工作原理示意图如下(L 为小灯泡,K1 、K2 为开关,a 、b 为直流电源的两极)。下列说法不正确的是( C )
A. 断开K2 、合上K1 ,镍镉电池能量转化形式:化学能→ 电能
B. 断开K1 、合上K2 ,电极A为阴极,发生还原反应
C. 电极B发生氧化反应过程中,溶液中KOH 浓度不变
D. 镍镉二次电池的总反应式:Cd+2NiOOH+2H2O⇌充电放电CdOH2+2NiOH2
[解析]断开K2 、合上K1 ,装置为原电池,能量转化形式为化学能转化为电能,A 正确;断开K1 、合上K2 ,装置为电解池,电极A 为阴极,发生还原反应,B 正确;电极B 发生氧化反应过程中,处于充电状态,装置为电解池,溶液中KOH 浓度减小,C 不正确;由题图可知,电池总反应方程式正确,D 正确。
【技巧点拨】 可充电电池(二次电池)的工作原理
8. [2019天津理综,6分]我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如图。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是( D )
A. 放电时,a 电极反应为I2Br−+2e−2I−+Br−
B. 放电时,溶液中离子的数目增大
C. 充电时,b 电极每增重0.65g ,溶液中有0.02mlI− 被氧化
D. 充电时,a 电极接外电源负极
[解析]根据电池的工作原理示意图,可知放电时a 电极上I2Br− 转化为Br− 和I− ,电极反应为I2Br−+2e−2I−+Br− ,A 项正确;放电时正极区I2Br− 转化为Br− 和I− ,负极区Zn 转化为Zn2+ ,溶液中离子的数目增大,B 项正确;充电时b 电极发生反应Zn2++2e−Zn ,b 电极增重0.65g 时,转移0.02mle− ,a 电极发生反应2I−+Br−−2e−I2Br− ,根据各电极上转移电子数相同,则有0.02mlI− 被氧化,C 项正确;放电时a 电极为正极,充电时a 电极为阳极,接外电源正极,D 项错误。
题组五
1. [2023新课标卷,6分]一种以V2O5 和Zn 为电极、ZnCF3SO32 水溶液为电解质的电池,其示意图如下所示。放电时,Zn2+ 可插入V2O5 层间形成ZnxV2O5⋅nH2O 。下列说法错误的是( C )
A. 放电时V2O5 为正极
B. 放电时Zn2+ 由负极向正极迁移
C. 充电总反应:xZn+V2O5+nH2OZnxV2O5⋅nH2O
D. 充电阳极反应:ZnxV2O5⋅nH2O−2xe−xZn2++V2O5+nH2O
[解析]
放电时Zn 失去电子生成Zn2+ ,Zn 为负极,则V2O5 为正极,A 正确;放电时,阳离子Zn2+ 移向正极,B 正确;由上述分析可知,放电总反应为xZn+V2O5+nH2OZnxV2O5⋅nH2O ,充电总反应为ZnxV2O5⋅nH2OxZn+V2O5+nH2O ,C 错误;由上述分析可知,D 正确。
2. [2023辽宁,3分]某无隔膜流动海水电解法制H2 的装置如图所示,其中高选择性催化剂PRT 可抑制O2 产生。下列说法正确的是( D )
A. b 端电势高于a 端电势
B. 理论上转移2mle− 生成4gH2
C. 电解后海水pH 下降
D. 阳极发生:Cl−+H2O−2e−HClO+H+
[解析]钛网上发生氧化反应,为阳极,则电源a 端为正极,电源b 端为负极,a 端电势高于b 端电势,A 项错误;理论上每转移2mle− ,生成1mlH2 ,质量为2g ,B 项错误;电解总反应为Cl−+H2OClO−+H2↑ ,电解后ClO− 水解使溶液呈碱性,海水pH 上升,C 项错误;阳极上Cl− 放电转化为HClO ,电极反应为Cl−+H2O−2e−HClO+H+ ,D 项正确。
3. [2022广东,4分]为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( D )
A. 加入AgNO3 溶液产生沉淀
B. 加入淀粉碘化钾溶液无蓝色出现
C. 加入KSCN 溶液无红色出现
D. 加入K3[FeCN6] 溶液无蓝色沉淀生成
[解析]若铁片被腐蚀,则溶液中含有Fe2+ ,在溶液中加入K3[FeCN6] 溶液,反应生成蓝色的KFe[FeCN6] 沉淀,D 项正确;A 项只能检验溶液中含有Cl− ,B 项只能检验溶液中无强氧化性物质,C 项只能检验溶液中无Fe3+ ,三者均不能说明铁片没有被腐蚀。
4. [2022广东,4分]科学家基于Cl2 易溶于CCl4 的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a 的反应为:
NaTi2PO43+2Na++2e−Na3Ti2PO43
下列说法正确的是( C )
A. 充电时电极b 是阴极
B. 放电时NaCl 溶液的pH 减小
C. 放电时NaCl 溶液的浓度增大
D. 每生成1mlCl2 ,电极a 质量理论上增加23g
[解析]由充电时电极a 的反应式可知,电极a 发生还原反应,则充电时电极a 为阴极,电极b 为阳极,A 项错误;放电时,负极Na3Ti2PO43 转化为Na+ ,正极Cl2 发生还原反应生成Cl− ,NaCl 溶液的浓度增大,但溶液一直为中性,故放电时NaCl 溶液的pH 不变,B 项错误、C 项正确;充电时,每生成1mlCl2 ,则转移2ml 电子,由题干电极a 反应式可知,有2mlNa+ 参与反应,则电极a 质量理论上增加46g ,D 项错误。
5. [2021天津,3分]如下所示电解装置中,通电后石墨电极Ⅱ上有O2 生成,Fe2O3 逐渐溶解,下列判断错误的是( C )
A. a 是电源的负极
B. 通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色
C. 随着电解的进行,CuCl2 溶液浓度变大
D. 当0.01mlFe2O3 完全溶解时,至少产生气体336mL (折合成标准状况下)
[解析]根据题图,结合题意知,石墨电极Ⅱ上H2O 发生氧化反应产生O2 ,故石墨电极Ⅱ是阳极,则b 是电源的正极、a 是电源的负极,A 项正确;石墨电极Ⅱ上H2O 放电产生O2 和H+:2H2O−4e−4H++O2↑ ,通电一段时间后,石墨电极Ⅱ附近溶液显酸性,能使石蕊显红色,B 项正确;电解时,Cu2+ 在石墨电极Ⅰ上放电生成Cu ,左室中Cl− 通过阴离子交换膜进入中间室,故CuCl2 溶液的浓度减小,C 项错误;由Fe2O3+6H+2Fe3++3H2O 和阳极反应式可得Fe2O3∼32O2 ,故产生O2 的体积(折合成标准状况下)是32×0.01ml×22.4L⋅ml−1×103mL⋅L−1=336mL ,D 项正确。
6. [2021辽宁,3分]如图,某液态金属储能电池放电时产生金属间化合物Li3Bi 。下列说法正确的是( B )
A. 放电时,M 电极反应为Ni−2e−Ni2+
B. 放电时,Li+ 由M 电极向N 电极移动
C. 充电时,M 电极的质量减小
D. 充电时,N 电极反应为Li3Bi+3e−3Li++Bi
[解析]结合该电池放电时产生金属间化合物Li3Bi ,可知M 极为负极,N 极为正极,电极反应分析如下。
结合上述分析可知,A 项错误;原电池中阳离子从负极向正极方向移动,即Li+ 由M 电极向N 电极移动,B 项正确;充电时M 电极为阴极,电极反应为3Li++3e−3Li ,电极质量将增加,C 项错误;充电时N 电极为阳极,电极反应为Li3Bi−3e−3Li++Bi ,D 项错误。
7. [2021海南,4分]液氨中存在平衡:2NH3⇌NH4++NH2− 。如图所示为电解池装置,以KNH2 的液氨溶液为电解液,电解过程中a 、b 两个惰性电极上都有气泡产生。下列有关说法正确的是( B )
A. b 电极连接的是电源的负极
B. a 电极的反应为2NH3+2e−H2↑+2NH2−
C. 电解过程中,阴极附近K+ 浓度减小
D. 理论上两极产生的气体物质的量之比为1:1
[解析]由题图可知,b 电极上NH2− 失电子发生氧化反应生成N2 和NH3 ,故b 电极为阳极,连接电源的正极,A 项错误;a 电极为阴极,由题图可知,NH3 在阴极发生还原反应,电极反应为2NH3+2e−2NH2−+H2↑ ,B 项正确;电解过程中,阳离子向阴极迁移,即钾离子移向阴极,阴极附近K+ 浓度增大,C 项错误;b 电极反应为6NH2−−6e−4NH3+N2↑ ,根据得失电子守恒知,电解一段时间后,a 电极生成的H2 和b 电极生成的N2 的物质的量之比为3:1 ,D 项错误。
8. [2021福建,4分]催化剂TAPP−Mn (Ⅱ)的应用,使Li−CO2 电池的研究取得了新的进展。Li−CO2 电池结构和该催化剂作用下正极反应可能的历程如图所示。
下列说法错误的是( D )
A. Li−CO2 电池可使用有机电解液
B. 充电时,Li+ 由正极向负极迁移
C. 放电时,正极反应为3CO2+4Li++4e−2Li2CO3+C
D. ∗LiCO2 、∗CO 、∗LiC2O3 和C都是正极反应的中间产物
[解析]Li 为碱金属单质,能与水反应,因此Li−CO2 电池可使用有机电解液,A 项正确;充电时Li+ 由阳极(正极)向阴极(负极)移动,B 项正确;由正极反应可能的历程知,放电时正极上CO2 发生还原反应,电极反应为3CO2+4Li++4e−2Li2CO3+C ,C 项正确;根据图示,∗LiCO2 、∗CO 、∗LiC2O3 是正极反应的中间产物,C 是正极反应的最终产物,D 项错误。
9. [2020江苏,4分]将金属M 连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是( C )
A. 阴极的电极反应式为Fe−2e−Fe2+
B. 金属M 的活动性比Fe 的活动性弱
C. 钢铁设施表面因积累大量电子而被保护
D. 钢铁设施在河水中的腐蚀速率比在海水中的快
[解析]根据图示可知金属M 失电子,为原电池的负极(图示为阳极),钢铁设施为原电池的正极(图示为阴极),此方法属于牺牲阳极的阴极保护法。该装置中阴极发生还原反应,A 项错误;金属M 被氧化,即金属活动性:M>Fe ,B 项错误;钢铁设施为原电池的正极,表面积累大量电子而被保护,C 项正确;海水中含有大量的NaCl 等电解质,而河水中电解质较少,故钢铁设施在河水中的腐蚀速率比在海水中的慢,D 项错误。
10. [2019江苏,2分]将铁粉和活性炭的混合物用NaCl 溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( C )
A. 铁被氧化的电极反应式为Fe−3e−Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl 溶液,铁不能发生吸氧腐蚀
[解析]A 项,铁、炭混合物用NaCl 溶液湿润后构成原电池,铁作负极,铁失去电子生成Fe2+ ,电极反应式为Fe−2e−Fe2+ ,错误;B 项,铁腐蚀过程中化学能除了转化为电能外,还可转化为热能等,错误;C 项,构成原电池后,铁腐蚀的速率变快,正确;D 项,用水代替NaCl 溶液,Fe 和炭也可以构成原电池,Fe 失去电子,空气中的O2 得到电子,铁发生吸氧腐蚀,错误。
【方法技巧】 有关金属腐蚀的“三个方面”
(1)金属腐蚀包括化学腐蚀和电化学腐蚀,以电化学腐蚀为主。电化学腐蚀又包括析氢腐蚀和吸氧腐蚀,若金属处于酸性环境,则发生析氢腐蚀;若金属处于碱性、中性或弱酸性环境,则发生吸氧腐蚀。
(2)一般来说,金属腐蚀快慢与影响因素有一定的关系:①在氧气浓度大的环境中,金属腐蚀较快;②在电解质浓度大的环境中,金属腐蚀较快;③在温度高的环境中,金属腐蚀较快;④电解池的阳极腐蚀速率> 原电池的负极腐蚀速率> 化学腐蚀速率> 原电池的正极腐蚀速率> 电解池的阴极腐蚀速率。
(3)金属防护的常用方法:①在金属表面覆盖保护层,如涂油、刷油漆或电镀等;②改变金属内部结构,如制成不锈钢;③电化学保护,如牺牲阳极的阴极保护法或外加电流的阴极保护法等;④烤蓝等。电极
电极反应
阳极
石墨
2H2O−4e−O2↑+4H+
阴极
C 电极
C2++2e−C
电极
电极反应式
电解池
阳极(光催化电极)
Li2O2+2h+2Li++O2
阴极(金属锂)
Li++e−Li
原电池
正极(光催化电极)
O2+2e−+2Li+Li2O2
负极(金属锂)
Li−e−Li+
电极
电极反应式
负极(M 极)
3Li−3e−3Li+
正极(N 极)
3Li++Bi+3e−Li3Bi
专题三 离子反应五年高考化学真题分类训练(2019-2023)Word版含解析: 这是一份专题三 离子反应五年高考化学真题分类训练(2019-2023)Word版含解析,共12页。
专题二 化学中常用计量五年高考化学真题分类训练(2019-2023)Word版含解析: 这是一份专题二 化学中常用计量五年高考化学真题分类训练(2019-2023)Word版含解析,共6页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
专题一 物质的组成、性质与分类五年高考化学真题分类训练(2019-2023)Word版含解析: 这是一份专题一 物质的组成、性质与分类五年高考化学真题分类训练(2019-2023)Word版含解析,共11页。












