
第14讲 氯及其化合物(含解析)-2024年江苏省普通高中学业水平合格性考试复习
展开一、氯气
1.物理性质
色,有 气味的气体,密度 空气,有 ,易 。在加压条件下,氯气转化为液态(称为 ),用 瓶保存和运输。
2.化学性质
(1)与金属反应
①与钠反应: 。
②与铁反应: 。
③与铜反应: 。
(2)与非金属(氢气)反应: 。
(3)与化合物反应
①与水反应: (写化学方程式)。
(写离子方程式)。
②制漂白液的反应: 。
③制漂白粉的反应: 。
(4)与NaBr、KI、FeCl2溶液反应
①与NaBr溶液反应: 。
②与KI溶液反应: 。
③与FeCl2溶液反应: 。
(5)漂白原理
①干燥的Cl2 漂白性,湿润的Cl2 漂白性。原因是
。
②漂白粉的漂白原理是 (用化学方程式表示)。
漂白粉的失效原因是 。
(6)毒性:Cl2为有毒气体。
3.氯气的制备
(1)工业制法: (该法称为 工业)。
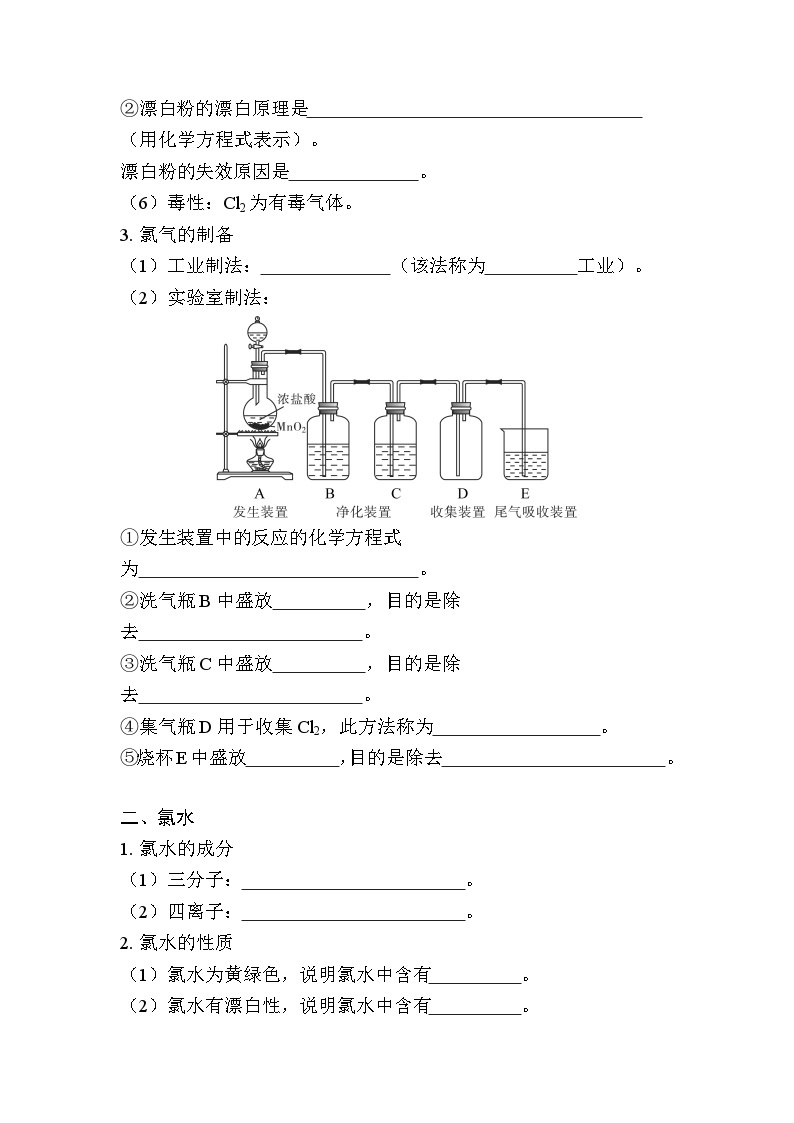
(2)实验室制法:
①发生装置中的反应的化学方程式为 。
②洗气瓶B中盛放 ,目的是除去 。
③洗气瓶C中盛放 ,目的是除去 。
④集气瓶D用于收集Cl2,此方法称为 。
⑤烧杯E中盛放 ,目的是除去 。
二、氯水
1.氯水的成分
(1)三分子: 。
(2)四离子: 。
2.氯水的性质
(1)氯水为黄绿色,说明氯水中含有 。
(2)氯水有漂白性,说明氯水中含有 。
(3)氯水有酸性,说明氯水中含有 。
三、次氯酸
1.次氯酸有 性,能杀菌消毒,具有 作用。
2.次氯酸是一种很弱的酸,酸性比碳酸 。
3.次氯酸不稳定,见光会分解,化学方程式为 。
四、氯离子的检验
向待测液中加入 ,若有 ,则说明含有Cl-。
【激活思维】
问题1:向含有酚酞的NaOH溶液中滴加氯水,红色褪去的原因是什么?
问题2:Cl2中含有的HCl和H2O杂质,能否用碱石灰一次性吸收?
@真题回放
考点1:氯气的性质
【真题1】 (2015·江苏学测)下列关于Cl2性质的说法正确的是( )
A.密度比空气小 B.是无色无味的气体
C.能使干燥的有色布条褪色 D.可与NaOH溶液反应
考点2:氯气的净化处理
【真题2】 (2016·江苏学测)判断:用NaOH溶液除去Cl2中混有的少量HCl。( )
考点3:氯水成分的探究
【真题3】 (2020·江苏合格考样题)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
考点4:含氯消毒剂的应用
【真题4】 (2021·江苏合格考真题)含氯消毒剂在卫生防疫方面起着重要的作用。常见的含氯消毒剂有漂白粉[有效成分为Ca(ClO)2]、“84”消毒液[有效成分为NaClO]等。
(1)漂白粉和“84”消毒液具有杀菌消毒功能,主要是因为两者均含有 (填离子符号)。
(2)以下实验能鉴别Ca(ClO)2溶液和NaClO溶液的是 (填字母)。
a.焰色试验 b.加入Na2CO3溶液 c.加入NaCl稀溶液
(3)①将“84”消毒液与洁厕剂(含有盐酸)混合,反应生成气体 (填化学式),能使人中毒。
②“84”消毒液与H2O2溶液混合会发生反应,减弱杀菌消毒功能。该反应生成三种常见物质,其中一种是O2,写出反应的化学方程式: 。
@过关检测
1.(2023·沛县合格考模拟)下列实验室收集氯气的装置正确的是( )
A
B
C
D
2.(2023·如皋合格考模拟)下列关于新制氯水的说法正确的是( )
A.为无色液体 B.属于纯净物
C.光照下稳定 D.具有酸性和漂白性
3.(2023·沛县合格考模拟)对于反应MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,下列说法正确的是( )
A.MnO2是还原剂 B.MnO2被还原
C.HCl中Cl得到电子 D.HCl发生还原反应
4.(2023·南京六校合格考模拟)下列有关氯气及氯水的说法正确的是( )
A.常温常压下,氯气密度小于空气 B.Cl2为共价化合物
C.可用pH试纸测量氯水的pH D.氯气为黄绿色有刺激性气味气体
5.(2023·连云港合格考模拟)下列说法正确的是( )
A.氯气液化为液氯是化学变化
B.液氯是纯净物,氯水为混合物
C.漂白粉的有效成分是Ca(ClO)2和CaCl2
D.氯气能与碱溶液发生反应,说明氯气显酸性
6.(2022·姜堰合格考模拟)下列生活中的物质与其有效成分的化学式、用途的对应关系中,错误的是( )
7.(2022·徐州合格考模拟)下列关于Cl2的制备、净化、收集及尾气处理的装置和原理能达到实验目的的是( )
甲 乙 丙 丁
A.用装置甲制取氯气 B.用装置乙除氯化氢C.用装置丙收集氯气D.用装置丁吸收尾气
8.(2022·徐州合格考模拟)下列物质的制备能够成功的是( )
A.石灰乳和氯气制备漂白粉 B.MnO2和稀盐酸反应制备氯气
C.用AlCl3与过量NaOH溶液制备Al(OH)3 D.电解饱和食盐水制备金属钠
9.(2020·海安合格考模拟)关于新制饱和氯水,下列说法正确的是( )
A.新制饱和氯水呈浅黄绿色,说明氯气溶于水但不与水反应
B.新制氯水中滴加几滴紫色石蕊溶液,溶液变红色且不褪色
C.向新制饱和氯水中通入SO2,溶液变为无色,是因为SO2将氯水漂白
D.新制氯水在光照时,溶液中会释放出氧气,同时溶液酸性增强
10.(2019·无锡合格考模拟)下列物质与指定物质的主要成分对应正确的是( )
A.赤铁矿——Fe2O3 B.漂白粉——NaClO
C.纯碱——NaOH D.大理石——Ca(OH)2
11.(2019·扬州合格考模拟)下列物质均可用于漂白,漂白原理不同于其他的是( )
A.次氯酸钙 B.次氯酸钠 C.氯水 D.二氧化硫
12.(2019·无锡合格考模拟)实验室用下图所示装置来制取少量氯气,下列说法正确的是( )
A.A容器中加入的是稀盐酸
B.C瓶的作用是收集氯气
C.F中加入NaOH溶液吸收多余的氯气
D.用该装置制取氯气前无需检查装置的气密性
13.(2019·扬州合格考模拟)在实验室用下列装置制取氯气并验证氯气的某些化学性质,其中能达到实验目的的是( )
A.用装置甲制取氯气 B.用装置乙除去氯气中的HCl
C.用装置丙收集一试管氯气 D.用装置丁验证氯气能支持H2燃烧
第14讲 氯及其化合物
【考点填空】
一、1.黄绿 刺激性 大于 毒 液化 液氯 钢
2.(1)①2Na+Cl22NaCl
②2Fe+3Cl22FeCl3
③Cu+Cl2CuCl2
(2)H2+Cl22HCl
(3)①Cl2+H2OHCl+HClO
Cl2+H2OH++Cl-+HClO
②Cl2+2NaOHNaCl+NaClO+H2O
③2Cl2+2Ca(OH)2CaCl2+Ca(ClO)2+2H2O
(4)①2NaBr+Cl22NaCl+Br2
②2KI+Cl22KCl+I2
③2FeCl2+Cl22FeCl3
(5)①无 有 氯气与水反应生成了具有漂白性的HClO
②Ca(ClO)2+CO2+H2OCaCO3↓+2HClO
漂白粉与空气中的水和CO2反应生成HClO,HClO见光分解,而失去漂白性
3.(1)2NaCl+2H2O2NaOH+H2↑+Cl2↑ 氯碱
(2)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②饱和食盐水 Cl2中混有的HCl
③浓H2SO4 Cl2中混有的水蒸气
④向上排空气法
⑤NaOH溶液 有毒Cl2,防止污染环境
二、1.(1)Cl2、HClO、H2O
(2)H+、Cl-、ClO-、少量OH-
2.(1)Cl2 (2)HClO (3)H+
三、1.强氧化 漂白
2.弱
3.2HClO2HCl+O2↑
四、稀硝酸酸化的硝酸银溶液 白色沉淀生成
问题1:含有酚酞的NaOH溶液为红色,滴加氯水后,溶液红色褪去,原因有二:一是氯水中含有具有漂白性的HClO,漂白酚酞所致;二是氯水中含有H+,与NaOH中和而使酚酞褪色。
问题2:不能。因为Cl2为酸性气体,也可以被碱石灰吸收。故先用饱和食盐水吸收HCl,再用浓硫酸吸收H2O。
【真题回放】
1.D 解析:A项,Cl2的相对分子质量比空气的平均相对分子质量大,所以Cl2的密度比空气大,错误;B项,Cl2是黄绿色的有刺激性气味的气体,错误;C项,Cl2与干燥有色布条不会产生有漂白性的HClO,所以有色布条不会褪色,错误;D项,Cl2是酸性气体,可以与NaOH反应生成NaClO和NaCl,正确。
2.错 解析:Cl2和HCl均可以被NaOH溶液吸收,错误。
3.D 解析:A项,Cl2为黄绿色,正确;B项,Cl-与Ag+反应生成AgCl沉淀,正确;C项,H+与NaHCO3反应生成CO2气体,正确;D项,Cl2也能将Fe2+氧化成Fe3+,错误。
4.(1)ClO- (2)ab (3)①Cl2
②NaClO+H2O2O2↑+NaCl+H2O
解析:(1)Ca(ClO)2、NaClO均含有ClO-。(2)Ca(ClO)2和NaClO中金属元素Ca、Na不同,故可以通过焰色试验鉴别,a正确;Na2CO3溶液与Ca(ClO)2反应可生成CaCO3沉淀,Na2CO3溶液与NaClO不反应,故可以通过Na2CO3溶液鉴别两者,b正确。(3)①NaClO与HCl反应生成有毒的Cl2,化学方程式为NaClO+2HClNaCl+Cl2↑+H2O。②NaClO与H2O2反应生成O2,H2O2中O由-1价升至0价,则反应中应有元素的化合价降低,显然为NaClO中Cl元素,NaClO中Cl为+1价,降为-1价,则为NaCl,再由H、O元素守恒,确定第三种产物为H2O,根据Cl、O得失电子守恒配平反应方程式。
【过关检测】
1.D 解析:Cl2能溶于水,故不能用排水法收集,A项错误;Cl2的密度比空气大,所以应从长管进气将空气排出,排除B项、C项;D中收集到Cl2,同时用NaOH溶液可以吸收多余的Cl2,D项正确。
2.D 解析:A项,新制氯水为黄绿色,错误;B项,氯水中含有Cl2、H2O和HClO分子等,为混合物,错误;C项,HClO见光会分解,错误;D项,HClO具有漂白性,氯水中含有H+,具有酸性,正确。
3.B 解析:A项,MnO2转化为MnCl2,Mn由+4价降为+2价,MnO2作氧化剂,错误;B项,氧化剂被还原,发生还原反应,正确;C项,HCl转化为Cl2,Cl的化合价升高,Cl失去电子,错误;D项,HCl作还原剂,发生氧化反应,错误。
4.D 解析:A项,Cl2的相对分子质量比空气的平均相对分子质量大,则Cl2的密度比空气大,错误;B项,Cl2为单质,错误;C项,氯水中含有HClO,可以漂白指示剂,故不可以用pH试纸测氯水的pH,错误;D项,Cl2为黄绿色、有刺激性气味的气体,正确。
5.B 解析:A项,Cl2液化是指Cl2由气态转化为液态,属于物理变化,错误;B项,液氯的成分为Cl2,为纯净物,氯水为氯气的水溶液,含有Cl2、H2O和HClO,为混合物,正确;C项,漂白粉的有效成分是Ca(ClO)2,主要成分为Ca(ClO)2和CaCl2,错误;D项,酸性是指电离出H+,而Cl2不能电离出H+,所以Cl2不显酸性,错误。
6.D 解析:D项,漂白粉的有效成分为Ca(ClO)2,错误。
7.D 解析:A项,缺少加热装置,错误;B项,Cl2、HCl均可以与NaOH反应,错误;C项,Cl2的密度比空气大,应用向上排空气法收集,错误;D项,Cl2可以被NaOH溶液吸收,正确。
8.A 解析:A项,Cl2与石灰乳反应生成CaCl2和Ca(ClO)2,正确;B项,MnO2可以氧化浓HCl生成Cl2,错误;C项,过量的NaOH会将Al(OH)3溶解,错误;D项,电解熔融的NaCl得到Na,错误。
9.D 解析:A项,Cl2与H2O反应生成HCl和HClO,错误;B项,HClO具有漂白性,可以使石蕊褪色,错误;C项,SO2与Cl2发生氧化还原反应,SO2表现为还原性,而不是漂白性,错误;D项,HClO见光分解生成HCl和O2,正确。
10.A 解析:漂白粉为CaCl2和Ca(ClO)2的混合物;纯碱为Na2CO3;大理石的主要成分为CaCO3。
11.D 解析:次氯酸钙、次氯酸钠、氯水的漂白原理均基于其强氧化性。SO2的漂白原理是基于其化合性。
12.C 解析:A项,实验室制备Cl2时应用浓盐酸,错误;B项,用饱和食盐水除去HCl,用浓硫酸干燥氯气,用E来收集Cl2,错误;C项,用F中的NaOH溶液吸收多余的Cl2,正确;D项,制备任何气体前,均需要检查装置的气密性,错误。
13.D 解析:A项,缺少加热装置,错误;B项,Cl2和HCl均可以被NaOH溶液吸收,错误;C项,Cl2的密度比空气大,应用向上排空气法收集,错误;D项,H2在Cl2中可以安静地燃烧,有苍白色火焰,正确。
选项
A
B
C
D
生活中的物质
食盐
“84”消毒液
复方氢氧化铝片
漂白粉
有效成分的化学式
NaCl
NaClO
Al(OH)3
CaCl2
用途
作调味品
作消毒剂
作抗酸药
作杀菌剂
第6讲 离子共存(含解析)-2024年江苏省普通高中学业水平合格性考试复习: 这是一份第6讲 离子共存(含解析)-2024年江苏省普通高中学业水平合格性考试复习,共8页。试卷主要包含了复分解反应,发生氧化还原反应,生成配合物等内容,欢迎下载使用。
第2讲 分散系(含解析)-2024年江苏省普通高中学业水平合格性考试复习: 这是一份第2讲 分散系(含解析)-2024年江苏省普通高中学业水平合格性考试复习,共5页。试卷主要包含了胶体的应用等内容,欢迎下载使用。
第32讲 乙醇 乙酸(含解析)-2024年江苏省普通高中学业水平合格性考试复习: 这是一份第32讲 乙醇 乙酸(含解析)-2024年江苏省普通高中学业水平合格性考试复习,共11页。试卷主要包含了乙醇,乙酸等内容,欢迎下载使用。