




【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第三章 水溶液中的离子反应与平衡 试卷.zip
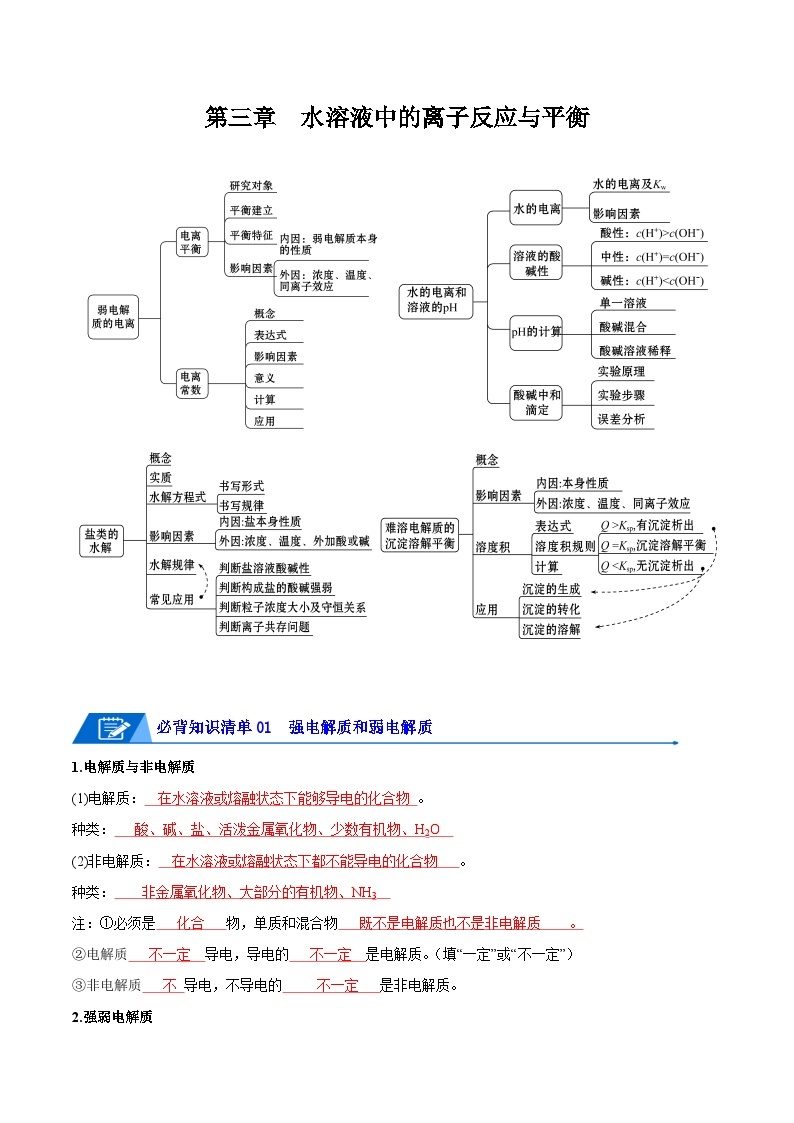
展开第三章 水溶液中的离子反应与平衡
必背知识清单01 强电解质和弱电解质
1.电解质与非电解质
(1)电解质:____________________________________________________。
种类:____________________________________________________
(2)非电解质:____________________________________________________。
种类:_______________________________________
注:①必须是_____________物,单质和混合物_______________________________________。
②电解质_____________导电,导电的_____________是电解质。(填“一定”或“不一定”)
③非电解质_____________导电,不导电的_____________是非电解质。
2.强弱电解质
(1)强电解质:①定义:在水溶液中能够_____________电离的电解质。
②特点:___________电离,只有___________,无___________,不可逆,电离方程式用“_________”连接
③类别:强酸:_______________________________________
强碱:__________________________
大部分盐(包括难溶盐)、活泼金属氧化物
(2)弱电解质:①定义:在水溶液中能够_____________电离的电解质。
②特点:_____________电离,既有_____________又有_____________,可逆,存在_____________,电离方程式用“ ”连接
③类别:_____________
注:①电解质的强弱与_____________无关,与溶液的_____________无必然联系
②电解质的导电性与溶液中自由移动的_____________有关,自由移动的离子浓度越大,离子所带电荷数越多,导电性_____________
(3)强电解质与弱电解质的比较
强电解质
弱电解质
概念
在水溶液中能_____________电离的电解质
在水溶液中只能_____________电离的电解质
电解质在溶液中的存在形式
只有_____________
既有___________,又有电解质___________
化合物类型
离子化合物、部分共价化合物
共价化合物
实例
①多数盐(包括难溶性盐);
②强酸,如HCl、H2SO4等;
③强碱,如KOH、Ba(OH)2等
①弱酸,如CH3COOH、HClO等;
②弱碱,如NH3·H2O等;
③水
3.电离方程式的书写
(1)原则:遵循__________________________
(2)书写: 多元弱酸_____________电离,以第_____________步电离为主,_____________书写;
多元弱碱_____________电离,_____________书写
(3)常见物质电离方程式的书写:
①NaCl:__________________________
②CH3COONH4:__________________________
③Na2CO3:__________________________
④NaHCO3:__________________________
⑤NaHSO4:在水溶液中:__________________________
在熔融状态下:__________________________
⑥CH3COONa:_______________________________________
⑦NaHS:____________________________________________________
⑧KHSO3:____________________________________________________
⑨NH4Cl:____________________________________________________
⑩CaCO3:____________________________________________________
(11)AgCl:____________________________________________________
(12)BaSO4:____________________________________________________
(13)HCl:____________________________________________________
(14)HNO3:____________________________________________________
(15)H2SO4:____________________________________________________
(16)HBr:____________________________________________________
(17)HI:____________________________________________________
(18)HClO4:____________________________________________________
(19)NaOH:____________________________________________________
(20)KOH:____________________________________________________
(21)Ba(OH)2:____________________________________________________
(22)CH3COOH:____________________________________________________
(23)HF:____________________________________________________
(24)HClO:____________________________________________________
(25)H2CO3:____________________________________________________
(26)H2SO3:____________________________________________________
(27)H2S:____________________________________________________
(28)H2C2O4:____________________________________________________
(29)H3PO4:_________________________________________________________________
(30)NH3·H2O:____________________________________________________
(31)Cu(OH)2:____________________________________________________
(32)Mg(OH)2:____________________________________________________
(33)Fe(OH)3:_______________________________________
(34)Al(OH)3: 碱式电离:____________________________________________________
酸式电离:_______________________________________
(35)H2O:___________________________________或______________________________________
必背知识清单02 弱电解质的电离平衡
1.电离平衡状态
(1)概念:在一定条件(如温度、浓度)下,弱电解质分子_______________________________________与_______________________________________相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程
(3)电离平衡的特征
2.电离平衡的影响因素
(1)温度:弱电解质的电离一般是_____________过程,升高温度使电离平衡向_____________的方向移动,电离程度_____________。
(2)浓度:在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率_____________,电离程度_____________。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度_____________。
(4)化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向_____________方向移动。
举例:以醋酸电离为例:CH3COOH(aq) CH3COO-(aq)+H+(aq) ΔH>0
改变条件
平衡移动方向
电离程度
n(H+)
c(H+)
c(CH3COO-)
导电能力
加水稀释
正向
_____________
增大
减小
减小
减弱
加入少量冰醋酸
正向
_____________
增大
增大
增大
增强
通入HCl(g)
逆向
_____________
增大
增大
减小
增强
加入NaOH(s)
正向
_____________
减小
减小
增大
增强
加入镁粉
正向
_____________
减小
减小
增大
增强
升高温度
正向
_____________
增大
增大
增大
增强
加入CH3COONa(s)
逆向
_____________
减小
减小
增大
增强
加入NaCl(s)
不移动
_____________
不变
不变
不变
增强
3.电离平衡常数
(1)定义:在一定条件下,达到电离平衡时,__________________________与__________________________比是一个常数,这个常数称为电离平衡常数,简称电离常数。一般弱酸用_____________表示,弱碱用_____________表示
(2)表达式:以ABA++B-为例,则_____________
注:在计算电离平衡常数时,弱电解质分子的浓度,常用_____________浓度代替_____________浓度进行忽略计算
(3)影响因素:
①__________________________
②只受_____________影响,升高温度,电离平衡常数_____________,电离程度_____________
(4)意义:相同条件下,K值越大,表示该弱电解质越_____________电离,所对应溶液的酸性或碱性越_____________
(5)说明:
多元弱酸是分步电离的,每一步都有相应的K,对于同一种弱酸的K1、K2、K3,总有K1_____________K2_____________K3,即电离程度逐渐_____________。这是因为上一级电离产生的H+,对下一级电离起到_____________作用。所以计算多元弱酸溶液的c(H+)或比较弱酸酸性相对强弱时,通常只考虑第_____________步电离
4.电离度
(1)定义:弱电解质在溶液中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数(包括已电离和未电离)的百分率,称为电离度。
(2)表达式:电离度通常用ɑ表示。
(3)意义:电离度实质上表示的是弱电解质达到电离平衡时的转化率,即表示弱电解质在水中的电离程度。
特别提示:
①温度相同,浓度相同时,不同弱电解质的电离度不同。若不同的一元弱酸的电离度越大,表示其酸性相对越强。
②同一弱电解质的浓度不同,电离度也不同,溶液越稀,电离度越大。
必背知识清单03 水的电离
1.水的电离
(1)电离方程式:__________________________或__________________________
(2)特点:①_____________电离
②_____________过程,_____________热
③25℃,水中的c(H+)=c(OH-)=_____________mol/L
④由水电离出的H+与OH-浓度_____________,即c(H+)水_____________c(OH-)水
(3)影响因素:
促进:____________________________________________________
抑制:____________________________________________________
水的电离H2OH++OH- ΔH>0
条件变化
移动方向
c(H+)
c(OH-)
Kw
程度
影响
升高温度
右移
增大
增大
增大
________
促进
加酸
左移
增大
减小
不变
________
抑制
加碱
左移
减小
增大
不变
________
抑制
加活泼金属如Na
右移
减小
增大
不变
________
促进
2.水的离子积
(1)定义:当水的电离达到平衡时,电离产物_____________和_____________浓度之积是一个常数,称为水的离子积常数,简称水的离子积,用_____________表示。
(2)表达式:Kw=_____________
说明:①Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液
酸溶液中:Kw= _____________
碱溶液中:Kw=_____________
盐溶液中:Kw= _____________
②不同溶液中的c(H+)、c(OH-)可能 _____________同,但任何溶液中的c(H+)水_____________c(OH-)水
③25℃时,水中的c(H+)=c(OH-)=_____________mol/L,Kw=_____________
100℃时,水中的c(H+)=c(OH-)≈_____________mol/L,Kw=_____________
④Kw只与_____________有关,温度升高,Kw_____________,水更_____________电离
必背知识清单04 溶液的酸碱性与pH
1.溶液的酸碱性
(1)讨论探究(常温下,利用平衡移动原理分析完成下表):
体系
c(H+)变化
c(OH-)变化
c(H+)与c(OH-)的关系
纯水
c(H+) __________c(OH-)
纯水中加入少量盐酸
_____________
_____________
c(H+) _________c(OH-)
纯水中加入少量氢氧化钠溶液
_____________
_____________
c(H+) _________c(OH-)
(2)结论:在任意溶液中,
c(H+) _________c(OH-),溶液呈中性;
c(H+) _________c(OH-),溶液呈酸性,c(H+)越大,酸性越强;
c(H+) _________c(OH-),溶液呈碱性,c(OH-)越大,碱性越强。
2.溶液的pH
(1)c(H+)、pH与溶液酸碱性的关系。
25 ℃时,溶液中c(H+)、pH与酸碱性的关系如图所示:
溶液
性质
c(H+)与c(OH-)
c(H+)/(mol·L-1)
pH(25 ℃)
任意温度
25 ℃
中性
c(H+)=c(OH-)
c(H+)=
c(H+)=1×10-7
pH=7
酸性
c(H+)>c(OH-)
c(H+)>
c(H+)>1×10-7
pH<7
碱性
c(H+)<c(OH-)
c(H+)<
c(H+)<1×10-7
pH>7
(2)pH
→
→
→
(3)溶液酸碱性的测量。
①pH试纸:
广泛pH试纸:可以识别pH差值约为1;
精密pH试纸:可以精确到小数点后一位。
使用方法:取一小片pH试纸放在干燥、洁净的玻璃片(或表面皿)上,用__________________蘸取待测液滴在试纸的中部,试纸变色后,立即与__________________对照比色,读出数值,确定溶液的pH。
【注意】pH试纸使用前不能润湿,会造成对待测液的稀释;广泛pH试纸读数只能是整数。
②pH计:
pH计精确度高,可直接从仪器中读数。
(4)pH的应用。
应用领域
实例
人体健康
人体的各种体液都有一定的pH,当酸碱平衡失调时,人体就表现出病变,因而可以利用检测血液中的pH诊断疾病
生活应用
利用护发素保护头发,就是通过调节头发的pH使之达到适宜的酸碱度
环保领域
酸性或碱性的废水,可以利用中和反应调节pH
农业生产
土壤的pH影响植物对养分的吸收及养分的有效性,各种作物的生长也都对土壤的pH范围有一定的要求,因而应注意保持土壤的酸碱性
科学实验
工业生产
溶液的pH控制常常是影响实验结果或产品质量、产量的一个关键因素
必背知识清单05 pH的计算
溶液pH的计算思路
(1)强酸与弱碱或强碱与弱酸等体积混合
弱过量,显弱性
当pH酸+pH碱=14时,若是强酸与弱碱混合,则弱碱过量,pH_________ 7
若是强碱与弱酸混合,则弱酸过量,pH_________7
(2)稀释后溶液pH的计算
①强酸:pH=a,加水稀释10n倍,则pH= _________
但都不突破7,无限稀释时等于或接近于7
②弱酸:pH=a,加水稀释10n倍,则_________
④弱碱:pH=b,加水稀释10n倍,则_________
必背知识清单06 酸碱中和滴定
一.酸碱中和滴定的原理与主要仪器
1.原理:
(1)含义:酸碱中和滴定是依据_________反应,用_________________________来测定__________________的方法。
(2)原理:
中和反应中酸提供的H+与碱提供的OH-的物质的量相等。即c(H+)·V酸=c(OH-)·V碱
c(H+)=或c(OH-)=。
2.主要仪器及使用:
(1)仪器
(2)滴定管的结构及使用方法
项目
具体结构或操作
构造
“0”刻度线在上方,尖嘴部分无刻度
精确度
读数可以读到_________mL
检漏
检查滴定管活塞是否漏水
润洗
加入反应液之前,滴定管要用所要盛装的溶液润洗2~3次
装液
将反应液加入相应的滴定管中,使液面位于“0”刻度线以上2~3 mL
排气泡
滴定前排出尖嘴处的气泡
调液面
调节活塞,使液面处于“0”刻度或“0”刻度以下的某刻度,并记录读取数值
【注意】
滴定管的“0”刻度在最上面,越往下数值越大,因为下端有一部分没有刻度,所以滴定管的实际容积大于它的标定容积。滴定管读数时要精确到0.01mL。注意量筒与滴定管的区别。
二.酸碱中和滴定操作
1.实验操作:
以标准盐酸滴定待测NaOH溶液为例:
(1)滴定前的准备
①滴定管:查漏→洗涤→润洗→装液→排气泡→调液面→记录。
②锥形瓶:注碱液→记体积→加指示剂。
(2)滴定
边滴边振荡→滴速先_________后_________→左手控制_________, 且结束前不能离开,右手_________,眼睛注视_________内溶液变化→判定终点→读数(等1-2min液面稳定后)
(3)终点判断
滴定终点:___________________________
注:恰好中和_________酸碱恰好完全反应_________溶液呈中性
判断终点的方法:等到滴入最后_________滴标准液,指示剂变色,且在_________内不恢复原来的颜色,视为滴定终点。
(4)数据处理
按上述操作重复_________次,求出用去标准盐酸体积的平均值,根据c(NaOH)=__________________计算。
2.常用酸碱指示剂及变色范围:
①强酸滴弱碱用_________,强碱滴弱酸用_________,强酸强碱互滴,__________________
②变色情况:
滴定种类
选用的指示剂
滴定终点颜色变化
指示剂用量
强酸滴定强碱
酚酞
粉红色→无色
2~3滴
甲基橙
黄色→橙色
强酸滴定弱碱
甲基橙
黄色→橙色
强碱滴定强酸
甲基橙
红色→橙色
酚酞
无色→粉红色
强碱定弱酸
酚酞
无色→粉红色
3.酸碱滴定曲线:
以滴加__________________为横坐标,以溶液_________为纵坐标绘出一条溶液pH随酸(或碱)的滴加量而变化的曲线。如图所示为用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HCl溶液过程中的pH变化曲线。
由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,有利于确定滴定终点。
4.常见误差:(用NaOH标准液在滴定未知浓度的盐酸)
步骤
操作
c(浓度)
洗涤
未用标准溶液润洗滴定管
_________
锥形瓶用待测溶液润洗
_________
未用待测溶液润洗取用待测液的滴定管(或移液管)
_________
锥形瓶洗净后瓶内还残留有蒸馏水
_________
滴定
快达滴定终点时滴定速度过快,停止滴定后,反加一滴待测液颜色无变化
_________
滴定前盛装标准液的滴定管尖嘴部分有气泡,滴定后气泡消失
_________
盛装待测液的滴定管尖嘴部分有气泡,滴定后气泡消失
_________
滴定过程中振荡时,锥形瓶内有液滴溅出
_________
滴定时有几滴标准溶液附在锥形瓶壁上或滴在锥形瓶外
_________
滴定结束时,滴定管尖端挂一液滴未滴下
_________
读数
滴定完毕,未等滴定管内壁的液体完全流下就开始读数
_________
滴定完毕立即读数,半分钟内颜色又复原
_________
滴定前仰视读数或滴定后俯视读数,过早估计终点
_________
滴定前俯视读数或滴定后仰视读数,过晚估计终点
_________
配制标准液产生的误差
若配制NaOH溶液,所取的NaOH固体部分潮解
_________
若配制NaOH溶液,所取的NaOH固体中含有不与酸反应的杂质
_________
若配制NaOH溶液,所取的NaOH固体中含有与酸反应的杂质(Na2CO3)
_________
若配制NaOH溶液,所取的NaOH固体中含有与酸反应的杂质(Na2O)
_________
必背知识清单07 盐类的水解
1.盐类的水解
(1)定义:______________________________________________________,叫做盐类的水解
(2)表示为:___________________________
(3)特点:①极其微弱,为_________反应,存在__________________状态
②是_________的逆反应,水解反应是_________热反应
(4)规律:________________________________________________________________________
注:①组成盐的酸越弱,水解程度_________。
②同浓度的正盐比其酸式盐水解程度_________ 。
③弱酸酸式盐的酸碱性,看电离与水解程度大的大小。
HCO3-、HPO42-、HS- 以_________为主→显_________性
HSO3-、H2PO4- 以_________为主→显_________性
(5)盐类水解方程式的书写
一般原则:①必须写“_________”符号(填“可逆符号”或“不可逆符号”)
②对于气体和沉淀的箭头,在方程式中_________(填“写”或“不写”)
③H2CO3、H2SO3等_________拆开(填“不要”或“要”)
④多元弱酸阴离子_________水解,_________书写,以第_________步为主;多元弱碱阳离子水解方程式 _________步写完
⑤遵守___________________________
书写模式: 盐的离子+ H2O弱酸(或弱碱)+OH-(或H+)
2.常见水解方程式的书写
CH3COONa:CH3COO—+ H2OCH3COOH+OH-
NaF:F—+ H2OHF+OH-
NaClO:ClO—+ H2OHClO +OH-
Na2CO3:CO32—+ H2OHCO3— +OH- HCO3—+ H2O H2CO3 +OH-
Na2SO3:SO32—+ H2OHSO3— +OH- HSO3—+ H2O H2SO3 +OH-
Na2C2O4:C2O42—+ H2OHC2O4— +OH- HC2O4—+ H2O H2C2O4 +OH-
K2S:S2—+ H2OHS— +OH- HS—+ H2O H2S +OH-
Na3PO4:PO43—+ H2O HPO42—+OH- ;HPO42—+ H2O H2PO4— +OH-;
H2PO4—+ H2O H3PO4 +OH-
NaHCO3:HCO3—+ H2O H2CO3 +OH-
NaHSO3:HSO3—+ H2O H2SO3 +OH-
KHS:HS—+ H2O H2S +OH-
NaHC2O4:HC2O4—+ H2O H2C2O4 +OH-
NaH2PO4:H2PO4—+ H2O H3PO4 +OH-
Na2HPO4:HPO42—+ H2O H2PO4— +OH-;H2PO4—+ H2O H3PO4 +OH-
NH4Cl:NH4++ H2ONH3•H2O+H+
FeCl3:Fe3++ 3H2OFe(OH)3+3H+
Al(NO)3:Al 3++ 3H2OAl(OH)3+3H+
MgCl2:Mg2++ 2H2OMg(OH)2+2H+
CuSO4:Cu2++ 2H2OCu(OH)2+2H+
CH3COONH4的双水解:CH3COONH4 +H2O CH3COOH+ NH3•H2O
AlO2-和Al3+的双水解:3AlO2-+ Al3++H2O=4Al(OH)3↓
HCO3-和Al3+的双水解:3HCO3-+ Al3+=Al(OH)3↓+3CO2↑
必背知识清单08 影响盐类水解平衡的因素
1.内因:组成盐的酸或碱越弱,其盐就越易水解,如水解程度:Na2CO3_________Na2SO3,Na2CO3_________NaHCO3。
2.外因
3.举例:以CH3COONa溶液为例分析外因对盐类水解平衡的影响情况:
CH3COO-+ H2O CH3COOH+OH-
c(CH3COO-)
c(CH3COOH)
c(OH-)
c(H+)
pH
水解程度
加热
减小
增大
增大
减小
增大
_________
加水
减小
减小
减小
增大
减小
_________
加CH3COOH
增大
增大
减小
增大
减小
_________
加CH3COONa
增大
增大
增大
减小
增大
_________
加HCl
减小
增大
减小
增大
减小
_________
加NaOH
增大
减小
增大
减小
增大
_________
必背知识清单09 水解常数
1.概念
在一定温度下,能水解的盐(强碱弱酸盐、强酸弱碱盐或弱酸弱碱盐)在水溶液中达到水解平衡时,__________________________________________________________________________________________,该常数叫作水解常数。
2.水解常数(Kh)与电离常数的定量关系(以CH3COONa为例)
CH3COONa溶液中存在如下水解平衡:
CH3COO-+H2OCH3COOH+OH-
Kh=
=
==(Ka为CH3COOH的电离常数)
因而Ka(或Kb)与Kw的定量关系为Ka·Kh=Kw(或Kb·Kh=Kw)。
如Na2CO3的水解常数Kh=;
NaHCO3的水解常数Kh=。
NH4Cl的水解常数Kh=(Kb为NH3·H2O的电离常数)。
3.水解常数是描述能水解的盐水解平衡的主要参数。水解常数只受_________的影响;因水解反应是吸热反应,故水解常数随温度的升高而_________。
必背知识清单10 盐类水解的应用
应用
举例
加热促进水解
热的纯碱溶液去污力强
分析盐溶液的酸碱性,并比较酸碱性的强弱
等物质的量浓度的Na2CO3、NaHCO3 溶液均显碱性,且碱性:Na2CO3>NaHCO3
判断溶液中离子能否大量共存
Al3+和HCO因发生相互促进的水解反应而不能大量共存
配制或贮存易水解的盐溶液
配制FeCl3溶液,要向FeCl3溶液中加入适量盐酸
胶体的制备,作净水剂
明矾溶于水生成胶状物氢氧化铝,能吸附水中悬浮的杂质,并形成沉淀使水澄清
化肥的使用
铵态氮肥不宜与草木灰混合使用
泡沫灭火器的反应原理(水解互促)
Al3++3HCO===Al(OH)3↓+3CO2↑
无水盐的制备
由MgCl2·6H2O制MgCl2,在干燥的HCl气流中加热
判断盐溶液的蒸干产物
将AlCl3溶液蒸干灼烧得到的是Al2O3而不是AlCl3
某些盐的分离除杂
为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgO或MgCO3或Mg(OH)2,过滤后再加入适量的盐酸
盐溶液除锈
NH4Cl溶液除去金属表面的氧化物(NH水解溶液显酸性)
判断电解质的强弱
CH3COONa溶液能使酚酞变红(pH>7),说明CH3COOH是弱酸
必背知识清单11 难溶电解质的沉淀溶解平衡
1.常温下,物质溶解性与溶解度的关系
溶解性
易溶
可溶
微溶
难溶
溶解度
>10g
1-10g
0.01-1g
<0.01g
2.难溶电解质
定义:溶解度小于_________g的电解质称为难溶电解质
3.难溶电解质的溶解平衡
(1)定义:在一定温度下,当沉淀和溶解的速率_________时,形成溶质的_________溶液,各离子的浓度保持_________,达到平衡状态,这种平衡称为沉淀溶解平衡。
(2)特点:___________________________
注:生成沉淀的离子反应不能进行到底(即离子浓度≠0),一般情况下,当溶液中剩余离子的浓度小于_________mol/L时,化学上通常认为生成沉淀的反应就进行完全了
(3)影响因素
内因:____________________________________
外因:①浓度:加水,平衡向_________方向移动
②温度:升温,多数平衡向_________方向移动(原因:溶解_________热);但少数向_________方向移动(例: Ca(OH)2 )
③加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向_________的方向移动
(4)溶度积常数(简称溶度积)——_________
①表达式:对于溶解平衡:MmAn(s)mMn+(aq)+nAm-(aq) 反应, Ksp=__________________
例:AgCl(s)Ag+(aq)+Cl-(aq) Ksp=__________________
②意义:对于同类型(_________个数相同)的难溶电解质,在相同温度下,Ksp越大→S(溶解度)越_________
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15 说明S(AgCl) _________S(AgBr)
③影响因素:KSP只与__________________和__________________有关
④应用:判断有无沉淀生成
Q(离子积)= [c(Mn+)]m·[c(Am-)]n(任意时刻的浓度)
Q>KSP时,__________________
Q=KSP时,__________________
Q
(1)生成沉淀方法:
①调节pH法。
加入氨水调节溶液的pH至7~8,可除去氯化铵中的杂质氯化铁。反应离子方程式:
____________________________________。
②加沉淀剂法。
加入的
沉淀剂
与Cu2+反应的离子方程式
与Hg2+反应的离子方程式
Na2S
__________________
__________________
H2S
__________________
__________________
(2)化学沉淀法废水处理工艺流程:
(3)沉淀的溶解
对于在水中难溶的电解质,如果不断_________平衡体系中的相应离子,使平衡向_________的方向进行,从而使沉淀溶解。
例如CaCO3溶于盐酸的过程:
分析:CO2气体逸出,_________不断减小,离子积Q(CaCO3) _________Ksp(CaCO3),导致平衡向__________________的方向移动。
溶解的离子方程式:___________________________。
(4)沉淀的转化
①实验探究:
Ag+沉淀转化的实验探究。
实验
步骤
实验现象
A中产生_________,B中变为_________,C中变为_________
离子方
程式
试管A:___________________________
试管B:___________________________
试管C:___________________________
实验分析
Ksp(AgCl) _________Ksp(AgI) _________Ksp(Ag2S)
Mg(OH)2与Fe(OH)3转化的实验探究。
实验
步骤
实验现象
①中产生_________,②中变为_________
离子方
程式
试管①:___________________________,
试管②:___________________________
实验分析
Ksp[Mg(OH)2] _________Ksp[Fe(OH)3]
②沉淀转化的实质:
沉淀转化的实质就是___________________________。一般说来,溶解度小的沉淀易转化为溶解度更小的沉淀。溶解度差别_________,转化越容易。
③沉淀转化的应用:
锅炉除水垢。
水垢中CaSO4(s)CaCO3(s)Ca2+(aq)
有关化学方程式:______________________________________________________。
自然界中矿物的转化。
如原生铜硫化物CuSO4(溶液)CuS(铜蓝)
有关化学方程式:______________________________________________________。
【疑难归纳】
一、一元强酸和一元弱酸的比较
(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项
目酸
c(H+)
酸性
中和碱的能力
与足量活泼金属反应产生H2的总量
与同一金属反应时的起始反应速率
一元强酸
大
强
相同
相同
大
一元弱酸
小
弱
小
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目
酸
c(H+)
酸性
中和碱的能力
与足量活泼金属反应产生H2的总量
与同一金属反应时的起始反应速率
一元强酸
相同
相同
小
少
相同
一元弱酸
大
多
二、理解Kw应注意的几个问题:
(1)Kw揭示了在任何水溶液中均存在水的电离平衡,H+和OH-共存,只是相对含量不同而已。
(2)Kw只与温度有关。因为水的电离是吸热过程,所以温度升高,有利于水的电离,Kw增大,如100 ℃,Kw=5.5×10-13。但是在室温下,Kw为1.0×10-14。
(3)Kw不仅适用于纯水,还适用于酸、碱的稀溶液,且由水电离的c水(H+)=c水(OH-)。此时,水溶液中水的离子积常数不变。
三、判断溶液酸碱性的标准
(1)判定溶液酸碱性的依据是c(H+)与c(OH-)的相对大小,如果c(H+)>c(OH-),溶液显酸性;如果c(H+)
(3)用酸碱指示剂判断溶液酸碱性时,要注意指示剂的变色范围。
四、酸(或碱)溶液稀释后pH的计算及大小比较
【问题探究】
对于pH=a的强酸和弱酸溶液,均稀释到原溶液体积的10n倍(a+n<7),试写出稀释后溶液的pH或范围。
稀释到原溶液体积的10n倍,强酸溶液的pH就增大n个单位,即稀释后强酸溶液的pH=a+n,弱酸溶液的pH范围:a<pH<a+n。
【知识归纳总结】
酸碱溶液稀释时pH的变化可用数轴表示。
①强酸、弱酸溶液的稀释:
②强碱、弱碱溶液的稀释:
③变化趋势:
对于pH相同的强酸和弱酸(或强碱和弱碱)溶液稀释相同的倍数,强酸(或强碱)溶液的pH变化幅度大(如下图所示)。这是因为强酸(或强碱)已完全电离,随着加水稀释,溶液中H+(或OH-)物质的量(水电离的除外)不会增多,而弱酸(或弱碱)随着加水稀释,电离程度增大,H+(或OH-)物质的量会不断增多。
五、盐类水解的再理解
1.盐类水解的实质:
盐电离→→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
2.盐类水解的特点:
→水解反应是可逆反应
→水解反应是酸碱中和反应的逆反应
→水解反应程度很微弱
3.盐类水解的规律:
(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。如:碳酸的酸性大于次氯酸,则相同浓度的NaHCO3溶液的水解程度小于NaClO溶液。
(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。如:碳酸的电离常数Ka1小于NH3·H2O的电离常数Kb,故NH4HCO3溶液显碱性。
(5)“同强显中性”——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液显中性。如Kb(NH3·H2O)=Ka(CH3COOH),故CH3COONH4溶液显中性。
4.盐类水解程度大小比较规律
(1)组成盐的弱碱阳离子水解使溶液显酸性,组成盐的弱酸根离子水解使溶液显碱性。
(2)盐对应的酸(或碱)越弱,水解程度越大,溶液碱性(或酸性)越强。
(3)多元弱酸的酸根离子比酸式酸根离子的水解程度大得多。如相同浓度时,CO比HCO的水解程度大。
(4)水解程度:相互促进水解的盐>单水解的盐>相互抑制水解的盐。
如NH的水解程度:(NH4)2CO3>(NH4)2SO4>(NH4)2Fe(SO4)2。
六、溶液中的离子浓度比较
1.判断粒子浓度关系的三个守恒规律:
规律
内容
实例(Na2CO3和NaHCO3)
物料
守恒
在电解质溶液中,由于某些离子能够水解,粒子种类增多,但这些粒子所含某些原子的总数始终不变
Na2CO3:c(Na+)=2[c(HCO)+c(CO)+c(H2CO3)]
NaHCO3:c(Na+)=c(HCO)+c(CO)+c(H2CO3)
电荷
守恒
在电解质溶液中,阳离子的电荷总数与阴离子的电荷总数相等,即溶液呈电中性
Na2CO3:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO)
NaHCO3:c(Na+)+c(H+)=c(HCO)+c(OH-)+2c(CO)
质子
守恒
电解质溶液中,分子(或离子)得失质子(H+)的物质的量应相等
Na2CO3:c(OH-)=c(H+)+c(HCO)+2c(H2CO3)
NaHCO3:c(OH-)=c(H+)-c(CO)+c(H2CO3)
2.溶液中离子浓度的大小比较:
(1)不同溶液中同一离子浓度的比较。
要看溶液中其他离子对其影响。
例如:在相同物质的量浓度的下列溶液中:a.NH4Cl、b.CH3COONH4、c.NH4HSO4,c(NH)由大到小的顺序:c>a>b。
(2)同一溶液中不同离子浓度的大小比较。
(3)混合溶液中各离子浓度的比较。
根据电离程度、水解程度的相对大小分析。
①分子的电离大于相应离子的水解:
例如:等物质的量浓度的NH4Cl与NH3·H2O混合溶液中,c(NH)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)。
②分子的电离小于相应离子的水解:
例如:在0.1 mol·L-1的NaCN和0.1 mol·L-1的HCN溶液的混合液中,各离子浓度的大小顺序为c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)。
(4)抓“四点”,突破酸碱中和滴定曲线中的粒子浓度关系:
①抓反应“一半”点,判断是什么溶质的等量混合。
②抓“恰好”反应点,生成的溶质是什么,判断溶液的酸碱性。
③抓溶液的“中性”点,生成什么溶质,哪种物质过量或不足。
④抓反应的“过量”点,溶液中的溶质是什么,判断哪种物质过量。
实例分析:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示:
(注:a点为反应一半点,b点呈中性,c点恰好完全反应,d点NaOH过量一倍)
分析:
a点,溶质为CH3COONa CH3COOH
离子浓度关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
b点,溶质为CH3COONa CH3COOH
离子浓度关系:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
c点,溶质为CH3COONa
离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
d点,溶质为CH3COONa NaOH
离子浓度关系:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
七、沉淀溶解平衡的再理解
1.难溶电解质的溶解平衡与弱电解质的电离平衡的区别:
区别角度
沉淀溶解平衡
电离平衡
物质类别
难溶电解质可以是强电解质也可以是弱电解质
难电离物质只能是弱电解质
变化
过程
已溶解溶质与未溶解溶质之间形成的沉淀与溶解的平衡状态
溶解的弱电解质分子与离子之间的转化达到的平衡状态
表示方法
如Al(OH)3:Al(OH)3(s)Al3+(aq)+3OH-(aq)
如Al(OH)3:Al(OH)3Al3++3OH-
2.影响溶解平衡的因素:
3.比较难溶电解质在水中的溶解能力:
—
—
4.判断给定条件下沉淀能否生成或溶解:
判断依据
结论
Q>Ksp
溶液过饱和,有沉淀析出
Q=Ksp
溶液饱和,沉淀与溶解处于平衡状态
Q
5.有关溶度积(Ksp)的计算:
(1)已知溶度积求溶液中的某种离子的浓度,如Ksp=a的饱和AgCl溶液中c(Ag+)= mol·L-1。
(2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的Ksp=a,在0.1 mol·L-1的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=10a mol·L-1。
(3)计算反应的平衡常数,如对于反应Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),Ksp(MnS)=c(Mn2+)·c(S2-),Ksp(CuS)=c(Cu2+)·c(S2-),而平衡常数K==。
6.沉淀溶解平衡的应用:
应用
实例
沉淀的生成
加沉
淀剂
法分
离离
子
如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS等沉淀,也是分离、除去杂质常用的方法。离子方程式为Cu2++S2-===CuS↓、Cu2++H2S===CuS↓+2H+和Hg2++S2-===HgS↓、Hg2++H2S===HgS↓+2H+。
控制溶液的pH分离物质
如工业原料NH4Cl中含杂质FeCl3,使其溶解于水,再加入氨水调节pH至7~8,可使Fe3+转变为Fe(OH)3沉淀而除去,离子方程式为Fe3++3NH3·H2O===Fe(OH)3↓+3NH。
沉淀的溶解
酸碱溶解法
如酸溶解法:如难溶于水的CaCO3沉淀可以溶于盐酸中。反应中,气体CO2的生成和逸出,使CaCO3溶解平衡体系中的CO浓度不断减小,平衡向沉淀溶解的方向移动。
盐溶
解法
如Mg(OH)2溶于NH4Cl溶液是由于NH与OH-反应,使c(OH-)减小,Mg(OH)2溶解平衡右移。
沉淀的转化
实例
①锅炉中的水垢含有CaSO4的清除转化过程:CaSO4(s)CaCO3(s)Ca2+(aq)
②在自然界也发生着溶解度小的矿物转化为溶解度更小的矿物的现象。深层的闪锌矿(ZnS)和方铅矿(PbS),便慢慢地转变为铜蓝(CuS)。
转化的一般原则
(1)溶解度较小的沉淀易转化成溶解度更小的沉淀。
(2)当一种试剂能沉淀溶液中的几种离子时,生成沉淀所需试剂离子浓度越小的越先沉淀。
(3)如果生成各种沉淀所需试剂离子的浓度相差较大,就能分步沉淀,从而达到分离离子的目的。
(4)两种沉淀的溶解度差别越大,沉淀转化越容易。
7.沉淀先后顺序的判断:
向溶液中加入沉淀剂,当有多种沉淀生成时,哪种沉淀的溶解度最小(当各种沉淀的Ksp表达式相同时,Ksp越小,沉淀的溶解度越小),则最先生成该沉淀。
(1)向含等浓度Cl-、Br-、I-的混合液中加入AgNO3溶液,最先生成的沉淀是AgI。
(2)向含等浓度CO、OH-、S2-的混合液中加入CuSO4溶液,最先生成的沉淀是CuS。
(3)向Mg(HCO3)2溶液中加入适量NaOH溶液,生成的沉淀是Mg(OH)2而不是MgCO3,原因是Mg(OH)2的溶解度比MgCO3的小。
【期中知识点归纳】(苏教版2019)2023-2024学年高二上册化学 选修1 专题2 化学反应速率与化学平衡 讲义: 这是一份【期中知识点归纳】(苏教版2019)2023-2024学年高二上册化学 选修1 专题2 化学反应速率与化学平衡 讲义,文件包含期中知识点归纳苏教版20192023-2024学年高二上册化学选修1专题2化学反应速率与化学平衡讲义教师版docx、期中知识点归纳苏教版20192023-2024学年高二上册化学选修1专题2化学反应速率与化学平衡讲义学生版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第二章 化学反应速率与化学平衡 试卷.zip: 这是一份【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第二章 化学反应速率与化学平衡 试卷.zip,文件包含期中知识点归纳人教版20192023-2024学年高二上册化学选修1第二章化学反应速率与化学平衡讲义学生版docx、期中知识点归纳人教版20192023-2024学年高二上册化学选修1第二章化学反应速率与化学平衡讲义教师版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第一章 化学反应的热效应 试卷.zip: 这是一份【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第一章 化学反应的热效应 试卷.zip,文件包含期中知识点归纳人教版20192023-2024学年高二上册化学选修1第一章化学反应的热效应讲义学生版docx、期中知识点归纳人教版20192023-2024学年高二上册化学选修1第一章化学反应的热效应讲义教师版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。