

中考复习 浙教版科学八年级上册 第1章 水和水的溶液 知识点
展开浙教版科学八年级上册 第1章 水和水的溶液 知识点
第1节 地球上的水
- 水的分布
- 水的分布
- 水的存在形式
1) 液态水:海洋水、河流水、地下水
2) 固态水:极地和高山上的冰川
3) 气态水:空气中的水蒸气
- 水的循环
- 水循环:自然界的水周而复始持续运动的过程,包括蒸发、蒸腾、凝结、降水、径流
- 水循环的过程
1) 陆地水、海洋水→大气水
a) 蒸发:陆地上的河流水、湖泊水和海洋水以直接蒸发的形式释放出来,转化为大气水
b) 升华:冰川在一定条件下,会直接升华为水蒸气,成为大气水
2) 大气水→陆地水、海洋水
空气中的水汽在一定的条件下,又会重新凝结成为液态水或凝华为固态水,并以液态雨水或固态的雪、冰雹等形式降落下来,落到陆地,成为陆地水,落到海洋成为海洋水
3) 陆地水→海洋水、地下水
a) 降落到陆地上的水,一部分在地球的引力的作用下,直接汇集成河流水、湖泊水,并形成地表径流,流入大海,成为海洋水
b) 另一部分则下渗转变为地下水和土壤水,并形成地下径流,流入大海,成为海洋水。当然,还有少量陆地水转化为冰川
- 水资源的分布
- 全球水资源分布情况
从全球范围看,赤道附近地区和沿海地区,水资源往往比较丰富,而内陆和沙漠地区,水资源则比较贫乏。据统计,全球大约有60%的地区正在经受着缺水的煎熬,甚至在一些水资源丰富的国家,如加拿大、美国等一些城市的供水也越来越困难
- 我国水资源分布情况
我国的水资源在地区分布上很不均匀,大量的淡水集中在南方,北方淡水资源只有南方淡水资源的1/4。据统计,全国600多个城市中,有近400个城市缺水,其中一半以上严重缺水
我国的水资源在时间分布上也很不均衡,突出表现在夏季丰富、冬季欠缺,江河径流量的年际变化大,尤其在北方更加明显
- 水与生命
- 水对植物的作用
水是植物的重要组成部分。在植物的各大器官中都含有水,但同一株植物不同部位的含水量是不同的,如根尖、嫩芽等含水量为60%~90%,干种子为10%~40%。不同植物的含水量也是不同的,如水生植物的含水量高达90%以上
- 水对动物的作用
动物也离不开水,水是动物生存的基本条件。一般动物体的含水量高于植物,约为70%~80%,其中水母体内的含水量高达98%左右。一些动物有着自己特殊的结构,可以适应缺水的环境
- 水对人体生命的作用
对于人的生存活动来说,水也是至关重要的物质。一个健康的成年人每天平均约需2.5升水。一个人可以十几天不进食,但不能不补充水。偶尔摄入较多的水对人体几乎是无害的,但是当人体内含水量不足时就会造成脱水,严重脱水时人就会有生命危险
第2节 水的组成
- 水的电解
- 实验仪器:水电解器、直流电源
- 实验现象
1) 通电后,两个电极上都有气泡产生
2) 与电源正极相连的玻璃管b内产生的气体体积小,与电源负极相连的玻璃管a内产生的气体体积大,且玻璃管b与玻璃管a内产生气体的体积比大约为1:2
- 气体检验
1) 玻璃管b中的气体可使带火星的木条复燃,证明是氧气
2) 玻璃管a中的气体,被移近火焰时能够燃烧,火焰呈淡蓝色(如果气体量少,可能发出爆鸣声),证明是氢气
- 实验结论
1) 水是由氢氧两种元素组成的
2) 水在通电的条件下,发生了分解反应,生成了氢气和氧气
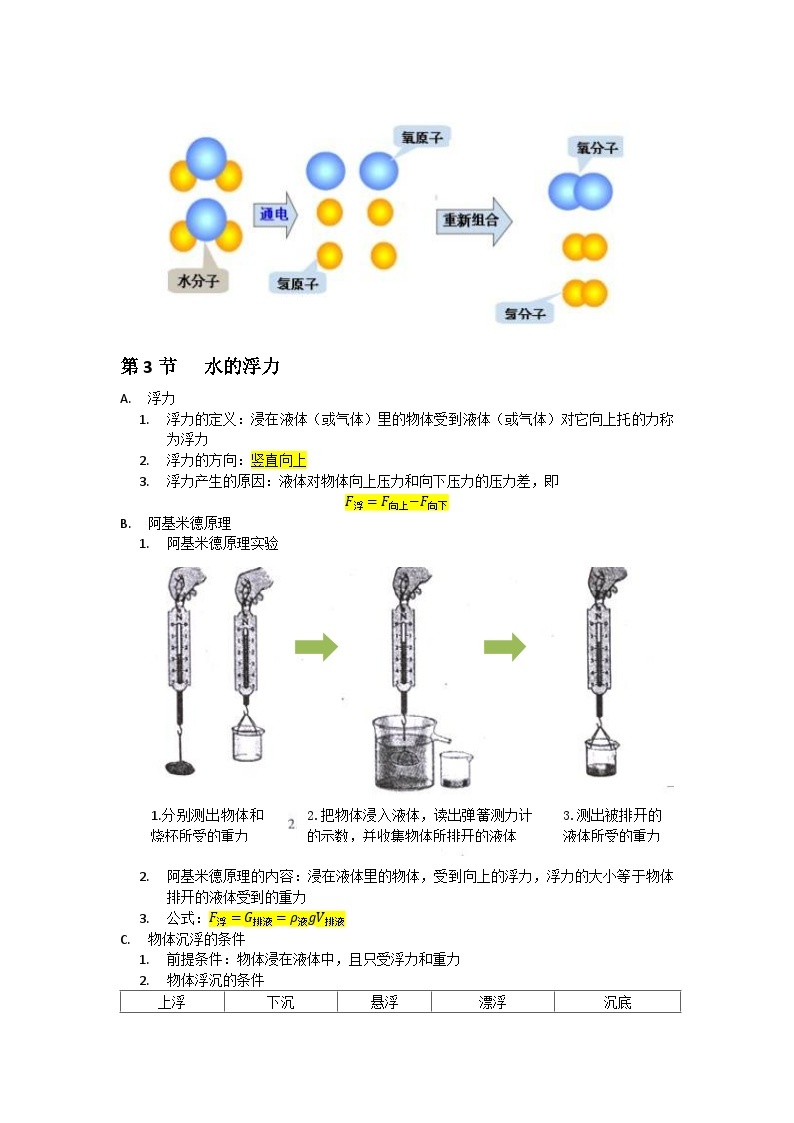
- 水分子的构成
- 水分子中含有两种不同的、更小的粒子,这种粒子就是原子
- 一个水分子中由两个氢原子和一个氧原子构成,因此我们可以说水是由氢元素和氧元素组成的
第3节 水的浮力
- 浮力
- 浮力的定义:浸在液体(或气体)里的物体受到液体(或气体)对它向上托的力称为浮力
- 浮力的方向:竖直向上
- 浮力产生的原因:液体对物体向上压力和向下压力的压力差,即
- 阿基米德原理
- 阿基米德原理实验
- 阿基米德原理的内容:浸在液体里的物体,受到向上的浮力,浮力的大小等于物体排开的液体受到的重力
- 公式:
- 物体沉浮的条件
- 前提条件:物体浸在液体中,且只受浮力和重力
- 物体浮沉的条件
上浮 | 下沉 | 悬浮 | 漂浮 | 沉底 |
|
|
|
| |
实心体 | 实心体 | |||
处于动态(运动状态不断改变),受非平衡力作用 | 可以停留在液体中的任何深度处 | “上浮”过程的最终状态 | “下沉”过程的最终状态 | |
处于静态,受平衡力作用 | ||||
- 物体沉浮条件的运用
- 密度计
1) 密度计是测量液体密度的工具,它是根据物体浮在液面条件的原理制成的
2) 结构:一根上部标有刻度,形状特殊的玻璃管,管下部的玻璃泡内装入小铅丸或汞
3) 密度计刻度值的特点:上面读数小,下面读数大;刻度不均匀,上疏下密。密度计没有零刻度
- 轮船
用钢板制成的轮船,由于船体中间很大部分是空的,可以排开更多的水,获得更大的浮力,从而能漂浮在水面上
- 潜艇
潜艇的两侧有水舱,当水舱充满水时,潜艇受到的重力大于浮力,潜艇下沉;当用压缩空气将水舱里的水排出一部分,潜艇受到的重力等于浮力时,潜艇就会停留在水面下任何深度的地方
- 热气球和气艇
氢气球、热气球、飞艇上浮到空中,这是因为氢气、热空气以及飞艇中的氦气的密度比空气的小,使得它们受到空气的浮力大于重力,因而能够升空
第4节 物质在水中的分散状况
- 溶液
- 概念
- 溶液的特征
1) 均一性:溶液中各部分的浓度和性质都相同
2) 稳定性:外界条件不变时,溶质、溶剂不会分离
- 悬浊液和乳浊液
- 定义
1) 悬浊液:固体小颗粒悬浮在液体里而形成的物质。如泥水、钡餐等
2) 乳浊液:小液滴分散到液体里形成的物质,也叫乳状液。如牛奶、肥皂水等
- 溶液、悬浊液、乳浊液的比较
| 溶液 | 悬浊液 | 乳浊液 |
形成过程 | 固体、液体、气体溶解在液体里 | 固体颗粒分散在液体里 | 小液滴分散在液体里 |
溶解性 | 溶 | 不溶 | 不溶 |
现象 | 透明且均一 | 浑浊、不均一 | 浑浊、不均一 |
稳定性 | 稳定 | 不稳定 | 不稳定 |
分散在液体中的粒子 | 分子或离子 | 许多分子的集合体 | 许多分子的集合体 |
久置现象 | 均一、稳定 | 沉淀 | 分层 |
相同点 | 都是混合物 | ||
- 说明
1) 悬浊液、乳浊液都是不稳定、不均一的
2) 悬浊液分散到液体里的固体小颗粒和乳浊液分散到液体里的小液滴都是大量分子的集合体
3) 溶液中的溶质是以分子或离子形式均匀扩散到溶剂里,形成均一、稳定的混合物
- 混合物
- 定义:有多种物质组成的物质
- 特点
1) 由多种物质组成,这些物质相互间没有发生化学反应
2) 各组分的含量多少不固定,不能用化学式表示其组成
3) 混合物没有固定的性质,它决定于所含各物质原有的性质和数量
4) 各组分保持自己的性质
- 固体药品的取用
- 存放:固体药品一般存放在广口瓶内
- 块状药品或金属颗粒的取用
- 固体粉末状药品的取用
- 液体药品的取用
- 较多量时——倾倒法
1) 操作要领
2) 注意:倒完液体后,立即盖紧瓶塞,并把试剂瓶放回原处且标签朝外
- 一定量时——量筒
量度一定量液体的体积时,量筒必须放平,视线与量筒内液体凹液面的最低处保持水平,再读出液体体积的数值
- 较少量时——滴加法
第5节 物质的溶解
- 物质的溶解性
- 溶解性:一种物质溶解在另一种物质里的能力
- 物质溶解的能力:一定条件下,物质能够溶解的数量是有限的
- 影响物质溶解性的因素
1) 不同物质在同一溶剂中的溶解能力不同
2) 同种物质在不同溶剂中的溶解能力不同
3) 同种物质在同一溶剂中的溶解能力与温度有关
- 物质溶解时的温度变化
1) 有的物质溶解时,会放出热量,使溶液温度显著升高,如强酸、强碱等
2) 有的物质溶解时,会吸收热量,使溶液温度显著降低,如NH4NO3等
3) 有许多物质溶解时,溶液的温度没有明显变化,如NaCl等
- 饱和溶液与不饱和溶液
- 定义
1) 饱和溶液:在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液
不饱和溶液:在一定温度下,向一定量的溶剂里加入某种溶质,还能继续溶解的溶液
2) 浓溶液:溶有较多溶质的溶液
稀溶液:溶有较少溶液的溶液
- 说明
1) 要明确“一定温度”和“一定量溶剂”这两个前提条件。溶液在某一温度下和一定量溶剂里对某种固态溶质来说饱和了,但若改变温度或改变溶剂的量,就可能使溶液变得不饱和
2) 要明确指出指哪种物质的饱和溶液或不饱和溶液
- 饱和溶液与不饱和溶液的转化条件
- 固体溶解度
- 定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。符号为S
- 正确理解溶解度概念的要点
条件 | 在一定温度下。物质的溶解度会随温度的变化而变化,不指明温度时,溶解度没有意义 |
标准 | 在100g溶剂里。这是概念中规定的标准,物质溶解量的多少与溶剂量的多少成正比,要比较物质溶解度的大小,必须要等量溶剂。此处100g是指溶剂质量,而不是溶液质量 |
状态 | “饱和”。规定只有在一定量溶剂中(100g)达到饱和时(溶解溶质的最大量),所溶解的溶质的质量才是一个确定的值 |
单位 | “g”。因为溶解度实质上是被溶解的溶质的质量 |
- 说明:通过溶解度可得到该温度下物质的饱和溶液中,溶质、溶剂和饱和溶液之间的质量关系,即m(溶质):m(溶剂):m(饱和溶液)=S:100g:(100g+S)。如20℃时硝酸钾的溶解度为31.6克,则在20℃时任意质量的硝酸钾饱和溶液中,硝酸钾、水、硝酸钾饱和溶液三者之间的质量比为31.6:100:131.6
- 影响因素
1) 内部因素:溶质和溶剂本身的性质
2) 外部因素:温度。温度对其影响分三种情况:
a) 大多数固体物质的溶解度随温度的升高而增大,如KNO3
b) 少数固体物质的溶解度受温度影响不大,如NaCl
c) 极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2
- 溶解性和溶解度的关系
溶解度/g(20℃) | <0.01 | 0.01~1 | 1~10 | >10 |
溶解性分类 | 难溶 | 微溶 | 可溶 | 易溶 |
举例 | AgCl、CaCO3 | Ca(OH)2 | KClO3 | KNO3、NaCl |
- 溶解度曲线
1) 溶解度曲线的意义
内容 | 表示意义 | 举例(以下图为例) | |
点 | 曲线上的点 | 表示物质在对应温度时的溶解度 | 如A、B表示物质N、M在t1℃时的溶解度分别为a g和b g |
两曲线交点 | 表示两物质在某温度时的溶解度相等 | 如C点表示物质在M、N在t2℃时的溶解度相等,均为c g | |
线 | 表示两物质的溶解度随温度改变而变化的趋势 | 如M的溶解度随温度的升高而增大,N的溶解度随温度的升高而减小 | |
面 | 曲线下面的点 | 表示溶液为不饱和溶液 | 如D点表示t1℃时N的不饱和溶液 |
曲线上面的点 | 表示溶液饱和且有未溶固体 | 如D点表示t1℃时M的饱和溶液 | |
2) 变化规律
a) 陡升型:大多数固体物质的溶解度随温度升高而迅速增大,表现在曲线“坡度”比较“陡”,如KNO3。从溶液中析出该物质时,可采取降温结晶;并可采取降温的方法,使该物质的不饱和溶液变为饱和溶液
b) 缓升型:少数固体物质的溶解度受温度的影响很小,表现在曲线“坡度”比较“平”,如NaCl。从溶液中析出该物质时,可采取蒸发结晶的方法;并可采取蒸发溶剂的方法,使该物质的不饱和溶液变为饱和溶液
c) 下降型:极少数物质的溶解度随温度的升高而减小,表现在“皮肤下降”,如Ca(OH)2。从溶液中析出该物质时,可采用升温结晶的方法;并可通过升温的方法,使该物质的不饱和溶液变为饱和溶液。
- 溶质的质量分数
- 定义:溶质质量与溶液质量之比
- 表达式:
- 注意事项
1) 溶质的质量分数是溶液组成的一种表示方法,所指溶液可以是饱和溶液,也可以是不饱和溶液;既可以是稀溶液,也可以是浓溶液
2) 溶质的质量分数是质量之比,用百分数来表示,一般与温度无关
3) 溶液质量是该溶液中溶剂质量与溶解的全部溶质质量之和(溶质可以是一种或几种)
4) 溶质质量是指形成溶液的那部分溶质的质量,不包括未溶解或结晶析出的溶质的质量
5) 溶质的质量分数越大,表示一定量溶液中所含溶质质量越多,溶液越浓;反之,则表示一定量溶液中所含溶质质量越少,溶液越稀
- 溶质的质量分数的计算
- 相关公式
附:
- 溶质质量的判断
1) 当物质不与溶剂发生化学反应且全部溶解时,投入溶剂中的物质的质量就是溶质质量,此时直接用有关公式计算
2) 当物质不与溶剂反应且未全部溶解时,只有溶解了的物质的质量才是溶质质量
3) 如果把某物质投入溶剂中,该物质与溶剂发生化学反应,则所得溶液中的溶质为反应所生成的物质。应先根据化学方程式求出溶质质量,然后才能计算溶液中溶质的质量分数
- 溶液的稀释计算
- 计算依据:稀释前后溶液中溶质的质量不变
- 稀释方法
1) 加水稀释:
A代表浓溶液质量,a%是它的质量分数,B代表稀释后溶液质量,b%代表它的溶质质量分数,代表加入水的质量
2) 加入稀溶液稀释:
C代表稀溶液质量,c%是它的溶质质量分数,d%代表混合后所得溶液的溶质质量分数
- 溶液的增浓计算
向原溶液中添加溶质 | 根据增加溶质后,溶液中溶质的质量 = 原溶液中溶质的质量 + 增加的溶质的质量,而溶液的质量 = 原溶液的质量 + 增加的溶质的质量,所以若设原溶液的质量为A g,溶质的质量分数为a%,加溶质B g后变成溶质的质量分数为b%的溶液,则A g×a% + B g = (A g + Bg) ×b% |
将原溶液蒸发掉部分溶剂 | 根据溶液蒸发溶剂前后,溶质的质量不变,若设原溶液质量为A g,溶质的质量分数为a%,蒸发B g水后变成溶质的质量分数为b%的溶液,则A g×a%=(A g-B g) ×b% |
与浓溶液混合 | 根据混合后的溶液的总质量等于两溶液的质量之和,混合后的溶液中溶质质量等于两溶液的溶质质量之和,所以设原溶液质量为A g,溶质的质量分数为a%,浓溶液质量为B g,溶质的质量分数为b%,两溶液混合后得到溶质的质量分数为c%的溶液,则 A g×a% + B g×b%=(A g+B g) ×c% |
- 配置一定质量分数的氯化钠溶液
- 以配置质量分数为6%的氯化钠溶液为例
计算 | 配置50g质量分数为6%的氯化钠溶液所需氯化钠的质量为3 g,水的质量为47 g |
称量 | 用托盘天平称量所需的氯化钠,放入烧杯中 |
量取 | 用量筒量取所需的水(水的密度可近似看作1 g/cm3),倒入盛有氯化钠的烧杯中 |
溶解 | 用玻璃棒搅拌,使氯化钠溶解 |
装瓶保存 | 把配置好的溶液装入瓶中,盖好瓶盖并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放在试剂柜中 |
- 导致溶液的溶质质量分数偏小的原因
1) 天平使用不正确,如药品、砝码放反(称量时使用游码),使药品称量质量偏小
2) 量取水的过程中仰视读数,使水量取多了
3) 烧杯不干燥,原来内部就有一些水
4) 固体药品中含有杂质等
- 导致溶液的溶质质量分数偏大的原因
1) 天平使用不正确,如称量前没有调平衡,指针偏右,导致药品称量偏多
2) 砝码已生锈,导致药品称量偏多
3) 量取水的过程中俯视读数,使水量取少了
4) 将量筒中的水倒入烧杯中时,一部分洒在外面等
第6节 物质的分离
- 物质的结晶
- 结晶
1) 结晶:已溶解在溶液中的溶质以晶体的形式析出的过程
2) 母液:结晶后余下的溶液,在该温度下为饱和溶液
- 结晶的方法
1) 蒸发结晶:适用于溶解度受温度影响变化比较小的固体物质
2) 降温结晶:又叫冷却热饱和溶液结晶法,适用于溶解度随温度升高而迅速增大的固体物质
用降温结晶法不能使溶液中的溶质全部结晶析出,而剩余的溶液仍是饱和溶液
- 结晶水合物
1) 结晶水:有些晶体从水溶液中结晶析出时,往往要结合一定量的水,这部分存在于析出晶体中的水叫结晶水
2) 结晶水合物:含有结晶水的晶体。如蓝色硫酸铜晶体(CuSO4·5H2O),也叫五水硫酸铜、胆矾或蓝矾
- 其他几种常用的分离方法
- 常用的净水方法
净水方法 | 原理 | 作用 |
沉淀 | 使不溶性的杂质沉淀下来,并与水分层 | 除去不溶性杂质 |
过滤 | 把液体与不溶于该液体的固体分开 | 除去不溶性杂质 |
吸附 | 利用活性炭等具有吸附作用的物质把水中的一些不溶性杂质、部分可溶性杂质吸附在表面而除去 | 除去部分不溶性杂质、可溶性杂质和臭味等 |
蒸馏 | 通过加热的方法使水变成水蒸气后冷凝成水 | 除去可溶性杂质和不溶性杂质 |
1) 上述四种净水方法发生的变化均为物理变化
2) 用蒸馏方法得到的水为纯净物,其他三种方法得到的水均为混合物
3) 一般的净水过程,通常都是几种净水方法综合运用,这样净化水的效果更好
- 沉淀法
把水静置,使水中的杂质沉淀到水底的方法
1) 明矾的净水作用
明矾溶于水后生成的凝胶状物质,能使水中细小的悬浮杂质集结而下沉,从而达到净水的目的
2) 活性炭的净水作用
活性炭是具有多孔结构的单质碳,对气体、蒸气或胶状固体具有强大的吸附能力,很多净水器中用活性炭来净化水
- 过滤
- 适用范围
1) 不溶性固体和液体两种颗粒大小不同的固体的分离
2) 过滤器的准备
取一张圆形滤纸,如图所示折好并放入漏斗,使之紧贴漏斗内壁,并使滤纸边缘略低于漏斗边缘,用少量水润湿滤纸并使滤纸与漏斗内壁之间不要有气泡
- 操作的注意事项
- 滤液仍然浑浊的可能原因
滤纸破损;液面超过滤纸边缘;漏斗或烧杯不干净等
- 蒸馏
- 原理:给液体加热,使液体加热,使它变为蒸气,再使蒸气冷凝成液体的方法
- 适用范围:通过蒸馏,可以把沸点不同的物质从混合物中分离出来,也可以把挥发性液体与溶解在液体中的不挥发性杂质分离开来,达到分离和提纯的目的
蒸馏装置图
- 注意事项
1) 蒸馏烧瓶下面须垫上石棉网,以防炸裂蒸馏烧瓶
2) 蒸馏烧瓶内应加入几粒沸石(或碎瓷片),使蒸馏平稳进行,以防加热时暴沸
3) 温度计的水银球应对着蒸馏烧瓶的支管口,因为蒸馏时需控制的温度是支管口蒸气的温度
4) 冷却水的流向应跟蒸气的流向相反,这种逆流冷却可以达到最好的冷却效果
5) 弃去开始馏出的部分液体,因为里面可能含有低沸点杂质和仪器表面的杂质
- 纯净物
- 定义:由一种物质组成的物质
- 判断方法:判断某物质是不是纯净物,主要根据它的组成是否单一
- 纯净物与混合物的关系
项目 | 混合物 | 纯净物 |
区别 | 1) 宏观组成:由两种或两种以上物质组成 2) 微管构成:由构成不同物质的微粒构成 3) 无固定组成,无固定物理性质 4) 各物质保持其原有的性质 | 1) 宏观组成:由同种物质组成 2) 微观构成:由构成同种物质的微粒构成 3) 有固定组成,有固定性质 |
联系 | ||
判断方法 | 判断某一物质是纯净物还是混合物,关键是看这种物质是由几种物质组成的,不能与物质的名称混淆。如冰水混合物,名称中含“混合物”,但实际上只含有水一种物质,属于纯净物 | |
第7节 水资源的利用、开发和保护
- 水资源的利用和开发
- 水资源的利用:人类社会对水的需求主要表现为生活用水、工业用水和农业用水等方面,地球上可以供我们直接利用的水并不多,人类利用较多的是河水、淡水湖泊和埋藏比较浅的地下淡水
- 解决我国华北、西北地区缺水问题的措施
1) 充分利用当地的水资源,节约用水,避免浪费和污染
2) 改变水循环路径,进行跨流域调水(如南水北调)
- 水资源的保护
- 水资源保护的重要内容
1) 水资源保护的重要内容之一就是节约用水
2) 水的再循环、减少水的使用及水的回收利用是保护和节约用水的三种主要方法。水资源保护的另一个重要内容是防止水污染
- 水体污染
1) 定义:大量污染物质排放到水体中,超过水体的自净能力,使水质恶化,水体及其周围的生态平衡遭到破坏,对人类健康、生活和生产活动等造成损失和威胁
2) 水体污染的来源
工业——废水、废渣、废气的任意排放
农业——过量使用农药和化肥
生活——生活污水和垃圾的任意排放








