




金属和金属材料-中考化学一轮复习课件PPT
展开2、纯金属材料的物理性质
注:合金是金属材料,不是合成材料
2Mg+O2 =2MgO 4Al+3O2 = 2Al2O3 (致密的)
俗语说“真金不怕火炼”
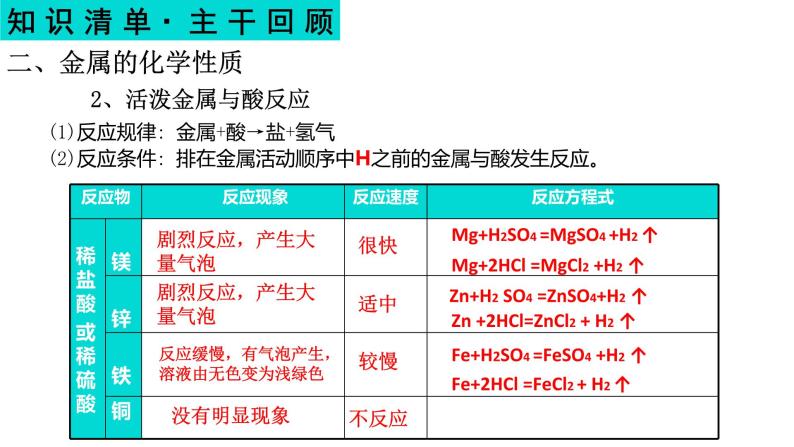
(1)反应规律: 金属+酸→盐+氢气(2)反应条件: 排在金属活动顺序中H之前的金属与酸发生反应。
剧烈反应,产生大量气泡
反应缓慢,有气泡产生,溶液由无色变为浅绿色
Mg+H2SO4 =MgSO4 +H2 ↑
Mg+2HCl =MgCl2 +H2 ↑
Zn+H2 SO4 =ZnSO4+H2 ↑
Zn +2HCl=ZnCl2 + H2 ↑
Fe+H2SO4 =FeSO4 +H2 ↑
Fe+2HCl =FeCl2 + H2 ↑
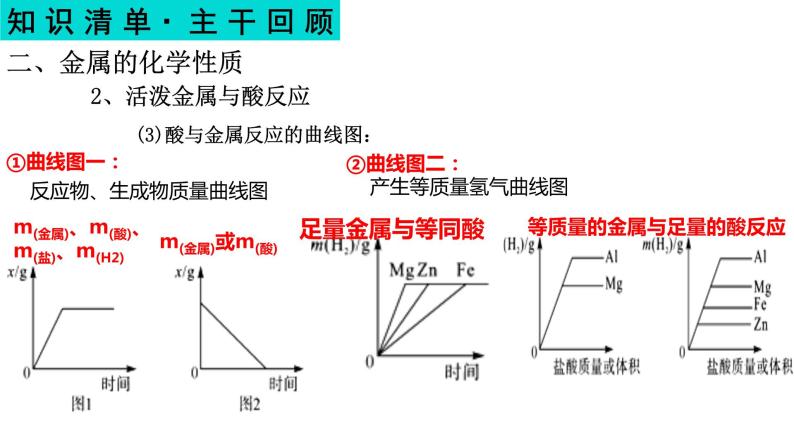
①曲线图一: 反应物、生成物质量曲线图
m(金属)、m(酸)、m(盐)、m(H2)
②曲线图二: 产生等质量氢气曲线图
(3)酸与金属反应的曲线图:
等质量的金属与足量的酸反应
③曲线图三:等量等价金属酸足量
④曲线图四:等量不等价金属酸足量
(1)反应规律:金属+盐→新盐+新金属。(2)反应条件:必须是在前的金属置换在后的金属(K、Ca、Na除外) ②反应中的盐必须溶于水。
2Al + 3CuSO4= Al2(SO4)3 + 3Cu
Cu +2AgNO3 =Cu(NO3)2 + 2Ag
1、概念:2、判断方法: 反应前后看物质类别和数量,必须是单质和化合物各一种3、表达式:A+BC==B+AC
2、金属活动性顺序的重要应用:(1)判断金属的活动性强弱:金属的位置越靠前,它的活动性越强。(2)判断金属与酸是否发生反应:排在氢前面的金属能置换出盐酸、稀硫酸里的H。(3)判断金属与盐溶液是否发生反应:位于前面的金属能把位于后面的金属从它们的盐 溶液里置换出来。
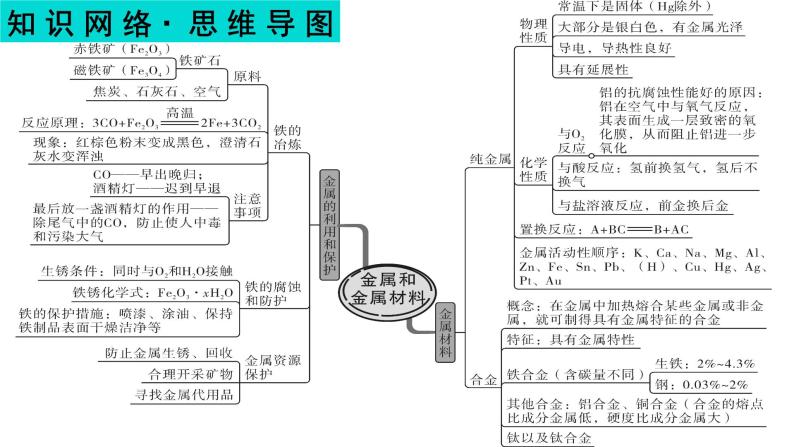
1.铁的冶炼:(1)原料:铁矿石、焦炭、石灰石和空气。(2)原理(以氧化铁为例):
五、金属资源的利用和保护
(3)现象:玻璃管中的红棕色固体变为黑色;试管内澄清的石灰水变浑浊(4)步骤:实验开始先通CO后加热;实验结束先停止加热,继续通CO至试管冷却。
2.金属资源保护:①铁制品锈蚀的条件:
与空气中的O2和H2O接触。
②防止锈蚀的方法:a、保持铁制品的洁净、干燥 b、覆盖保护膜:如涂油、刷漆 c、制成合金或改变金属内部结构
考点2 金属的化学性质及置换反应
考点3 金属活动性顺序及其应用
考点4 金属资源的利用和保护
1、(2021安徽改编)材料与人类生活密切相关。下列物品的主要成分属于金属材料的是( ) A. 大理石华表 B. 塑料水管 C. 陶瓷餐具 D. 黄金面具
2、(2020安徽)右图标出的是有关灯泡组成的物质, 请根据右图回答下列问题。 (1)所标物质中属于金属材料的是 , 属于非金属单质的是 。 (各写一种即可) (2)物质的性质决定其用途。请你就图中标出的物质举一例 说明: 。 (3)比较锡和铜的金属活动性强弱可采用 的方法。
氮气的化学性质不活泼,可用于灯泡填充气
钨丝(或铜丝、焊锡、铝)
把锡片插入到硫酸铜溶液中
1、(2022宜昌)向装有一定量硝酸铜和硝酸银混合溶液的试管中,缓慢加入细铁粉,充分反应,下列关于试管中物质的变化关系错误的( )
2、(滁州期末)将质量相等、表面积相同的锌片和镁片分别加入到完全相同的两份稀盐酸中,反应速率随时间变化的关系如图所示,反应后两种金属都有剩余,下列说法错误的是( )A.曲线②表示的是锌与稀盐酸反应速率的变化B.两种金属和稀盐酸反应最终产生的氢气质量相等C.镁和稀盐酸反应速率快是因为镁的相对原子质量小D.刚开始时反应速率都变快是因为反应放热
1、(2021·株洲)经过实验探究,人们总结出了金属活动性顺序规律,下列有关说法正确的是( )A.金属铝比铁更耐腐蚀,是因为铁更活泼B.工业上可以利用单质铁回收硫酸锌溶液中的金属锌C.铜、银单质分别与稀盐酸混合,铜置换出氢气更快D.金属活动性顺序可作为金属能否在溶液中发生置换反应的一种判断依据
2、(2022·怀化)现有质量相等的X、Y、Z三种金属,分别放入三份溶质质量分数相等的足量稀硫酸中,X不发生反应,Y、Z在生成物中均显+2价,Y、Z反应生成氢气的质量与反应时间的关系如图所示,则下列说法正确的是( )A.X、Y、Z的金属活动性顺序为Y>Z>XB.相对原子质量:Y>ZC.完全反应生成氢气的质量:Y
4、向Mg(NO3)2、AgNO3、Cu(NO3)2混合液中加入一定量的铁粉,充分反应 后过滤.下列情况不可能存在的是( ) A.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+ B.滤纸上有Ag、Cu,滤液中有Cu2+、Fe2+、Mg2+ C.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+ D.滤纸上有Ag、Cu、Fe,滤液中有Cu2+、Fe2+、Mg2+
(2020.安徽)小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:(1)写出铝和盐酸反应的化学方程式:______________________________。(2)实验②和③表明:该反应快慢与_______________有关。(3)能表明盐酸浓度对反应快慢有影响的实验编号是:________和_______。(4)如果把实验①中盐酸的质量分数改为4%,请你推出铝丝消失时间(用t表示)的取值范围:___________________。
2Al + 6HCl = 2AlCl3 + 3H2 ↑
(2020.安徽)小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?方法:_____________________________。(6)小明将稀盐酸换成稀硫酸继续实验,发现铝丝和稀硫酸反应现象不明显。 【发现问题】为什么铝丝易与稀盐酸反应而难与稀硫酸反应呢? 【提出假设】Cl-的存在使酸和铝的反应容易进行。 【设计实验】如果你能帮助小明设计一个合理的实验来验证假设。_________________________________________________________。
向两支试管中各加入铝丝和稀硫酸,再分别加入氯化钠溶液和硫酸钠溶液(或向放有铝丝和稀硫酸的试管中加入稀盐酸)
用排水法收集一瓶氢气所需的时间(或通过单位时间内生成氢气的量、温度变化等
金属和金属材料-中考化学一轮复习课件PPT: 这是一份金属和金属材料-中考化学一轮复习课件PPT,共30页。PPT课件主要包含了思维导图,燃料及其利用,金属之最,金属材料,纯金属,物理性质,铝Al,铁Fe,汞Hg,钙Ca等内容,欢迎下载使用。
金属和金属材料-中考化学一轮复习课件PPT: 这是一份金属和金属材料-中考化学一轮复习课件PPT,共60页。
2023年中考化学一轮复习:金属和金属材料 课件PPT: 这是一份2023年中考化学一轮复习:金属和金属材料 课件PPT,共50页。












