
- 第15讲 Fe(OH)2、Fe(OH)3、铁盐-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第16讲 金属材料-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第18讲 元素周期律-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第19讲 化学键-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
- 第20讲 第一章期末备考提分练 -2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册) 试卷 0 次下载
第17讲 原子结构与元素周期表-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册)
展开第17讲 原子结构与元素周期表
必备知识
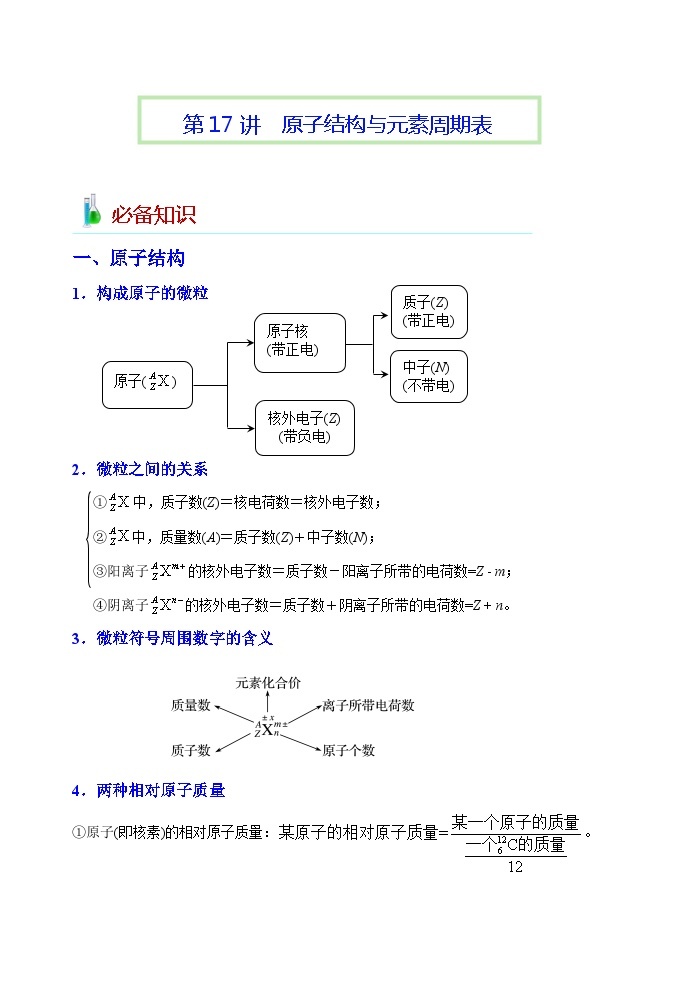
一、原子结构
原子()
原子核
(带正电)
核外电子(Z)
(带负电)
质子(Z)
(带正电)
中子(N)
(不带电)
1.构成原子的微粒
2.微粒之间的关系
①中,质子数(Z)=核电荷数=核外电子数;
②中,质量数(A)=质子数(Z)+中子数(N);
③阳离子的核外电子数=质子数-阳离子所带的电荷数=Z - m;
④阴离子的核外电子数=质子数+阴离子所带的电荷数=Z + n。
3.微粒符号周围数字的含义
4.两种相对原子质量
①原子(即核素)的相对原子质量:。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
②元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。如:Ar(Cl)=Ar(35Cl)×a%+Ar(37Cl)×b%。
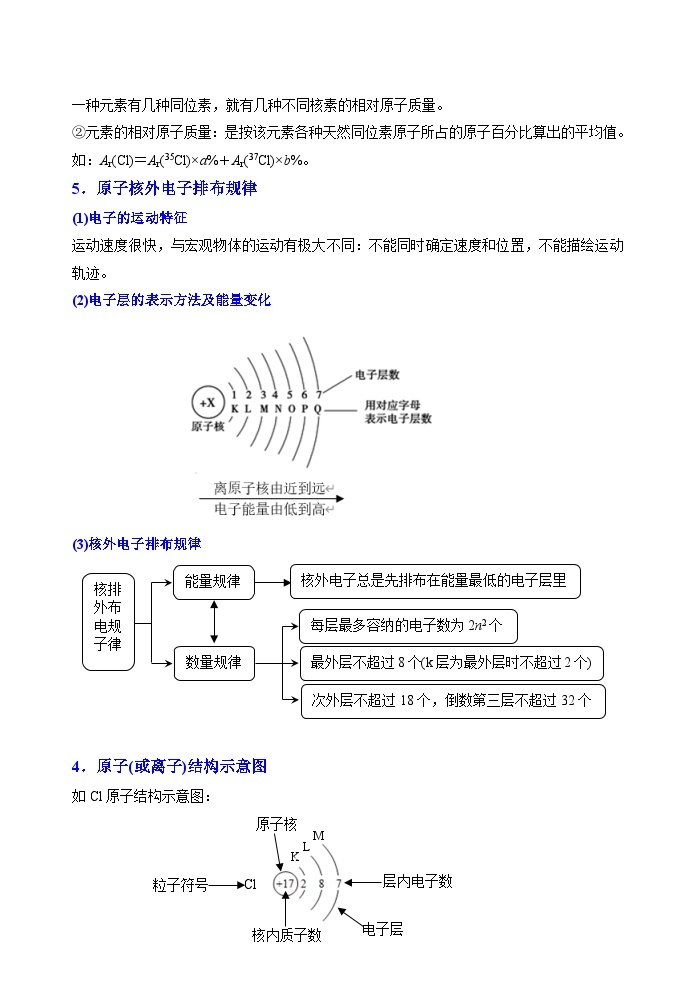
5.原子核外电子排布规律
(1)电子的运动特征
运动速度很快,与宏观物体的运动有极大不同:不能同时确定速度和位置,不能描绘运动轨迹。
(2)电子层的表示方法及能量变化
(3)核外电子排布规律
核排
外布
电规
子律
能量规律
数量规律
核外电子总是先排布在能量最低的电子层里
每层最多容纳的电子数为2n2个
最外层不超过8个(k层为最外层时不超过2个)
次外层不超过18个,倒数第三层不超过32个
4.原子(或离子)结构示意图
K
M
L
粒子符号
Cl
核内质子数
层内电子数
电子层
原子核
如Cl原子结构示意图:
二、元素、核素、同位素
1.元素、核素、同位素的关系图示:
元素
核素
核素
……
同位素
具有相同核电荷数的同一类原子的总称,一种元素可有多种核素。
质子数相同,中子数不同的同一种元素的不同核素的互称
具有一定数目的质子和一定数目的中子的一种原子,表示方法()
2.同位素的特征“六同三不同”:
六
同
化学性质几乎完全相同
位置相同
同一元素
核外电子数相同
核电荷数相同
质子数相同
三
不
同
中子数不同
物理性质不同
质量数不同
3.同位素的丰度:
同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
4.几种重要的核素
核素
U
C
H
H
O
用途
核燃料
用于考古断代
制氢弹
示踪原子
三、元素周期表及其应用
1.原子序数
按照元素在周期表中的顺序给元素所编的序号,称为原子序数。
原子序数=质子数=核电荷数=核外电子数=质量数-中子数。
2.元素周期表的编排原则
元素周期表的编排原则
同一
周期
同一
主族
电子层数相同
上 下:电子层数递增
最外层电子数相同
左 右:最外层电子数递增
3.元素周期表结构记忆简图
元
素
周
期
表
周期(7个)
七个横行
族(16个)
十八纵行
短周期
(3个)
长周期
(4个)
第一周期2种元素
第二周期8种元素
第三周期8种元素
第四周期18种元素
第五周期18种元素
第六周期32种元素(含镧系15种元素)
第七周期32种元素(含锕系15种元素)
主族(A):由短周期和长周期元素共同构成,共7个。
副族(B):完全由长周期元素构成,共7个。
第Ⅷ族:由第8、9、10纵行构成,共3个纵行。
0族:第18纵行。
4.元素周期表结构中的三个规律
(1)对角线规则:周期表中位于对角线位置的元素性质相似,如Li和Mg、Be和Al、B和Si。
(2)奇偶规律:在同一主族内,族序数、原子序数,若有一个是偶数(或奇数),另一个必为偶数(或奇数)。
(3)相同电子层结构的规律:稀有气体元素的原子与同周期非金属元素的阴离子以及下一周期金属元素(主族)的阳离子具有相同的电子层结构。
5.元素周期表中元素的分区
族
周期
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1
2
3
4
5
6
7
(1)分界线左面为金属元素区,分界线右面为非金属元素区。金属性最强的元素(不考虑放射元素)位于周期表的左下角,是Cs元素。非金属性最强的元素位于元素周期表的右上角,是F元素。
(2)分界线附近的元素的性质,既能表现一定的金属性,又能表现一定的非金属性。
(3)由卤族元素的性质递变规律,可推知元素砹(At)应为黑色固体,与氢气难化合,HAt不稳定,AgAt难溶于水等。
6.元素周期表的三大应用
(1)科学预测:为新元素的发现及预测它们的原子结构和性质提供了线索。
(2)寻找新材料:
寻找
新材料
分界线附近元素
氟、氯、磷、硫元素
过渡元素
半导体材料
优良催化剂和耐高温耐腐蚀的合金材料
研制农药的材料
寻找
寻找
探索
(3)用于工农业生产:对探矿有指导意义的是地球化学元素的分布与它们在元素周期表中位置关系,研制农药材料等
四、原子结构与元素的性质
1.原子结构决定化学性质
(1)金属元素的原子最外层电子一般小于4个,在化学反应中易失去电子,具有金属性;
(2)非金属元素的原子最外层电子一般多于4个,在化学反应中易得到电子,具有非金属性。
(3)稀有气体元素的原子最外层为8电子(氦为2电子)稳定结构,不易失去或得到电子,通常表现为0价。
2.碱金属元素原子结构与性质的关系
从Li、Na、K、Rb到Cs,原子的最外层电子数都是1个,电子层数依次增加;原子半径依次增大;原子核对最外层电子的吸引能力依次减弱;原子失去电子的能力依次增强;碱金属元素的还原性依次增强;金属性依次增强。
3卤族元素原子结构与性质的关系
从F、Cl、Br到I,原子的最外层电子数都是7个,电子层数依次增加;原子半径依次增大;原子核对最外层电子的吸引能力依次减弱;原子得到电子的能力依次减弱;卤族元素的氧化性依次减弱;非金属性依次减弱。
易混易错点
一、与原子结构有关的易混易错点
1.电子排布规律
(1)最外层电子数为3~7的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(2)最外层为l个或2个电子,则可能是ⅠA、ⅡA族元素,也可能是副族、Ⅷ族或0族元素氦。
(3)原子最外层比次外层电子多的元素一定位于第2周期。
(4)某元素阴离子最外层电子数与次外层相同,该元素位于第3周期。
(5)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
当A、B在ⅠA或ⅡA族时,y=x+m。当A、B在ⅢA~0族时,y=x+n。
2.原子不一定都有中子,如H。
3.质子数相同的微粒不一定属于同一种元素,如F与OH-。
4.核外电子数相同的微粒,其质子数不一定相同,如Al3+与Na+、F-等,N与OH-等。
5.某元素的原子最外层只有一个电子,不一定是金属元素。
6.微粒符号周围数字的含义。
7.①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴离子、阳离子中质子数与电子数不相等。
②有质子的微粒不一定有中子,如1H;有质子的微粒不一定有电子,如H+。
③质子数相同的微粒不一定属于同一种元素,如F-与OH-。
④核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+,F-、N和OH-等。
8.质子数和核外电子数分别相等的两种微粒关系
(1)可以是两种原子,如同位素原子。
(2)可以是两种分子,如CH4、NH3等。
(3)可以是两种带电荷数相同的阳离子,如NH、H3O+。
(4)可以是两种带电荷数相同的阴离子,如OH-、F-。
二、与元素、核素、同位素有关的易混易错点
1.不同核素可能具有相同的质子数,如H、H;也可能具有相同的中子数,如C、O;也可能具有相同的质量数,如C、N。
2.一种元素可以有多种核素,也可能只有一种核素。
3.同位素之间的转化,既不是物理变化也不是化学变化,是核反应。
4.核素是具有固定质子数和中子数的原子,同位素是指同一元素的不同核素之间的互称,同素异形体是指同一元素的不同单质间的关系。
5.只有核素才有质量数,质量数不适用于元素。质量数可以视为核素的近似相对原子质量。
6.规避同位素、同素异形体概念理解的易错点
同位素研究的对象是原子,同位素的“同位”是指一种元素的几种核素在元素周期表中占同一个位置,即质子数相同,中子数不同;同素异形体研究的对象是单质,同素异形体的“同素”是指元素的种类相同。
(1)由于同位素的存在,核素的种数远大于元素的种类。
(2)同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大;同一元素的各种稳定核素在自然界中所占的原子百分数(丰度)不变。
区分时抓住概念的关键点——研究对象:同位素——原子,同素异形体——单质,同分异构体——化合物。
三、与元素周期表及应用有关的易混易错点
1.ⅠA族元素不等同于碱金属元素,氢元素不属于碱金属元素。
2.元素周期表中第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族,不是ⅧB族。
3.根据元素周期表的构成特点,可分析每个族的元素种类,含元素种类最多的族是ⅢB族,共有32种元素。
4.过渡元素全部是金属元素,原子最外层电子数不超过2个(1~2个)。
5.由于镧系和锕系的原因,第6、7周期的ⅡA族和ⅢA族元素原子序数差为25。
6.元素周期表中元素的原子序数的差值关系
(1)同周期ⅡA族与ⅢA族元素的原子序数之差有三种情况:第2、3周期(短周期)相差1,第4、5周期相差11,第6、7周期相差25。
(2)相邻周期,同一主族元素的原子序数可能相差2、8、18、32。若A、B是同主族相邻周期元素,A、B所在周期分别有m和n种元素。如图:
(3)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素的种数远大于118种。
7.元素周期表结构中隐含的两条规律
(1)同周期主族元素原子序数差的关系
①短周期元素原子序数差=族序数差。
②两元素分布在过渡元素同侧时,原子序数差=族序数差。两元素分布在过渡元素两侧时,第四或第五周期元素原子序数差=族序数差+10,第六周期元素原子序数差=族序数差+24。
③第四、五周期的第ⅡA与ⅢA族原子序数之差都为11,第六周期为25。
(2)同主族、邻周期元素的原子序数差的关系
①ⅠA族元素,随电子层数的增加,原子序数依次相差2、8、8、18、18、32。
②ⅡA族和0族元素,随电子层数的增加,原子序数依次相差8、8、18、18、32。
③ⅢA~ⅦA族元素,随电子层数的增加,原子序数依次相差8、18、18、32。
8.(1)ⅠA族元素不等同于碱金属元素,H元素不属于碱金属元素。
(2)元素周期表第18列是0族,不是ⅧA族,第8、9、10三列是Ⅷ族,不是ⅧB族;含元素种类最多的族是ⅢB族,共有32种元素。
(3)过渡元素包括7个副族和第Ⅷ族,全部都是金属元素,原子最外层电子数不超过2个(1~2个)。
(4)最外层电子数为3~7个的原子一定属于主族元素,且最外层电子数即为主族的族序数。
(5)同一周期ⅡA族与ⅢA族元素的原子序数可能相差1(2、3周期)或11(4、5周期)或25(6、7周期)。
(6)过渡元素:元素周期表中从ⅢB族到ⅡB族10列共六十多种元素,这些元素都是金属元素。
(7)镧系:元素周期表第六周期中,57号元素镧到71号元素镥,共15种元素。
(8)锕系:元素周期表第七周期中,89号元素锕到103号元素铹,共15种元素。
(9)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
细剖精析·易混不混·易错不错
1.H、H、H与16O、17O、18O能组成___种不同的水分子?
【细剖精析】
18种。H、H、H之间有两种结合方式,相同核素自身结合有三种:H2、H2、H2。三种不同核素相互结合又有三种:HH、HH、HH。这六种再分别与16O、17O、18O组合,共18种。(1)H216O、H216O、H216O。HH16O、HH16O、HH16O。;(2)H217O、H217O、H217O。HH17O、HH17O、HH17O。;(3)H218O、H218O、H218O。HH18O、HH18O、HH18O。。
2.有5种单核粒子,它们分别是、、+、2+、(“”内元素符号未写出),则它们所属元素的种类有___种。
【细剖精析】
3种。元素的种类由质子数(或核电荷数)决定。5种单核粒子中,有三种不同的质子数,分别为:18、19、20三种,所以共有三种不同的元素。
3.1H、2H、3H三种微粒都属于___,因为它们是具有相同___的同一类原子。
【细剖精析】
氢元素,质子数。
4.在H、H、H、C、C、C、N、N中,核素、元素的种数分别为___种、___种。
【细剖精析】
8,3。上面所列的每个粒子都是一种核素,共有8种。其中质子数有三种分别为1、6、7。所以有三种不同的元素。
5.C、C、C的关系为___,因为它们是具有___的同一元素的不同原子,它们的化学性质几乎完全相同。
【细剖精析】
同位素,相同的质子数和不同的中子数
6.所有的原子中都含有质子和中子吗?符号C表示的含义是什么?
【细剖精析】
H中不含有中子,所有原子均含有质子;C表示质子数为6,中子数为6的碳原子。
7.质子数相同的微粒一定属于同一种元素吗?
【细剖精析】
不一定。质子数相同的粒子不一定属于同种元素,如Ne和H2O。
8.同主族从上到下,酸性:HF>HCl>HBr,这种比较方法正确吗?
【细剖精析】
不正确。同主族从上到下,非金属性减弱,其最高价氧化物对应水化物的酸性减弱。酸性:HClO4>HBrO4,而氢化物的酸性:HF
【细剖精析】
不能。因为硫的最高价氧化物对应的水化物是H2SO4不是H2SO3,氯的最高价氧化物对应的水化物是HClO4不是HClO。应根据元素的最高价氧化物对应的水化物的酸性强弱比较其非金属性强弱。
10.(1)任何原子内都有中子吗?
【细剖精析】
H中无中子。
(2)同位素的性质相同吗?
【细剖精析】
同位素的物理性质有差异,化学性质几乎完全相同。
11.核外电子排布的各条规律之间有怎样的关系?以19号元素K的原子结构示意图不能写成为例来说明。
【细剖精析】
核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条。第(3)、(4)条是对第(2)条的限制。如钾原子由于受第(3)条限制,最外层不能超过8个,故原子结构示意图为。
12.“核外电子排布相同的微粒,化学性质相同”这一说法是否正确?
【细剖精析】
不正确。核外电子排布相同可以是多种离子或原子,如S2-、Cl-、Ar、K+、Ca2+的核外电子排布都是,但它们的化学性质不同。若属于同位素的不同核素,化学性质相同,如H、H、H。
13.最外层只有一个电子的元素是否都是碱金属元素?
【细剖精析】
不是,氢元素原子最外层也只有1个电子,但是碱金属元素不包括氢元素。
对点训练
一、原子结构与核素
1.(2021·泉州现代中学高一期中)下列有关原子核外电子的说法错误的是
A.每个电子层作为最外层时,最多可容纳8个电子
B.电子在核外是分层排布的
C.电子不停地做高速运动
D.离原子核近的电子能量低,离原子核远的电子能量高
【答案】A
【解析】
A.第一个电子层作为最外层时,最多可容纳2个电子,如氦原子,故A错误;
B.电子在原子中处于不同的能量状态,按照能量不同分层排布,故B正确;
C.原子核外的电子,在核外不停的作无规则高速移动,故C正确;
D.原子核外区域能量可能不同,距核由近到远,能量由低到高,即离原子核近的电子能量低,离核远的电子能量高,故D正确;
故选A。
2.(2021·全国高一课时练习)元素的原子最外层电子得到或失去后,一定不会改变的是
①元素种类;②化学性质;③相对原子质量;④微粒电性;⑤原子核;⑥电子层数;⑦最外层电子数;⑧核外电子总数。
A.②③⑤ B.②④⑥⑧ C.②⑤ D.①③⑤
【答案】D
【解析】
元素的原子最外层电子得到或失去后:①元素种类不变;②化学性质发生改变;③相对原子质量与电子数无关,不会改变;④变成阳离子或阴离子,微粒的电性发生改变;⑤原子核不会发生改变;⑥原子失去最外层电子,电子层数减少;⑦最外层电子数一定会变;⑧核外电子总数一定会变;综上所述,元素的原子最外层电子得到或失去后,一定不会改变的是①元素种类、③相对原子质量、⑤原子核,答案选D。
3.(2021·全国高一课时练习)下列各组微粒中,各电子层上的电子数均为2n2的是
A.He与H B.F与Na+ C.Ne与Ar D.He与Mg2+
【答案】D
【解析】
A.H原子的最外层电子为1个,不满足2n2,A项错误;
B.F原子的最外层电子为7个,不满足2n2,B项错误;
C.Ar原子的第三层电子数为8个,不满足2n2,C项错误;
D.He只有一层,且电子数为2个,满足2n2,Mg2+有两层电子,分别为2和8,满足2n2,D项正确;
答案选D。
4.(2021·全国高一课时练习)具有相同电子数的微粒,其相互关系
A.一定是同位素 B.一定是同种原子 C.一定是同种分子 D.不能确定
【答案】D
【解析】
A.同位素是质子数相同但中子数不同的同种元素的不同原子之间的互称,铵根和氢氧根是具有相同电子数的微粒,但不互为同位素,A项错误;
B.铵根和氢氧根是具有相同电子数的微粒,但不是同种原子,B项错误;
C.铵根和氢氧根是具有相同电子数的微粒,但不是同种分子,C项错误;
D.具有相同电子数的微粒可以是同种分子,也可以是同种原子,也可以是不同的离子,则不能确定,D项正确;
答案选D。
5.(2021·全国高一课时练习)一种粒子的质子数和电子数与另一种粒子的质子数和电子数相等,则下列关于两种粒子之间的关系说法错误的是
A.它们可能是同位素 B.可能是不同分子
C.可能是相同的原子 D.可能是一种分子和一种离子
【答案】D
【解析】
A.同位素是质子数相同,中子数不同的核素,因此同位素之间的质子数和电子数相等,A正确;
B.H2O和NH3均有10个电子和10个质子,因此可以是不同分子,B正确;
C.相同的原子的质子数和电子数都相等,C正确;
D.离子中质子数和电子数不相等,分子中质子数和电子数相等,若分子和离子的质子数相等,则电子数一定不相等,D错误;
故选D。
6.(2021·全国高一课时练习)下列关于核外电子层结构的说法中错误的是
A.N层为最外层时,最多只可容纳8个电子 B.N层为最外层时,最多只可容纳18个电子
C.不管L层是否是最外层,最多可容纳8个电子 D.K层,最多只可容纳2个电子
【答案】B
【解析】
A.除K层外,当其它电子层为最外层时,最多只可容纳8个电子,A正确;
B.N层是第4层,原子核外最多容纳32个电子,由于原子核外最外层是8个电子时是稳定结构,故当其为最外层时,最多只可容纳8个电子,B错误;
C.L层是第2电子层,最多容纳8个电子,当其为最外层时,最多容纳8个电子,因此不管L层是否是最外层,最多可容纳8个电子,C正确;
D.K层是原子核外的第1电子层,最多只可容纳2个电子,D正确;
故合理选项是B。
7.(2021·全国)现有下列几组粒子:①N2、CO;②NH、OH-;③O、CN-;④PO、ClO。对上述四组粒子归类正确的是
A.①中质子数相等、电子数和原子数不相等 B.②中质子数和电子数相等、原子数不相等
C.③中电子数相等、质子数和原子数不相等 D.④中原子数和电子数相等、质子数不相等
【答案】D
【解析】
A.①中N2、CO的质子数和电子数都等于14,原子数均为2,A错误;
B.②中NH、OH-的原子数和质子数不相等,电子数都为10,B错误;
C.③中O、CN-的原子数相等,O中含有18个电子和16个质子,CN-中含有14个电子和13个质子,电子数和质子数不同,C错误;
D.④中P、Cl所含的电子数分别为15、17,酸根离子中所含原子数都为5,所含的总电子数均为50个,电子数相等,两种酸根离子的质子数不相等,D正确;
答案为:D。
8.(2022·重庆巴蜀中学)化学与生产、生活、科技息息相关,下列说法不正确的是
A.飞沫传播病毒存在气溶胶,医用口罩对微小带病毒气溶胶有过滤隔离效果
B.2020年12月17日凌晨,嫦娥五号携带回的月壤样本中含有珍贵的,与互为同素异形体
C.核酸检测是确认病毒类型的有效手段,核酸是高分子化合物
D.华为首款5G手机搭载的智能制程“麒麟980”手机芯片的主要成分是晶体硅
【答案】B
【解析】
A.飞沫传播病毒存在气溶胶,医用口罩中间层熔喷无纺布对微小带病毒气溶胶有过滤隔离效果,故A正确;
B.与互为同位素,故B错误;
C.核酸是由许多核苷酸聚合成的生物大分子化合物,属于高分子化合物,故C正确;
D.硅属于半导体材料,可以用于制造芯片,则手机芯片的主要成分是晶体硅,故D正确;
故选B。
9.(2021·河南)钷广泛用于量规、光电池等。的最外层电子数是2,下列说法不正确的是
A.的原子核外有61个电子 B.与互为同位素
C.属于金属元素 D.的中子数为147
【答案】D
【解析】
A.原子的质子数等于核外电子数,故的原子核外有61个电子,故A正确;
B.与的质子数相同、中子数不同,故互为同位素,故B正确;
C.属于金属元素,故C正确;
D.的中子数为147-61=86,故D错误;
故选D。
10.(2021·四川省武胜烈面中学校高二开学考试)下列说法正确的是
A.与互为同位素 B.与性质完全相同
C.位于周期表中第六周期 D.的质子数为78
【答案】A
【解析】
A. 与的质子数均为53,质量数不同则中子数不同,故互为同位素,A正确;
B. 与的质子数相同、因此原子核外电子数也相同、化学性质相同,而质量数等性质有所不同,因此性质不完全相同,B错误;
C.第六周期最后一个元素Rn原子序数为86。的原子序数为94,则Pu位于周期表中第七周期,C错误;
D. 的质子数为53、中子数=131-53=78,D错误;
答案选A。
11.(2021·全国高三)2021年,我国发布了《医用同位素中长期发展规划》,对提升医用同位素相关产业能力水平、保障健康中国战略实施具有重要意义。医用同位素有14C、18F、131I等。有关说法正确的是
A.14C位于元素周期表的第二周期第ⅥA族
B.18F和131I具有相同的最外层电子数
C.14C与12C的性质完全相同
D.化合物23Na131I的中子总数为奇数
【答案】B
【解析】
A.C原子序数为6,位于元素周期表的第二周期第ⅣA族,故A错误;
B.F和I 属于第ⅦA族,最外层电子数相同,故B正确;
C. 14C与12C的化学性质几乎完全相同,但物理性质有差异,故C错误;
D. 23Na131I 的中子总数为(23-11)+(131-53),不为奇数,故D错误。
故选B。
12.(2021·绥德中学高一月考)长期依赖进口、价格昂贵的物质在我国科学家的攻关下,终于成功地研制出了。下列说法正确的是
A.与互为同位素 B.与是中子数相同
C.和化学性质不相同 D.和互为同素异形体
【答案】A
【解析】
A.与的质子数都为8,中子数分别为16-8=8,18-8=10,即质子数相同,中子数不同,两者互为同位素,选项A正确;
B.与的质子数都为8,中子数分别为16-8=8,18-8=10,选项B错误;
C.和互为同位素,都具有8个质子和8个核外电子,处于周期表中同一位置上,化学性质基本相同,选项C错误;
D.与的质子数都为8,中子数分别为16-8=8,18-8=10,即质子数相同,中子数不同,两者互为同位素,选项D错误;
答案选A。
二、元素周期表及应用
1.(2020·宝山区·上海交大附中高二期中)下列个表是元素周期表中的一部分,表中数字表示的是原子序号与其在周期表中的位置相符合的是
A. B.
C. D.
【答案】D
【解析】
A.1号元素和2号元素不应只隔1纵行,且1号元素与11号元素之间还应有一横行,A错误;
B.4号元素(Be)和13号元素(Al)中间应隔有10纵行过渡元素,B错误;
C.10号元素(Ne)为0族元素,不和15、16号元素在同一周期,C错误;
D.中列为9、17、35,中行为16、17、18,符合位置关系,D正确;
故答案为:D。
2.(2022·怀仁市大地学校高中部高一月考)为纪念元素周期表诞生150周年,联合国宣布2019年为“元素周期表年”。硅是第14号元素,如图是硅元素在元素周期表中的相关信息,下列说法正确的是
A.硅元素属于金属元素 B.硅元素的相对原子质量为28.09g
C.SiO2中硅元素的化合价为+4 D.硅元素是地壳中含量最高的元素
【答案】C
【解析】
A.硅元素属于非金属元素,A错误;
B.硅元素的相对原子质量为28.09,B错误;
C.由化合价规则知,二氧化硅中硅呈+4价,C正确;
D.氧元素是地壳中含量最高的元素、硅在地壳中含量占第二位,D错误;
答案选C。
3.(2021·新疆伊犁哈萨克自治州·高一期末)下列关于元素周期表说法正确的是
A.元素周期表中最外层电子数为2的元素一定在第ⅡA族
B.在过渡元素中找优良催化剂和耐高温、耐腐蚀的合金材料
C.元素所在族序数等于元素原子最外层电子数
D.元素周期表有七个横行,分为七个周期,有18个纵行,分为18个族
【答案】B
【解析】
A.元素周期表中最外层电子数为2的元素不一定在ⅡA族,如氦元素的最外层电子数为2,但位于元素周期表0族,故A错误;
B.副族和Ⅷ族统称为过渡元素,在过渡元素中可以找优良催化剂和耐高温、耐腐蚀的合金材料,故B正确;
C.副族元素和Ⅷ族所在族序数不等于元素原子最外层电子数,故C错误;
D.元素周期表有七个横行,分为七个周期,有18个纵行,分为主族、副族、Ⅷ族和0族共16个族,故D错误;
故选B。
4.(2021·江苏高一开学考试)下列关于元素周期表的叙述正确的是
A.在元素周期表中共有18个纵行,18个族 B.同族元素的最外层电子数一定相同
C.同周期元素的电子层数相同 D.元素周期表有7个周期,8个主族
【答案】C
【解析】
A.周期表共有18个纵行,16个族,其中第Ⅷ族包括第8、9、10三个纵行,A项错误;
B.对于0族元素、副族元素及第Ⅷ族元素来说,同族元素原子的最外层电子数不一定相同,B项错误;
C.同周期元素具有相同的电子层数,C项正确;
D.元素周期表有7个周期,7个主族,D项错误;
答案选C。
5.(2021·黑龙江高二期末)已知元素周期表中前七周期排满后的元素种类和周期序数的关系如下所示:
周期数
一
二
三
四
五
六
七
元素种类
2种
8种
8种
18种
18种
32种
32种
预测第八周期最多可能含有的元素种类为
A.18种 B.32种 C.50种 D.64种
【答案】C
【解析】
第八周期元素原子核外有8个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、50、32、18、8,原子序数为168;第七周期元素原子核外有7个电子层,根据排布规律,最后一种元素各层电子数为2、8、18、32、32、18、8,原子序数为118,则第八周期元素种类数为168-118=50,C选项符合题意;答案为C。
6.(2021·张家口市第一中学)下列关于元素周期表的叙述正确的是
A.周期表中有八个主族,八个副族
B.目前使用的元素周期表中,最长的周期含有32种元素
C.短周期元素是指1~20号元素
D.原子的最外层电子数都等于该元素所在的族序数
【答案】B
【解析】
A.周期表中7个主族、8个副族,1个0族、共16个族,A错误;
B.一至七周期元素的种类为2、8、8、18、18、32、32,目前使用的元素周期表中最长的周期(第六、七周期)含有32种元素,B正确;
C.短周期为一至三周期,是指1-18号元素,C错误;
D.主族元素的最外层电子数都等于该元素所在的族序数,副族和0族元素不一定,D错误;
故选B。
7.(2021·全国高一课时练习)已知三种元素,其原子最外层电子数之和为17,核内质子数之和为31,满足上述条件的一组元素是
A.N P Cl B.P O S C.N O S D.O P Cl
【答案】C
【解析】
A.N、P、Cl三种元素原子的最外层电子数为17,但原子核内质子数为39,A不符合题意;
B.P、O、S三种元素原子的最外层电子数为17,但原子核内质子数为39,B不符合题意;
C.N、O、S三种元素原子的最外层电子数为17,原子核内质子数为31,C符合题意;
D.O、P、Cl 三种元素原子的最外层电子数为18,但原子核内质子数为40,D不符合题意;
故合理选项是C。
8.(2021·四川省绵阳江油中学高一月考)A、B、C均为短周期的元素,它们在周期表的位置如图。已知:B、C元素的原子序数之和是A元素的原子序数的4倍,则A、B、C分别是
A.Be、Na、Al B.O、P、Cl C.P、O、Cl D.C、Al、P
【答案】B
【解析】
假设A的原子序数是x,则根据元素在周期表的相对位置可知:B的原子序数是(x+8-1),C的原子序数是(x+8+1)。由于B、C元素的原子序数之和是A元素的原子序数的4倍,所以4x=(x+8-1)+(x+8+1),解得x=8,所以x+8-1=15,x+8+1=17,因此A是O元素,B是P元素,C是Cl元素,故合理选项是B。
9.(2021·上海高二课时练习)A、B两元素能以共价键结合成AB2型化合物分子,A和B在周期表中所属族数是
A.IA和VA B.IVA和VIA C.IIA和VIA D.IA和VIIA
【答案】B
【解析】
化学式为AB2型的分子中,A的化合价可能为+2或+4价,为IIA或IVA,B的化合价可能为-1或-2价,最高化合价为+7或+6,为VIIA或VIA,组合可能为IIA和VIIA、IVA和VIA,故选:B。
10.(2021·上海高二课时练习)下列说法正确的是
A.非金属元素全部是短周期元素
B.原子核外电子层数与最外层电子数相等的元素一定是金属元素
C.最外层只有2个电子的元素一定是金属元素
D.过渡元素全部是金属元素
【答案】D
【解析】
A.非金属元素不一定是短周期元素,如Br、I等,故A错误;
B.原子核外电子层数与最外层电子数相等的元素不一定是金属元素,如H元素,故B错误;
C.最外层只有2个电子的元素不一定是金属元素,如He元素,故C错误;
D.过渡元素即是所有副族和Ⅷ族元素全部是金属元素,故D正确;
故选D。
11.(2019·罗平县第二中学)甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能为
A.x+2 B.x+4 C.x+32 D.x+18
【答案】B
【解析】
由元素周期表结构,对于处于ⅠA、ⅡA元素而言,同主族原子序数之差为上一周期元素的种类数;对于其他主族,同主族原子序数之差为下一周期元素的种类数,同一主族不同周期的元素,原子序数相差可能为2、8、18、32等或它们的组合,如10、26、34等,不可能相差4,即乙原子序数不可能为x+4;
答案选B。
三、原子结构与元素的性质
1.(2020·赤峰二中)下列说法正确的是( )
A.碱金属单质Li、Na、K性质活泼,均可以保存在煤油中
B.碱金属单质Li、Na、K的熔沸点逐渐升高
C.F-、Cl-、Br-、I-的还原性逐渐增强
D.HF、HCl、HBr、HI的沸点逐渐升高
【答案】C
【解析】
A.Li单质密度较煤油小,因此不能保存在煤油中,一般保存在石蜡中,故A错误;
B.碱金属单质的熔点、沸点均随着原子序数的递增而降低,故B错误;
C.F2、Cl2、Br2、I2的氧化性逐渐减弱,其对应简单离子的还原性逐渐增强,故C正确;
D.HF中存在分子间氢键,沸点较高,高于HI,故D错误;
故答案为:C。
2.(2019·全国)下列有关碱金属元素、卤素原子结构和性质描述正确的是( )
①随着核电荷数的增加,碱金属单质、卤素单质的熔、沸点依次升高,密度依次增大
②F、Cl、Br、I的原子核外最外层电子数都是7,次外层电子数都是8
③碱金属单质的还原性很强,均易与氧气发生反应,加热时生成氧化物R2O
④砹是原子序数最大的卤族元素,根据卤素性质的递变规律,At与H2化合最容易
⑤根据HF、HCl、HBr、HI的稳定性逐渐减弱的事实,推出F、Cl、Br、I的非金属性逐渐增强的规律
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序,非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大,得电子能力减弱
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A.全部正确 B.⑦⑧
C.①③⑤⑥⑦ D.①③⑦⑧
【答案】B
【解析】
①随着核电荷数的增大,碱金属单质的熔、沸点逐渐降低,密度呈增大趋势(K异常),而卤素单质的熔、沸点依次升高,密度依次增大,错误;
②F、Cl、Br、I的原子核外最外层电子数都是7,次外层电子数分别为2、8、18、18,错误;
③碱金属单质的还原性很强,均易与氧气发生反应,加热时除Li生成Li2O外,其他碱金属生成过氧化物或超氧化物,错误;
④根据卤素单质性质的递变规律,At与H2化合最不容易,错误;
⑤根据HF、HCl、HBr、HI的稳定性逐渐减弱的事实,推出F、Cl、Br、I的非金属性逐渐减弱的规律,错误:
⑥碱金属中Li的密度比煤油小,要保存在液体石蜡中,其余碱金属的密度比煤油大,应保存在煤油中,错误;
⑦卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大,原子获得电子的能力逐渐减弱,正确;
⑧Na2CO3不易分解,根据碱金属元素化学性质的相似性可知,碳酸铯不易发生分解反应生成氧化铯和二氧化碳,正确。
答案为B
3.(2020·七台河市第一中学高一期中)天然存在的Fr(钫)极微量,它的 21种同位素都有放射性,它是碱金属中最重的元素,根据它在周期表中的位置预言其性质,其中不正确的是
A.在已知碱金属中它具有最多的电子层 B.在空气中燃烧的时候,生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱 D.单质的熔点不如Na的高
【答案】B
【解析】分析:A.依据同主族元素从上到下电子层数依次递增解答;
B.依据同主族元素从上到下金属性依次递增解答;
C.元素金属性越强,氧化物对应水化物的碱性越强;
D.依据同主族金属元素熔点从上到下依次的降低的规律解答。
解析:A.钫与钠、钾同主族,位于第七周期,所以在已知碱金属中它具有最多的电子层,A正确;
B.钫的活泼性强于钠和钾,钠在空气中燃烧生成过氧化钠,钾在空气中燃烧生成超氧化钾,所以钫在空气中燃烧时生成更复杂的氧化物,B错误;
C.同主族元素金属性从上到下依次增强,钫位于第ⅠA族的最下方,所以其金属性最强,则氧化物对应的水化物碱性极强,C正确;
D.同主族金属元素熔点从上到下依次的降低,D正确;答案选B。
4.(2021·四川省绵阳江油中学高一月考)下列关于卤族元素(X)及其化合物叙述错误的是
A.单质均有颜色,随原子序数递增颜色加深
B.HX随原子序数递增稳定性逐渐减弱
C.单质均能与水反应形成HX和HXO
D.HX中除HF分子间存在氢键,其余HX分子均不存在氢键
【答案】C
【解析】
A.卤族元素的单质的颜色从上到下为浅黄绿色、黄绿色、深红棕色、紫黑色,颜色逐渐加深,A正确;
B.非金属性越强,其氢化物越稳定,同主族从上到下非金属性减弱,即HX随着原子序数递增,稳定性逐渐减弱,B正确;
C.F2与水反应生成HF和O2,C错误;
D.F的非金属性极强,HF分子间存在氢键,其余HX不存在分子间氢键,D正确;
综上所述答案为C。
5.(2021·全国高一课时练习)砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,不正确的是
A.与H2化合的能力:At2
【答案】B
【解析】
A.同主族从上到下,单质和氢气化合越来越不容易,所以与H2化合的能力:At2<I2,故A正确;
B.同主族从上到下元素的单质从气态、液态、固态变化,且颜色加深,碘为紫黑色固体,则砹是黑色固体,故B错误;
C.由碘易溶于有机溶剂,则砹易溶于某些有机溶剂,也是不易溶于水的,故C正确;
D.同主族元素原子具有相等的最外层电子数,即砹原子的最外层有7个电子,故D正确;
故选B。
6.(2021·全国)卤族元素是最活泼的一族非金属元素,下列关于卤族元素的说法正确的是
A.从上到下卤素单质的氧化性增强
B.从上到下,卤素原子的电子层数依次增多,原子半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱
D.卤素单质与H2化合的难易程度为F2
【解析】
A.从上到下元素的原子半径逐渐增大,得电子能力逐渐减弱,所以卤素单质的氧化性逐渐减弱,故A错;
B.从上到下,卤素原子的电子层数依次增多,原子半径依次增大,故B错;
C.从F到I,原子的半径逐渐增大,原子核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故C正确;
D.从F到I,非金属性逐渐减弱,与氢气化合易程度为F2>Cl2>Br2>I2,故D错;
答案选C。
提升训练
一、选择题
1.日本政府于2021年4月13日召开会议,决定在未来2年内将核电站产生的核废水分批排入大海,核废水中包含63种放射性物质,其中可导致白血病,下列有关说法不正确的是
A.的质子数为38
B.内中子数和核外电子数之差为11
C.和互为同位素
D.转变为属于物理变化
【答案】B
【解析】
A.左下角表示质子数,则的质子数为38,A正确;
B.内中子数和核外电子数之差为90-38-38=14,B错误;
C.和的质子数相同,质量数不同,二者互为同位素,C正确;
D.转变过程是没有产生新物质,为属于物理变化,D正确;
答案选B。
2.简单原子的原子结构可用图表示方法形象地表示:
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同位素 B.①②③互为同素异形体
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
【答案】A
【分析】
●表示质子或电子,○表示中子,则三种微粒分别是、、,所以三种微粒互为同位素,是氢元素的三种核素,据此分析解题。
【解析】
A.①②③互为同位素,选项A正确;
B. ①②③是三种不同的核素,属于同一元素,选项B错误;
C. ①②③是三种化学性质相同的微粒,选项C错误;
D. ①②③具有相同的质子数,质量数分别为1、2、3,不相同,选项D错误;
答案选A。
3.卢瑟福利用核反应发现。下列说法正确的是
A.该反应是化学反应 B.和互为同位素
C.该反应涉及的主族元素有3种 D.的中子数为17
【答案】C
【解析】
A.该反应中没有化学键的断裂和形成,不是化学反应,A错误;
B.和不是同种元素不是互为同位素,B错误;
C.该反应涉及的主族元素有3种分别是N、O、H,C正确;
D.的中子数为17-8=9,D错误;
答案选C。
4.质子数和中子数之和为A,核内中子数为N的R2+与16O所形成的W g氧化物中所含质子的物质的量为
A. (A-N+8) mol B. (A-N+10) mol
C.(A-N+8) mol D. (A-N+6) mol
【答案】A
【解析】
R2+带2个单位正电荷,所以其氧化物的化学式为RO,该氧化物的摩尔质量为(A+16) g·mol-1,W g该氧化物的物质的量为mol;核内中子数为N的R2+的质量数为A,所以质子数为A-N,1 mol氧化物中含有(A-N+8) mol质子,所以W g该氧化物中所含质子的物质的量为(A-N+8) mol,综上所述A符合题意,故选A;
答案选A。
5.设NA表示阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,3.2g14C18O中含中子数为1.8NA
B.常温常压下,4.6gNO2和N2O4混合气体中含有的氧原子数目为0.2NA
C.78gNa2S和Na2O2的混合物中含有阴离子数等于NA
D.235g核素U发生裂变反应:U+n+Xe+10n,净产生的中子(n)数为10NA
【答案】D
【解析】
A.3.2g14C18O中含中子数为1.8NA,故A正确;
B.NO2和N2O4最简式都是NO2, 4.6gNO2和N2O4混合气体中含有的氧原子数目为0.2NA,故B正确;
C.Na2S和Na2O2的相对分子质量都是78,且阴阳离子之比均为1:2,78gNa2S和Na2O2的混合物中含有阴离子数为NA,故C正确
D.235g核素U的物质的量是1mol,发生裂变反应:U+n+Xe+10n,净产生的中子(n)数为9NA,故D错误;
选D。
6.下列关于元素周期表的说法正确的是
A.金属元素都在长周期 B.每一主族中都有非金属元素
C.每一族只包含一个纵列 D.前三个周期为短周期,其余为长周期
【答案】D
【解析】
A.有几种金属元素例如Li元素在短周期,A错误;
B.第ⅡA没有非金属元素,B错误;
C.Ⅷ族有3个纵列,C错误;
D.短周期为一、二、三周期,其他为长周期,D正确;
答案选D。
7.下列关于原子结构的说法有误的是
A.原子的种类由质子数和中子数决定
B.可发生核聚变反应是化学变化
C.在原子结构分层排布中,M层(第三层)容纳电子数最多为18
D.在化学反应过程中,原子核不发生变化,但原子外层电子可能发生变化
【答案】B
【解析】
A.同种元素的质子数相同,同种元素的原子由于中子数不同而形成不同的核素,所以原子的种类由质子数和中子数决定,故A正确;
B.可发生核聚变反应,原子核发生变化,是核变化,故B错误;
C.在原子结构分层排布中,每个电子层最多容纳2n2电子,则M层(第三层)容纳电子数最多为18,故C正确;
D.化学变化中最小的微粒是原子,在化学反应过程中,原子核不发生变化,氧化还原反应中氧化剂得电子,还原剂失电子,原子外层电子可能发生变化,故D正确;
故选B。
8.1869年,俄国化学家门捷列夫制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一,随着人们对科学的认识不断深入,终于使门捷列夫元素周期表变得完整。下图是元素周期表的一部分,请回答下列问题:
①
②
③
④
⑤
⑥
⑦
⑧
⑨
元素④在周期表中的位置是
A.第二周期ⅢA族 B.第二周期ⅣA族
C.第二周期ⅤA族 D.第二周期ⅥA族
【答案】D
【解析】
由图可知,元素④位于元素周期表第二周期ⅥA族,故选D。
9.X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和Z同主族,三种元素原子的核内质子数之和为31,则X、Y、Z是
A.C、Na、Si B.C、Mg、Al C.N、O、S D.P、S、O
【答案】C
【解析】
A.若X、Y、Z是C、Na、Si,则C、Na是两个不同周期元素,且不相邻,Na、Si也不是同一主族元素,A不符合题意;
B.若X、Y、Z是C、Mg、Al,C、Mg是两个不同周期的元素,且不相邻,而Mg、Al是同一周期相邻元素,不是同一主族元素,B不符合题意;
C.若X、Y、Z是N、O、S,则N、O是同一周期相邻元素,O、S是同一主族元素,且三种元素的原子的核内质子数之和为31,C符合题意;
D.P、S、O三种元素原子序数的和是39,由于原子序数等于原子核内质子数,故三种元素原子核内质子数之和为39,D不符合题意;
故合理选项是C。
10.部分元素在周期表中的分布如图所示(虚线为金属元素与非金属元素的分界线),下列说法不正确的是
A.虚线左侧是金属元素 B.At处于第六周期ⅥA族
C.Si、Ge可作半导体材料 D.As既有金属性又有非金属性
【答案】B
【解析】
A.由周期表的结构可知,位于金属元素与非金属元素的分界线左侧的元素是金属元素,右侧的是非金属元素,故A正确;
B.At元素的原子序数为85,位于元素周期表第六周期ⅦA族,故B错误;
C.由周期表的结构可知,位于金属元素与非金属元素的分界线附近的Si、Ge可作半导体材料,故C正确;
D.由周期表的结构可知,位于金属元素与非金属元素的分界线附近的As元素既有金属性又有非金属性,故D正确;
故选B。
11.下列叙述中正确的是
A.除零族元素外,原子最外层电子数都等于该元素所属的族序数
B.各主族元素都是由金属元素和非金属元素组成的
C.过渡元素包括副族元素和第VIII族元素
D.ⅠA、IIA族的元素全部是金属元素,均能与酸发生反应生成氢气
【答案】C
【解析】
A.除零族元素外,短周期元素原子的最外层电子数等于该元素所属的主族序数,故A错误;
B.不是各主族元素都是由金属元素和非金属元素组成的,比如第ⅡA元素中无非金属元素,故B错误;
C.过渡元素包括七个副族元素和第VIII族元素,故C正确;
D.ⅠA、IIA族的元素除氢元素以外全部是金属元素,均能与酸发生反应生成氢气,故D错误;
故选C。
12.已知X原子的结构示意图如图,则X在元素周期表中的位置是
A.第二周期VIIIA族 B.第四周期IA族
C.第三周期0族 D.第三周期VIIA族
【答案】C
【解析】
由X原子的结构示意图可知,X原子的核电荷数为18,核外有3个电子层,最外层有8个电子,则X为Ar元素,位于元素周期表第三周期0族,故选C。
13.2018年IUPAC(国际纯粹与应用化学联合会)制作了新版周期表,包含118种元素。下列有关元素周期表说法正确的是
A.元素周期表中只有第ⅡA元素原子最外层电子数为2
B.元素周期表有18个族
C.第ⅠA族的元素全部是金属元素
D.元素周期表中含元素种类最多的族是第ⅢB族
【答案】D
【解析】
A.He最外层有2个电子,但属于稀有气体元素,在0族,故A错误;
B.元素周期表有7个主族、7个副族、1个0族和1个VIII族,共16个族,故C错误;
C.第ⅠA族的H元素是非金属,故C错误;
D.元素周期表中含元素种类最多的族为ⅢB族,含锕系和镧系元素,故D正确。
故选D。
14.下列叙述错误的是
A.H2O和D2O均由氢元素和氧元素组成,它们互为同素异形体
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.六种微粒、、、、、,它们所属元素的种类是3种
【答案】A
【解析】
A.H2O和D2O均由氢元素和氧元素组成,均是水分子,同素异形体是指由同一种元素形成的不同单质,故A错误;
B.1H和2H是不同的核素,它们的质子数相等都为1,故B正确;
C.14C和14N的质量数相等,都是14,它们的中子数不等,分别是8和7,故C正确;
D.元素是指具有相同的核电荷数(核内质子数)的一类原子的总称,六种微粒、、、、、,它们所属元素的种类是3种,分别是Ar、K、Ca,故D正确;
故选A。
15.关于元素周期表的说法正确的是
A.第IA族的元素都为金属元素
B.同主族元素相差的原子序数可能为16、26、36、46
C.同周期IA族和ⅢIA族原子序数差可能为1、11、25
D.元期表中有7个主族,7个副族,一个0族,一个VIII族,共16个族16个纵行
【答案】C
【解析】
A.第ⅠA族的元素除H元素外,其他元素都是金属元素,故A错误;
B.在元素周期表中,第一周期共有2种元素,第二周期共有8种元素,第三周期共有8种元素,第四周期共有18种元素,第五周期共有18种元素,第六周期共有32种元素,第七周期共有32种元素,故主族元素相差的原子序数可能为2或8或18或32,不可能为16、26、36、46,故B错误;
C.同周期ⅡA族和ⅢA族原子序数差可能为1、11、25,若两种原子均位于第二周期Be和B的原子序数相差1,若两种原子均位于第三周期,Mg和Al的原子序数相差1,若两种原子均位于第四周期,Ca和Ga的原子序数相差11,若两种原子均位于第五周期,Sr和In的原子序数相差11,若两种原子均位于第六周期,Ba和Tl的原子序数相差25,故C正确;
D.周期表中有7个主族,7个副族,1个0族,1个Ⅷ族,共16个族,由于第Ⅷ族占3个纵行,故元素周期表有18个纵行,故D错误;
故选C。
16.下列关于原子结构及微粒间的数量关系的说法正确的是
A.同种元素的原子均有相同的质子数和中子数
B.微粒Na+、Mg2+、O2-具有相同的电子层结构
C.某元素原子的最外层只有2个电子,则该元素一定是金属元素
D.Ca2+的质子数比核外电子数少2
【答案】B
【解析】
A.同种元素的原子均有相同的质子数,但中子数不一定相同,A错误;
B.微粒Na+、Mg2+、O2-核外电子排布是2、8,三种微粒具有相同的电子层结构,B正确;
C.某元素原子的最外层只有2个电子,该元素可能是He,也可能是Be,因此该元素不一定是金属元素,C错误;
D.Ca是20号元素,Ca2+的质子数是20,离子的核外电子数是18,故质子数比核外电子数多2个,D错误;
故合理选项是B。
77.已知碳有三种核素 12C、13C、14C,氧元素也有三种核素 16O、17O、18O,则由以上核素形成的不同CO2分子的相对分子质量有
A.18种 B.8种 C.9种 D.7种
【答案】D
【解析】
碳元素有12C、13C、14C;氧元素有16O、17O、18O,选任意的两种O原子与C原子组合,根据数学组合可知,它们能够形成3×3×(3-1)=18种CO2分子,由12C、13C、14C、16O、17O、18O组成的CO2分子有:12C16O2,12C17O2,12C18O2,13C16O2,13C17O2,13C18O2,14C16O2,14C17O2,14C18O2,12C16O17O,12C16O18O,12C17O18O,13C16O17O,13C16O18O,13C17O18O,14C16O17O,14C16O18O,14C17O18O,共18种,相对分子质量从44到50,共7种不同的相对分子质量。
故选:D。
18.下列有关碱金属、卤素原子结构和性质的描述,正确的个数为
①随着核电荷数的增加,碱金属单质的熔、沸点依次升高,密度依次增大
②、、、的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成的氧化物形式为
④根据同族元素性质的递变规律推测,与化合较难,破化银也难溶于水
⑤根据、、的非金属性依次减弱,可推出、、的酸性依次减弱
⑥碱金属都应保存在煤油中
⑦卤素按、、、的顺序非金属性逐渐减弱的原因是随着核电荷数的增加,电子层数增多,原子半径增大
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A.2 B.3 C.4 D.5
【答案】B
【解析】
①碱金属单质的熔、沸点随着原子序数的递增而降低,碱金属单质的密度随着原子序数的递增呈增大趋势(例外),故①错误;
②是9号元素,原子次外层电子数为2,最外层电子数为7,、、的最外层电子数都是7,次外层电子数分别是8、18、18,故②错误;
③碱金属单质的金属性很强,均易与氧气发生反应,加热时,锂生成氧化锂,钠生成过氧化钠,故③错误;
④砹的原子序数大于碘,根据同族元素性质的递变规律可以推测,与氢气化合较难,砹化银也难溶于水,故④正确;
⑤元素的非金属性强弱与其对应氢化物的酸性强弱无关,因此由、、的非金属性逐渐减弱,无法推出、、的酸性强弱,故⑤错误;
⑥的密度比煤油小,不能保存在煤油中,应该保存在石蜡中,故⑥错误;
⑦F、、、位于同一主族,原子序数逐渐增大,电子层数增多,原子半径增大,原子核对最外层电子的吸引力减小,得电子的能力逐渐降低,故非金属性逐渐减弱,故⑦正确;
⑧氧化铯是活泼金属氧化物,易和二氧化碳发生反应,所以碳酸铯不易发生分解反应生成氧化铯和二氧化碳,故⑧正确。
答案选B。
二、非选择题
19.(1)日本大地震和海啸造成核电站爆炸,发生核泄漏,使碘131、铯137等放射性核素扩散到空气和海洋中。碘131的原子核中,中子数与质子数之差为_______,铯元素位于元素周期表中第_______周期_______族。
(2)下列原子:、、、、、、、、中共有_______种元素,_______种核素。
(3)在H3O+中,质子数、中子数、电子数之比为___;在NH3D+中,质子数、中子数、电子数之比为___。
【答案】(1)25 六 IA (2) 7 9 (3)11:8:10 11:8:10
【分析】
根据原子的构成微粒间的关系进行计算,质子数+中子数=质量数,质子数等于原子序数,对于阳离子来说是失去电子,阴离子是得到电子,其它微粒数保持不变。
【解析】
(1)根据质子数等于原子序数,中子数=质量数-质子数,碘元素的中子数=131-53=78,故中子数与质子数之差为:78-53=25,故答案为78;铯元素在元素周期表中的第六周期,IA主族,故答案为:六、IA;
(2)根据元素是质子数相同的同一类原子的总称,根据左下角表示质子数判断,一共有7种元素,故答案:7;根据核素是具有一定质子数和一定中子数的一种原子判断,故有9种核素,故答案为:9;
(3)根据质子数等于原子序数,对于H3O+中质子数是:3+8=11,中子数等于质量数减去质子数,故中子数为:0+16-8=8,电子数:11-1=10,故质子数、中子数、电子数之比为:11:8:10;在NH3D+中不同之处D中含有1个质子和1个中子,同理得出故质子数、中子数、电子数之比为:11:8:10;
20.(1)30 g 12C18O 和 28 g 14N2 所含的分子数之比为_______。
(2)同温同压下,12C18O和14N2两种气体的密度之比为_______。
(3)同温同压同体积的12C18O和 14N2具有电子数之比为_______。
(4)28 g14N2所含的原子数为_______NA.
(5)将乙烯、CO、N2三种气体分别盛放在三个相同容器中,若三个容器的温度和质量相等,则三个容器的气体压强之比为_______。
【答案】(1)1∶1 (2) 15∶14 (3) 1∶1 (4) 2 (5) 1∶1∶1
【解析】
(1)M(12C18O)=30 g·mol-1,30 g 12C18O的n(12C18O)=1 mol,M(14N2)=28 g·mol-1,28 g 14N2的n(14N2)=1 mol,n(12C18O)=n(14N2),N(12C18O)=N(14N2),分子数之比为1∶1;
(2)同温同压下,密度之比等于摩尔质量之比,M(12C18O)∶M(14N2)=30∶28=15∶14;
(3)同温同压同体积,则n(12C18O)=n(14N2),1 mol 12C18O中n(e-)=14 mol,1 mol 14N2中n(e-)=14 mol,所以电子数之比为1∶1;
(4)M(14N2)=28 g·mol-1,n(14N2)=1 mol,含有2 mol原子,则28 g14N2所含的原子数为2NA;
(5)乙烯、CO、N2的质量相等,三者的摩尔质量相等,所以n(乙烯)=n(CO)=n(N2),同温同体积时,压强之比等于物质的量之比,所以气体压强之比为1∶1∶1。
21.已知A、B两种元素,A的原子序数为x,A和B所在周期的元素种类数目分别为m和n。
(1)如果A和B同在IA族,当B在A的上一周期时,B的原子序数为___________,当B在A的下一周期时,B的原子序数为___________;
(2)如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为___________;当B在A的下一周期时,B的原子序数为___________。
【答案】
(1) x-n x+m
(2) x-m x+n
【分析】
(1)
如果A和B同在ⅠA族,当B在的A上一周期时,原子序数之差恰好为B所在的元素种类数,所以B的原子序数为x-n;当B在A的下一周期时,二者原子序数之差为A所在周期的元素种类数,所以B的原子序数为x+m;
(2)
A、B同在ⅦA族时,A、B原子序数之差恰好为相邻两周期中靠下一周期的元素种类数,与A、B同在ⅠA族相反,所以如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为x-m,当B在A的下一周期时,B的原子序数为 x+n。
22.表标出的是元素周期表的一部分元素,回答下列问题:
(1)属于第二周期元素的有_______、__________、________ (填元素符号), 属于第ⅢA 族的有 ________(填元素符号),属于第 IA 族的有__________ 、_______(填元素符号)。
(2)C 元素在元素周期表中的位置是第_____周期第____族。B 元素在元素周期表中的位置是第_____周期第____族。
【答案】(1)C O F Al Na K (2) 3 VA 2 ⅥA
【分析】
根据元素在周期表中的分布,A是F,B是O,C是P,D是C,E是Ar,F是Cl, G是S,H是P,I是Mg,J是Na,K是Ca,L是K,M是过渡金属元素,N是Br,结合元素周期表的结构分析解答。
【解析】
(1)属于第二周期元素的有D、B、A三种元素,分别为C、O、F;属于第ⅢA 族的是H,为Al元素;属于第 IA 族的有J、L两种元素,分别为Na、K,故答案为:C;O;F;Al;Na;K;
(2)C是P元素,在元素周期表中的位置是第3周期第VA族。B 是O元素,在元素周期表中的位置是第2周期第ⅥA族,故答案为:3;VA;2;ⅥA。
23.完成下列问题:
(1)10Be和9Be___________。
A.是同一种原子 B.具有相同的中子数
C.具有相同的化学性质 D.具有相同的核外电子排布
(2)有下列微粒或物质:
①O、O、O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥K、Ca、Ar,回答下列问题:
a.互为同位素的是___________;
b.互为同素异形体的是___________;
c.①⑤⑥中共有___________种核素,共___________种元素。
(3)D 2O的摩尔质量为___________,相同质量的D2O与D2O所含中子数之比为___________。
(4)电解相同质量的H2O和D2O时产生的氢气在同温同压下体积之比为___________,质量之比为___________。
【答案】(1)CD (2) ①⑤ ③ 9 5 (3) 20g/mol 11:12 (4) 10:9 5:9
【解析】
(1) A.10Be和9Be是质子数相同,中子数不同的不同种原子,故错误;
B.10Be和9Be的质子数相同,中子数不同,故错误;
C.10Be和9Be的质子数相同,最外层电子数相同,化学性质相同,故正确;
D.10Be和9Be的质子数相同,核外电子数相同,核外电子排布相同,故正确;
CD正确,故答案为:CD;
(2)①O、O、O的质子数相同,核外电子数相同,互为同位素;
②H2O、D2O是不同种氢原子与氧原子形成的化合物,不互为同位素,也不互为同素异形体;
③石墨、金刚石是碳元素形成的不同种单质,互为同素异形体;
④H2、D2、T2是氢元素的不同种原子形成的同种单质分子,不互为同位素,也不互为同素异形体;
⑤H、D、T的质子数相同,核外电子数相同,互为同位素;
⑥K、Ca、Ar的质量数相同,质子数不同,是不同种元素的三种不同的原子;
a.由分析可知,互为同位素的是①⑤,故答案为:①⑤;
b.由分析可知,互为同素异形体的是③,故答案为:③;
c.由分析可知,①⑤⑥中有5种不同的元素,9种不同的核素,故答案为:9;5;
(3)D 2O的摩尔质量为20g/mol,相同质量的D2O与D2O所含中子数之比为(×10):(×12)=11:12,故答案为:11:12;
(4)电解相同质量的H2O和D2O时产生的氢气在同温同压下体积之比为:=10:9,质量比为(10×2):(9×4)=5:9,故答案为:5:9。
24.某同学做同主族元素性质相似性、递变性实验时,自己设计了一套实验方案,并记录了有关实验现象(见表格,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验方案
实验现象
①将氯水滴加到溴化钠溶液中,振荡后加入适量CCl4溶液,振荡,静置
A.浮在水面上,熔成小球,四处游动,随之消失
②将一小块金属钠放入冷水中
B.分层,上层无色,下层紫红色
③将溴水滴加到NaI溶液中,振荡后加入适量CCl4溶液,振荡,静置
C.浮在水面上,熔成小球,四处游动,并伴有轻微的爆炸声,很快消失
④将一小块金属钾放入冷水中
D.分层,上层无色,下层棕红色
请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________________________。
(2)实验用品:①试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L‒1NaBr溶液、0.1mol·L‒1NaI溶液、CCl4溶液等。
②仪器:___、___、镊子、小刀、玻璃片等。
(3)实验内容(请把表中与实验方案对应实验现象的标号和化学方程式补写完整):
实验方案
实验现象
化学方程式
①
D
Cl2+2NaBr=2NaCl+Br2
②
A
2Na+2H2O=2NaOH+H2↑
③
___
___
④
___
___
(4)实验结论:___________________________________________________。
【答案】(1)探究同主族元素性质的相似性和递变性 (2) 试管 胶头滴管 (3) B Br2+2NaI=2NaBr+I2 C 2K+2H2O=2KOH+H2↑ (4) 同主族元素化学性质相似;同主族元素自上而下,元素原子失电子能力增强,得电子能力减弱
【解析】
(1) 依据某同学做同主族元素性质相似性、递变性实验,结合实验为对比相同条件下,金属钠和金属钾与水反应的过程和实验现象以及卤素元素之间的实验过程和现象,可知实验的目的是探究同主族元素性质的相似性和递变性,故答案为:探究同主族元素性质的相似性和递变性;
(2) ② 根据实验方案,实验仪器除了镊子、小刀、玻璃片外,还需要胶头滴管滴加溶液,试管盛放溶液,故答案为:试管;胶头滴管;
(3) ③将溴水滴加到NaI溶液中,振荡后再加入适量 CCl4,振荡,静置,溶液分层,上层无色,下层紫红色,实验现象为B,反应的化学方程式为 Br2+2NaI=2NaBr+I2;答案为:B;Br2+2NaI=2NaBr+I2;
④将一小块金属钾放入冷水中,钾浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失,实验现象为C,反应的化学方程式为2K+2H2O=2KOH+H2↑;答案为:C;2K+2H2O=2KOH+H2↑;
(4) 钠和钾都与水反应,但反应剧烈程度不同,钾比钠活泼;氯、溴、碘属于同主族元素,根据实验的反应和现象可知,氯气置换出溴单质,溴单质可以置换出碘单质,说明氧化性:Cl2>Br2>I2,证明同主族元素化学性质虽然相似,但存在不同。且从上到下,元素失电子能力增强,得电子能力减弱。故答案为:同主族元素化学性质相似;同主族元素自上而下,元素原子失电子能力增强,得电子能力减弱。
第19讲 化学键-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册): 这是一份第19讲 化学键-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共31页。试卷主要包含了化学键,离子键离,共价键,共价键分类,电子式,离子化合物与共价化合物的比较,化学键类型与物质类别的判断,化学键对物质性质的影响等内容,欢迎下载使用。
第16讲 金属材料-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册): 这是一份第16讲 金属材料-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共20页。试卷主要包含了合金,常见金属材料等内容,欢迎下载使用。
第14讲 Fe、铁的氧化物-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册): 这是一份第14讲 Fe、铁的氧化物-2023-2024学年高一化学易混易错巧讲精练(人教版2019必修第一册),共27页。试卷主要包含了8g·cm-3,5n=0,2gB.5等内容,欢迎下载使用。