



2019-2023年高考化学分类汇编 专题12 铁及其化合物
展开2019-2023年高考化学分类汇编专题12
铁及其化合物
一、单选题
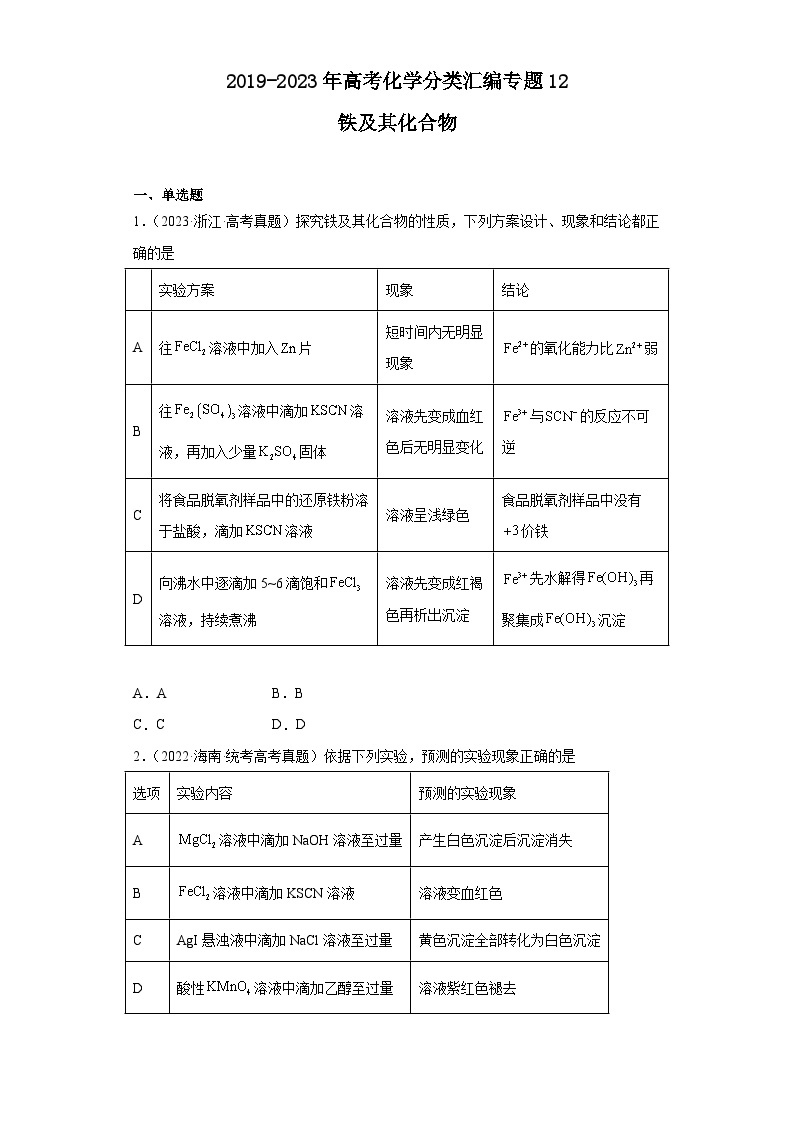
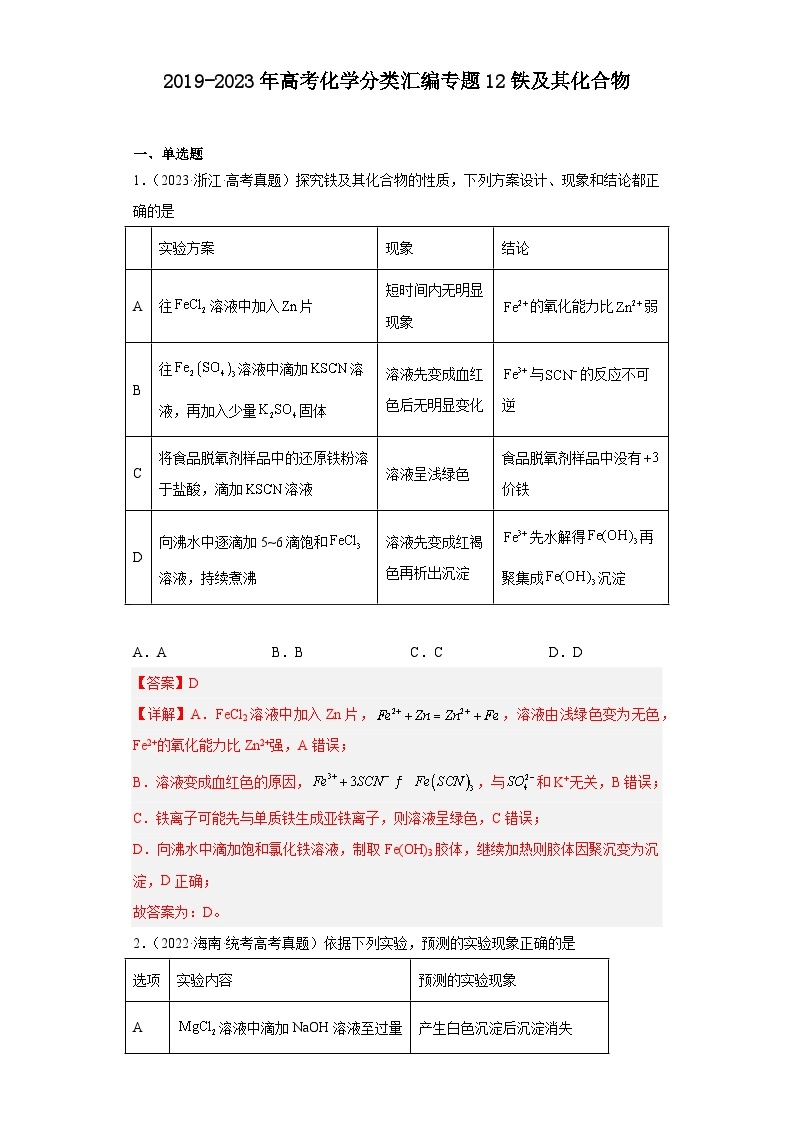
1.(2023·浙江·高考真题)探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是
实验方案
现象
结论
A
往溶液中加入片
短时间内无明显现象
的氧化能力比弱
B
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
向沸水中逐滴加5~6滴饱和溶液,持续煮沸
溶液先变成红褐色再析出沉淀
先水解得再聚集成沉淀
A.A B.B
C.C D.D
2.(2022·海南·统考高考真题)依据下列实验,预测的实验现象正确的是
选项
实验内容
预测的实验现象
A
溶液中滴加NaOH溶液至过量
产生白色沉淀后沉淀消失
B
溶液中滴加KSCN溶液
溶液变血红色
C
AgI悬浊液中滴加NaCl溶液至过量
黄色沉淀全部转化为白色沉淀
D
酸性溶液中滴加乙醇至过量
溶液紫红色褪去
A.A B.B
C.C D.D
3.(2022·山东·高考真题)高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含Zn、Fe元素的杂质)为主要原料制备Cu粉的工艺流程如下,可能用到的数据见下表。
开始沉淀pH
1.9
4.2
6.2
沉淀完全pH
3.2
6.7
8.2
下列说法错误的是
A.固体X主要成分是和S;金属M为Zn
B.浸取时,增大压强可促进金属离子浸出
C.中和调pH的范围为3.2~4.2
D.还原时,增大溶液酸度有利于Cu的生成
4.(2022·广东·高考真题)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
A.加入溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入溶液无红色出现
D.加入溶液无蓝色沉淀生成
5.(2021·江苏·高考真题)下列有关物质的性质与用途不具有对应关系的是
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
6.(2021·浙江·高考真题)下列说法正确的是
A.减压过滤适用于过滤胶状氢氧化物类沉淀
B.实验室电器设备着火,可用二氧化碳灭火器灭火
C.制备硫酸亚铁铵晶体时,须将含和的溶液浓缩至干
D.将热的饱和溶液置于冰水中快速冷却即可制得颗粒较大的晶体
7.(2021·广东·高考真题)部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是
A.可与反应生成
B.既可被氧化,也可被还原
C.可将加入浓碱液中制得的胶体
D.可存在的循环转化关系
8.(2021·河北·统考高考真题)“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。下列说法错误的是
A.钢是以铁为主的含碳合金
B.钢的含碳量越高,硬度和脆性越大
C.生铁由于含碳量高,熔点比熟铁高
D.冶炼铁的原料之一赤铁矿的主要成分为Fe2O3
9.(2020·浙江·高考真题)黄色固体X,可能含有漂白粉、、、、之中的几种或全部。将X与足量的水作用,得到深棕色固体混合物Y和无色碱性溶液Z。下列结论合理的是
A.X中含,可能含有
B.X中含有漂白粉和
C.X中含有,Y中含有
D.用酸化溶液Z,若有黄绿色气体放出,说明X中含有
10.(2020·浙江·统考高考真题)下列说法不正确的是
A.[Cu(NH3)4]SO4可通过CuSO4溶液与过量氨水作用得到
B.铁锈的主要成分可表示为Fe2O3·nH2O
C.钙单质可以从TiCl4中置换出Ti
D.可用H2还原MgO制备单质Mg
11.(2019·海南·高考真题)下列说法正确的是
A.和都属于两性氧化物
B.悬浊液和乳浊液的分散质均为液态
C.和中的金属都呈现两种价态
D.葡萄糖溶液和淀粉溶液都具有丁达尔效应
12.(2019·江苏·高考真题)室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L−1NaOH溶液:Na+、K+、、
B.0.1 mol·L−1FeCl2溶液:K+、Mg2+、、
C.0.1 mol·L−1K2CO3溶液:Na+、Ba2+、Cl−、OH−
D.0.1 mol·L−1H2SO4溶液:K+、、、
13.(2019·江苏·高考真题)室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B
C.C D.D
14.(2019·全国·高考真题)下列实验现象与实验操作不相匹配的是
实验操作
实验现象
A
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B
将镁条点燃后迅速伸入集满CO2的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A.A B.B
C.C D.D
二、元素或物质推断题
15.(2022·浙江·统考高考真题)化合物X由4种元素组成。某兴趣小组按如图流程进行实验:
请回答:
(1)组成X的元素有______,X的化学式为______。
(2)溶液C中溶质的成分是______(用化学式表示);根据C→D→E的现象,给出相应微粒与阳离子结合由弱到强的排序______。
(3)X与足量Na反应生成固体F的化学方程式是______。
(4)设计实验确定溶液G中阴离子______。
三、工业流程题
16.(2021·海南·统考高考真题)无水常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和杂质)为原料制备无水。
已知:氯化亚砜()熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和___________。
(2)为避免引入新的杂质,试剂B可以选用___________(填编号)。
A.溶液 B.水
C.水 D.溶液
(3)操作②是蒸发结晶,加热的同时通入的目的是___________。
(4)取少量晶体,溶于水并滴加溶液,现象是___________。
(5)反应的化学方程式为___________。
(6)由转化成的过程中可能产生少量亚铁盐,写出一种可能的还原剂___________,并设计实验验证是该还原剂将还原___________。
17.(2020·海南·高考真题)以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
回答下列问题:
(1)黄铁矿中硫元素的化合价为_____________。
(2)由炉渣制备还原铁粉的化学方程式为____________________________。
(3)欲得到更纯的NaHSO3,反应①应通入_____________ (填 “过量”或“不足量”)的SO2气体。
(4)因为Na2S2O5具有______________性, 导致商品Na2S2O5中不可避免地存在Na2SO4。
检验其中含有的方法是__________________。
(5)一般用 K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。
反应式:+6Fe2+ +14H+ = 2Cr3+ +6Fe3+ +7H2O
某次实验称取0.2800 g样品,滴定时消耗浓度为0.03000 mol·L-1的K2Cr2O7溶液25.10 mL,则样品中铁含量为____________________%。
18.(2020·江苏·高考真题)实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。
其主要实验流程如下:
(1)酸浸:用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有___________(填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原:向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成___________(填化学式);检验Fe3+是否还原完全的实验操作是______________。
(3)除杂:向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是___________[,]。
(4)沉铁:将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为____________。
②设计以FeSO4溶液、氨水- NH4HCO3混合溶液为原料,制备FeCO3的实验方案:__。
【FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5】。
四、实验题
19.(2021·北京·高考真题)铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O⇌TiO2·xH2O↓+H2SO4
iii.0.1 mol/L Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3;
0.1 mol/L Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(1)纯化
①加入过量铁粉的目的是_______。
②充分反应后,分离混合物的方法是_______。
(2)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如图)。
①产生白色沉淀的离子方程式是_______。
②产生白色沉淀后的pH低于资料iii中的6.3。原因是:沉淀生成后c(Fe2+)_______0.1mol/L(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:_______。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:_______。
(3)产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
wg铁黄溶液b溶液c滴定
资料:Fe3++3=Fe(C2O4),Fe(C2O4)不与稀碱液反应
Na2C2O4过量,会使测定结果_______(填“偏大”“偏小”或“不受影响”)。
20.(2020·全国·统考高考真题)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L−1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子
u∞×108/(m2·s−1·V−1)
阴离子
u∞×108/(m2·s−1·V−1)
Li+
4.07
4.61
Na+
5.19
7.40
Ca2+
6.59
Cl−
7.91
K+
7.62
8.27
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L−1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。
21.(2019·江苏·高考真题)聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m广泛用于水的净化。以FeSO4·7H2O为原料,经溶解、氧化、水解聚合等步骤,可制备聚合硫酸铁。
(1)将一定量的FeSO4·7H2O溶于稀硫酸,在约70 ℃下边搅拌边缓慢加入一定量的H2O2溶液,继续反应一段时间,得到红棕色黏稠液体。H2O2氧化Fe2+的离子方程式为________;水解聚合反应会导致溶液的pH________。
(2)测定聚合硫酸铁样品中铁的质量分数:准确称取液态样品3.000 g,置于250 mL锥形瓶中,加入适量稀盐酸,加热,滴加稍过量的SnCl2溶液(Sn2+将Fe3+还原为Fe2+),充分反应后,除去过量的Sn2+。用5.000×10−2 mol·L−1 K2Cr2O7溶液滴定至终点(滴定过程中与Fe2+反应生成Cr3+和Fe3+),消耗K2Cr2O7溶液22.00 mL。
①上述实验中若不除去过量的Sn2+,样品中铁的质量分数的测定结果将________(填“偏大”或“偏小”或“无影响”)。
②计算该样品中铁的质量分数(写出计算过程)_____。
22.(2019·浙江·高考真题)某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
2019-2023年高考化学分类汇编 专题1 物质的分类: 这是一份2019-2023年高考化学分类汇编 专题1 物质的分类,文件包含2019-2023年高考化学分类汇编专题1物质的分类解析版docx、2019-2023年高考化学分类汇编专题1物质的分类原卷版docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
2019-2023年高考化学分类汇编 专题20 化学与STSE: 这是一份2019-2023年高考化学分类汇编 专题20 化学与STSE,文件包含2019-2023年高考化学分类汇编专题20化学与STSE解析版docx、2019-2023年高考化学分类汇编专题20化学与STSE原卷版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
2019-2023年高考化学分类汇编 专题19 化学实验基础: 这是一份2019-2023年高考化学分类汇编 专题19 化学实验基础,文件包含2019-2023年高考化学分类汇编专题19化学实验基础解析版docx、2019-2023年高考化学分类汇编专题19化学实验基础原卷版docx等2份试卷配套教学资源,其中试卷共81页, 欢迎下载使用。