














人教版 (2019)必修 第一册第一节 物质的分类及转化习题ppt课件
展开人教版(2019)高中化学必修第一册
第一章1.1《物质的分类及转化》教学设计
物质的分类及转化 (第 2 课时)
一、 学习目标
1.金属的氧化和金属氧化物的还原。
2.单质、氧化物、酸之间的转化。
3.单质、氧化物、碱之间的转化。
4.根据化学方程式的简单计算。
5.单质、氧化物、酸之间的转化。
6.单质、氧化物、碱之间的转化。
7.根据化学方程式的简单计算。
二、学科核心素养
1. 下列每组物质中都有一种物质与其他物质在分类方法上不同,试分析每组中物质的组成规律,将这种不同于其他物质的物质找出来,用横线画出。
A.HC l O 3 、 KClO 3 、 Cl 2 、 NaClO 3
B. 空气、 N 2 、 HC l 、 CuSO 4
C. 铜、金、汞、钠
D.H 3 PO 4 、 HNO 3 、 HC l 、 H 2 SO 4
2. 某物质经分析可知仅含一种元素,此物质 ( )
A. 可能是纯净物也可能是混合物
B. 可能是单质也可能是化合物
C. 一定是纯净物
D. 一定是一种单质
三、情境引入
(一)金属的氧化和金属氧化物的还原
1.铜与氧化铜之间的相互转化实验
(1)实验步骤和实验现象:
①用坩埚夹着铜片在酒精灯的外焰上加热。现象:发现紫红色铜片变成了黑色。铜的表面生成了氧化铜。
②把在酒精灯外焰上加热后的铜片,马上插入酒精(乙醇)中。现象:铜片表面又由黑色变成了紫红色。
(2)实验结论:
在这个过程中,铜在加热的条件下能和空气中的氧气结合形成黑色的氧化铜,铜片表面生成的黑色氧化铜马上和酒精(乙醇)反应又转化成了铜。
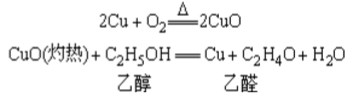
(3)注意事项:
铜一定要在酒精灯的外外焰上加热,不要使铜碰到酒精灯的灯芯。因为在铜的表面生成的氧化铜与酒精灯的内焰或灯芯接触,实质上是和还没有燃烧的酒精(乙醇)蒸汽接触,会使已经生成的氧化铜又被酒精还原成铜。
(4)实验小结:
①氧气在加热的条件下能和铜结合生成氧化铜。金属获得氧的过程被称为金属的氧化(oxidation)。
②酒精能与灼热的氧化铜反应从氧化铜中夺取氧,使氧化铜转化为铜。金属氧化物失去氧的过程被称为金属氧化物的还原(deoxidation)。
2.使铁的表面形成氧化层保护膜实验
铁片放在浓硝酸、浓硫酸中,没有气体放出,这是因为铁在浓硝酸、浓硫酸中生成了铁的氧化物,正是这层致密的氧化膜保护了铁,使铁不能与酸反应生成氢气。但将铁片放在稀硫酸中,则有气体放出,即生成了氢气。
绝大部分金属都能在一定条件下与氧气化合生成金属的氧化物,但一些不活泼的金属如:金、铂等,很难和氧化合生成氧化物。金属还能和某些能提供氧的物质如:硝酸、浓硫酸等反应,生成金属氧化物。
3.氢气还原氧化铜实验
(1)实验步骤:
在干燥的硬质试管里铺一薄层黑色氧化铜粉末,固定在铁架台上,通入氢气,待空气排尽后,加热氧化铜。反应完成后停止加热,再继续通入一会儿氢气,直到试管冷却。
(2)实验装置:
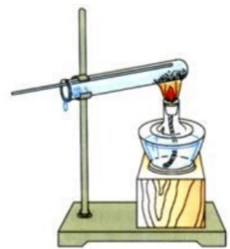
(3)实验现象:
黑色的氧化铜变成紫红色,试管口有水珠生成。
(4)注意事项:
①试管口应略向下倾斜,防止反应过程中生成的水流到试管底部使试管破裂;
②氢气的导入管要伸到试管的底部;
③反应开始前要先通入氢气,以排尽试管中的空气;当反应完成时,要先停止加热,继续通入氢气,直到试管冷却,再停止通入氢气,以防止生成的灼热的铜又被空气中的氧气氧化成氧化铜。
(5)实验结论:
氢气在加热的条件下能从氧化铜中夺取氧,使氧化铜转化为铜。
一氧化碳、碳、镁、铝等同样能在加热的条件下从氧化铜等氧化物中夺取氧,使氧化铜等氧化物转化为金属单质。有关的化学方程式为:
氧化铜和氢气 ![]()
氧化铜和一氧化碳 ![]()
氧化铜和碳 ![]()
氧化铜和镁 ![]()
氧化铁和一氧化碳 ![]()
(二)酸碱指示剂
遇酸或碱的溶液可显示不同颜色的物质叫做酸碱指示剂,简称指示剂。
指示剂在不同溶液中的呈色情况如下表。

(三)单质、氧化物、酸之间的转化
1.酸雨形成的模拟实验步骤:
在燃烧匙里放入少量硫粉,加热,直到燃烧,然后把燃着硫的燃烧匙伸入盛有氧气的集气瓶,等燃烧停止后,小心地闻一下气体的气味,然后立即向瓶内倒入少量水,振荡,加入几滴石蕊试液测定溶液的酸碱性。


2.实验现象:
(1)有无色、有刺激性的气体生成;
(2)石蕊试液变成红色。
3.实验原理:有关的化学方程式为:
![]()
![]()
4.实验结论:根据硫、二氧化硫和亚硫酸之间的转化,我们可以看到非金属、非金属氧化物和对应的酸之间一般有如下的转化规律:
某些非金属氧化物并不能直接与水反应,如:二氧化硅(沙子的主要成分)就不能与水直接反应生成硅酸。
(四)单质、氧化物、碱之间的转化
金属、金属氧化物和对应的碱之间一般有如下的转化规律:
![]()
但只有少部分金属氧化物能直接与水反应生成对应的碱,如:氧化钠与水反应生成氢氧化钠、氧化钙与水反应生成氢氧化钙。而大部分金属氧化物并不能直接与水反应生成对应的碱,这些氧化物可以先与酸反应生成盐溶液,盐溶液再与可溶性的碱溶液反应生成对应碱的沉淀。有关的化学方程式为:
Na2O+H2O=2NaOH
CaO+H2O=Ca(OH)2
CuO+H2SO4=CuSO4+H2O
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
(五)单质、氧化物、酸、碱、盐之间的转化关系

十种生成盐的方法:
(1)非金属单质(氧气除外)+金属单质→无氧酸盐
(2)酸性氧化物+碱性氧化物→含氧酸盐
(3)酸性氧化物+碱→盐+水
(4)碱性氧化物+酸→盐+水
(5)酸+碱→盐+水
(6)酸+盐→新酸+新盐
(7)碱+盐→新碱+新盐
(8)盐+盐→新盐+另一新盐
(9)金属单质+盐→新金属+新盐
(10)金属单质+酸→盐+氢气
(六)根据化学方程式的简单计算
1.化学方程式的表示意义
化学方程式表示的意义:

以“S+O2![]() SO2”反应为例:
SO2”反应为例:
(1)宏观含义:硫与氧气在点燃的条件下生成二氧化硫。
(2)微观含义:1个硫原子与1个氧分子点燃时生成1个二氧化硫分子。
(3)质量比:每32份质量的硫跟32份质量的氧气完全反应,生成64份质量的二氧化硫。
2.根据化学方程式计算一般步骤
(1)根据题意设未知量(用x、y等字母来表示);
(2)写出配平了的化学方程式;
(3)求出有关物质间的质量比,并写出相应化学式的下边;
(4)把已知量和x、y等写在相应质量比的下边;
(5)列出比例式,求未知量x、y;
(6)简明地写出答案。
3.气体参加反应或求气体体积的计算
在初中阶段,根据化学方程式计算时都是计算质量关系。若有一定体积的气体参加反应,则先要将它换算成气体的质量;若要求出待求物气体的体积数,则要将已求出的气体质量换算成体积。
气体的体积(V)与气体的质量(m)的换算关系为:
m(g)=V(L)×ρ(g/L)(ρ为气体的密度)
4.根据化学方程式进行计算时常犯的错误
(1)不认真审题,答非所问;
(2)元素符号或化学式写错;
(3)化学方程式没有配平;
(4)相对分子质量计算错误;
(5)同一种物质不用相同的单位;
(6)把不纯物当成纯净物。
5.有关含杂质问题的计算方法
化学方程式中进行的计算,各物质都被理想化为纯净物,而实际的生产或科学实验中纯净物是不存在的,这就需要把不纯的反应物换算成纯净物后才能进行化学方程式的计算,而计算出的纯净物也要换算成实际生产或实验中的不纯物。有时还要考虑生产或科学实验中的消耗。这些辅助性的计算也是不可缺少的重要环节。
有关不纯物质的质量的计算方法:先把不纯的反应物和生成物的质量换算成纯净物的质量,然后才能代入化学方程式进行计算。

纯物质的质量=不纯物质的总质量×纯度
=不纯物质的总质量×(1-杂质的质量分数)
不纯物质的总质量=纯物质的质量÷纯度。
例题:含碳酸钙90%的石灰石(杂质不和酸反应)10克跟足量的盐酸反应,可产生二氧化碳多少克?
6.化学计算的解题思路
(1)审题:认真阅读题目,反复推敲关键字句,准确理解题意。
(2)析题:运用所学知识剖析题目,理清层次,挖掘隐含信息,排除干扰条件,分析已知和待求。明确物质间的关系,寻找解题突破口。
(3)解题:解题时要做到思路清楚,方法正确,步骤明晰,计算准确,书写规范。
(4)难题:检查所用条件是否符合题意,是否全部解出所要求的问题,单位是否统一,计算是否正确等。
化学必修 第一册第二节 离子反应习题课件ppt: 这是一份化学必修 第一册第二节 离子反应习题课件ppt,文件包含人教版2019高中化学必修第一册第一章第二节离子反课件应课件pptx、人教版2019高中化学必修第一册第一章第二节离子反应习题精练docx、人教版2019高中化学必修第一册第一章第二节离子反应教学设计docx、人教版2019高中化学必修第一册第一章第二节离子反应导学案册docx等4份课件配套教学资源,其中PPT共36页, 欢迎下载使用。
人教版 (2019)必修 第一册第一节 物质的分类及转化图文课件ppt: 这是一份人教版 (2019)必修 第一册第一节 物质的分类及转化图文课件ppt,共16页。PPT课件主要包含了宏观角度,由元素组成,微观角度,元素与物质关系,物质的组成和构成,化合物,同素异形体,标准不同分类不同,物质分类,交叉分类法等内容,欢迎下载使用。
高中人教版 (2019)第一节 物质的分类及转化教学演示课件ppt: 这是一份高中人教版 (2019)第一节 物质的分类及转化教学演示课件ppt,共36页。PPT课件主要包含了树状分类法,交叉分类法,单质的分类,氧化物的分类,分离溶液与胶体等内容,欢迎下载使用。














