


2024届高考化学一轮总复习课时跟踪练16化学键
展开课时跟踪练16
一、选择题
1.(2022·黄石市有色第一中学月考)下列关于化学键的说法,认识错误的是( )
①ss σ键与sp σ键的对称性不同
②π键不能单独存在,一定要和σ键共存
③含有π键的化合物与只含σ键的化合物的化学性质不同
④2个非金属元素的原子之间形成的化学键都是共价键
⑤分子中含有共价键,则一定只含有1个σ键
⑥成键的原子间原子轨道重叠越多,共价键越牢固
⑦1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
A.①⑤ B.②⑥
C.③⑦ D.②④
解析:①ss σ键与sp σ键的对称性相同,均为轴对称,故错误;②分子中可以只含σ键,π键不能单独存在,一定要和σ键共存,故正确;③π键不稳定,易断裂,含有π键的化合物化学性质较活泼,与只含σ键的化合物的化学性质不同,故正确;④非金属原子常以共用电子对形成化学键,2个非金属元素的原子之间形成的化学键都是共价键,故正确;⑤分子中含有共价键,不一定只含有1个σ键,如水分子中含有2个σ键,故错误;⑥成键的原子间原子轨道重叠越多,成键原子间的距离越小,共价键越牢固,故正确;⑦N原子最外层有5个电子,有3个未成对电子,1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的,故正确;综上所述①⑤错误,故选A。
答案:A
2.(2022·东莞高级中学月考)黑火药是我国古代四大发明之一,它是由木炭(C)、硫黃(S)、火硝(KNO3)按一定比例混合而成,爆炸时发生反应:S+2KNO3+3CK2S+3CO2↑+N2↑。下列叙述不正确的是( )
A.K2S属于离子化合物
B.火硝中既含有离子键,又含有共价键
C.CO2和N2分子中均含有共价键
D.CO2的电子式是![]()
解析:K2S由钾离子和硫离子构成,含有离子键,属于离子化合物,故A项正确;KNO3由钾离子和硝酸根离子构成,含有离子键,硝酸根离子中氧原子和氮原子之间为共价键,故火硝中既含有离子键,又含有共价键,故B项正确;CO2是共价化合物,含有共价键,N2分子中氮原子之间以共价键结合,则二者均含有共价键,故C项正确;CO2分子中一个碳原子与两个氧原子各共用两对电子,其电子式为![]() ,故D项错误。
,故D项错误。
答案:D
3.(2022·随州一中月考)天津大学马一太、田华教授团队在国家重点研发计划——科技冬奥专项支持下,通过校企合作,研发了国际先进的二氧化碳(R744)跨临界直冷制冰技术,满足不同项目对冰面的要求,被誉为是“最快的冰”。下列有关说法正确的是( )
A.CO2跨临界制冰过程破坏了碳氧共价键
B.H2O的空间构型为直线形
C.冰属于分子晶体
D.CO2分子中存在1个σ键和1个π键
解析:CO2跨临界制冰过程发生物理变化,没有破坏碳氧共价键,故A项错误;H2O中O原子采取sp3杂化,有两对孤电子对,属于V形空间构型,故B项错误;冰是水分子通过氢键形成的晶体,属于分子晶体,故C项正确;CO2分子内每个氧原子和碳原子共用两对电子对,1个碳氧双键存在1个σ键1个π键,则CO2分子中存在2个σ键2个π键,故D项错误。
答案:C
4.(2022·长沙市南雅中学月考)下列关于共价键的说法错误的是( )
A.σ键的电子云图形是轴对称的,π键的电子云图形是镜面对称的
B.H只能形成σ键,N可以形成σ键和π键
C.HCN分子中有2个σ键和2个π键
D.共价键的键长越长,共价键越牢固
解析:σ键的电子云图形是轴对称的,可以围绕对称轴旋转,π键的电子云图形分布在原子核构成平面的两侧,是镜面对称的,故A项正确;H核外只有1个电子,位于1s轨道,电子云为球形,和其他原子形成共价键时只能以“头碰头”的方式形成σ键,N原子2p轨道有3个单电子,2个N原子成键时,只能有1个p电子以“头碰头”的方式形成σ键,另外2个p电子以“肩并肩”方式形成π键,故B项正确;HCN的结构式为HCN,单键为σ键,三键中有1个σ键和2个π键,所以分子中共有2个σ键和2个π键,故C项正确;共价键的键长越长,键能越小,共价键越不牢固,故D项错误。
答案:D
5.(2022·泉州师范学院附属鹏峰中学月考)Li2O的BornHaber循环如图所示,下列说法正确的是( )
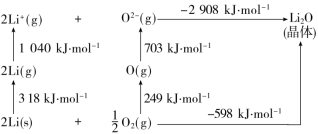
A.Li在纯氧中燃烧生成Li2O2
B.Li的第一电离能为1 040 kJ·mol-1
C.O===O的键能为249 kJ·mol-1
D.Li2O的晶格能为2 908 kJ·mol-1
解析:锂在氧气中燃烧主要产生Li2O而不是Li2O2,A项错误;由题图中2 mol Li(g)转变成2 mol Li+(g)所需要的能量为1 040 kJ可知Li的第一电离能为=520 kJ·mol-1,B项错误;由题图中O2(g)转化为1 mol O(g)所需要的能量为249 kJ可知,O===O键能为氧气分子变为氧原子所需能量为2×249 kJ·mol-1=498 kJ·mol-1,即键能为498 kJ·mol-1,C项错误;晶格能是气态离子形成1 mol离子晶体释放的能量,题图中2Li+(g)+O2-(g)===Li2O(s) ΔH=
-2 908 kJ·mol-1,则Li2O的晶格能为2 908 kJ·mol-1,D项正确。
答案:D
6.(2022·绵阳南山中学期中)锶(38Sr)是碱土金属(第ⅡA)元素。氯化锶(SrCl2)是最常见的锶盐。SrCl2可用于制造红色烟火,常由SrCO3与盐酸反应制备。下列说法正确的是( )
A.Sr属于s区元素,基态Sr原子没有d电子
B.SrCO3的晶格能小于MgCO3,所以热分解温度低于MgCO3
C.与同周期相邻的主族元素相比,Sr的第一电离能更大
D.上述制备SrCl2的离子方程式为CO+2H+===CO2↑+H2O
解析:Sr为38号元素,是碱土金属(第ⅡA)元素,核外电子排布为1s22s22p63s23p63d104s24p65s2,基态Sr原子有d电子,故A项错误;使离子晶体变为气态正离子和气态负离子所吸收的能量叫晶格能,主要影响因素是离子电荷,电荷越高,晶格能越大,其次就是离子半径,离子半径越小,晶格能越大,SrCO3与MgCO3分解后,分别生成氧化锶和氧化镁,而氧化镁比氧化锶更稳定,镁离子半径小,晶格能大,所以碳酸镁更容易分解而生成较稳定的氧化镁,故B项错误;同周期元素第一电离能从左到右有增大的趋势,所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素,当价层电子在能量相等的轨道上形成全空、半满、或全满结构时,原子的能量较低,元素的第一电离能较大,锶核外电子排布为1s22s22p63s23p63d104s24p65s2,Sr的第一电离能更大,故C项正确;SrCO3是难溶物,离子方程式中不能拆,故D项错误。
答案:C
7.(2022·龙岩市永定第一中学月考)碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其分子结构如图。下列说法错误的是( )
![]()
A.该分子只含有极性键
B.该分子属于极性分子
C.该分子的原子中存在孤电子对
D.该分子中σ键与π键个数比为4∶1
解析:碳酸亚乙烯酯分子除含有极性键外还含有非极性键如C—C,故A项错误;该分子正负电荷中心不重叠,属于极性分子,故B项正确;该分子的原子中存在孤电子对,如五元环上的两个氧原子各有两个孤电子对,故C项正确;该分子中σ键与π键个数比为8∶2=4∶1,故D项正确。
答案:A
8.(2022·福州高级中学月考)美国科学家合成了含有N的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈V形,如图所示。以下有关该物质的说法不正确的是( )
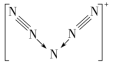
A.每个N中含有35个质子和34个电子
B.该离子中有非极性键和配位键
C.该离子中含有4个π键
D.与PCl互为等电子体
解析:1个氮原子中含有7个质子、7个电子,则1个N5分子中含有35个质子、35个电子,N是由N5分子失去1个电子得到的,则1个N离子中有35个质子,34个电子,故A项正确;N中氮氮三键是非极性共价键,中心的氮原子有空轨道,两边的2个氮原子提供孤电子对形成配位键,故B项正确;1个氮氮三键中含有2个π键,所以该离子中含有4个π键,故C项正确;N和PCl具有相同原子数,但价电子数分别为24、27,不是等电子体,故D项错误。
答案:D
9.(2022·六安市皖西中学月考)离子液体是在室温或接近室温时呈液态的盐类物质,应用广泛。1乙基3甲基咪唑四氟硼酸盐离子液体结构如图所示,下列相关叙述错误的是( )
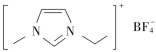
A.该离子液体中C、N杂化方式均有sp3
B.阴离子呈正四面体形,存在共价键和配位键
C.阳离子中σ键数目是π键数目的10倍
D.该离子液体与水能够形成氢键
解析:1乙基3甲基咪唑四氟硼酸盐离子液体中,根据C原子形成的化学键有1个双键,判断应采用的是sp2杂化,还有碳原子形成的是4个单键,判断采用的是sp3杂化,N原子形成的有1个双键判断是sp2杂化,另1个N原子接的都是单键判断是sp3,故A项正确;阴离子BF中的B原子采用sp3杂化,根据VSEPR模型判断空间构型是正四面体,根据杂化理论判断B原子中有空轨道,F-有孤电子对,故还含有配位键,故B项正确;根据单键是σ键,双键中一根是σ键、一根是π键,判断该物质中含有σ键是19个,π键2,σ键数目不是π键数目的10倍,故C项错误;该物质中含有电负性大的N和F原子,故能与水中的氢原子形成氢键,故D项正确。
答案:C
10.(2022·莆田二中月考)一种合成中间体Z可通过如下转化得到。下列有关X、Y、Z的说法正确的是( )
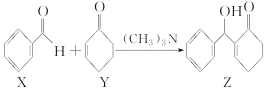
A.1 mol X中含有2 mol碳氧π键
B.X、Y均能与银氨溶液反应
C.X分子中所有原子一定在同一平面
D.Z与足量H2加成后的产物分子中含3个手性碳原子
解析:双键中含有1个π键,则由结构简式可知,1 mol X中含有1 mol碳氧π键,故A项错误;由结构简式可知,Y分子中不含醛基,不能与银氨溶液反应,故B项错误;苯环和醛基为平面结构,由于单键可以旋转,所以X分子中所有原子可能在同一平面,故C项错误;由结构简式可知,一定条件下Z分子与足量氢气发生加成反应生成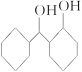 ,
, 分子中含有3个连有不同原子或原子团的手性碳原子,故D项正确。
分子中含有3个连有不同原子或原子团的手性碳原子,故D项正确。
答案:D
二、非选择题
11.(2022·齐齐哈尔市第八中学校月考)W、M、X、Y、Z是周期表前36号元素中的五种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)MX的空间构型是______________。H2X分子的VSEPR模型名称为__________。
(2)0.2 mol WX2中含有的π键数目为________(用NA表示阿伏加德罗常数的值)。
(3)W、M、X、Y的第一电离能由大到小顺序为______________(用元素符号回答)。
(4)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为__________,其中碳氧原子之间共价键是______(填字母)。
a.2个σ键 b.2个π键 c.1个σ键,1个π键
解析:W的一种核素在考古时常用来鉴定一些文物的年代,则W为C元素;X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭,则X为O元素;M的氧化物是导致酸雨的主要物质之一,原子序数介于碳、氧之间,故M为N元素;Y的基态原子核外有6个原子轨道处于半充满状态,原子核外电子排布式为1s22s22p63s23p63d54s1,故Y为Cr元素;Z能形成红色的Z2O和黑色的ZO两种氧化物,Z为Cu元素。据此分析解答。(1)MX即为NO中心N原子价层电子对数为3+=3,不含孤电子对,所以空间构型为平面正三角形;H2X即H2O,中心O原子价层电子对数为2+=4,所以VSEPR模型名称为四面体形。(2)WX2即为CO2,结构式为O===C===O,双键含有1个σ键、1个π键,所以0.2 mol CO2中含有0.4 mol π键,数目为0.4NA。(3)W、M、X、Y分别为C、N、O、Cr,Cr为金属元素,第一电离能较小,同周期主族元素自左至右第一电离能呈增大趋势,但N原子2p能级轨道半满,更稳定,第一电离能大于O元素,所以第一电离能由大到小顺序N>O>C>Cr。(4)COCl2分子中C原子采取sp2杂化成键,C原子与Cl原子之间只能形成C—Cl单键,故C原子与O原子之间形成C===O双键,该分子的结构式为![]() ;碳氧原子之间共价键为双键,含1个σ键,1个π键,故选c。
;碳氧原子之间共价键为双键,含1个σ键,1个π键,故选c。
答案:(1)平面正三角形 四面体形 (2)0.4NA
(3)N>O>C>Cr (4)![]() c
c
12.(2022·泉州科技中学月考)以下是一些元素的信息,其中有一种元素不在短周期。
元素A | 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 |
元素B | 基态原子M层p轨道上有5个电子 |
元素C | 短周期中金属性最强,与X反应能生成两种常见化合物 |
元素X | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 |
元素Y | 单质为双原子分子,结构中σ键与π数目比为1∶2 |
根据上述信息,回答下列问题:
(1)写出X3的等电子体________(写一个即可),基态Y原子核外电子所占据的最高能级的电子云形状为________。
(2)A元素在元素周期表中的______区,基态A原子的未成对电子有______个。
(3)B、C、X的简单离子半径由大到小的顺序为________(填离子符号)。
(4)H—X与H—Y两种共价键中,键的极性较强的是______,键长较长的是______(X、Y用元素符号表示)。
(5)Y与碳元素形成的一种阴离子与Y2是等电子体,请写出该阴离子的电子式:___________。
Y的常见氢化物易溶于水的主要原因是_______________________________________
________________________________________________________________________。
(6)铂丝蘸取化合物CB在酒精灯上灼烧,火焰呈______色,显色原因是______(填字母)。
A.CB受热挥发 B.CB受热分解
C.C离子中电子跃迁 D.B离子中电子跃迁
解析:根据元素性质及核外电子排布规律分析元素的种类;根据等电子体概念分析解答。X最外层电子数是内层电子数的3倍,X原子只能有2个电子层,最外层电子数为6,则X为O元素,可以形成双原子阴离子O;元素A单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物,则A为Fe;B基态原子M层p轨道上有5个电子,则B为Cl元素;C在短周期中金属性最强,与X反应能生成两种常见化合物,则C为Na元素;短周期元素Y单质为双原子分子,结构中σ键与π键数目比为1∶2,则Y为N元素。(1)O3的等电子体有SO2或NO;基态N原子核外电子所占据的最高能级为p轨道,电子云形状为纺锤形或哑铃形。(2)A元素为Fe,价层电子排布式为3d64s2,在元素周期表中的d区,基态A原子的未成对电子在3d轨道上,共有4个。(3)B、C、X分别为Cl、Na、O,Cl-有3个电子层,半径最大,O2-和Na+核外电子排布相同,核电荷越大,半径越小,所以简单离子半径由大到小的顺序为Cl->O2->Na+。(4)X为O,Y为N,O的电负性强于N,所以键的极性较强的是H—O;N的原子半径大于O,所以键长较长的是H—N。(5)等电子体具有相同的原子数目及相同的价层电子总数,所以Y与碳元素形成的一种阴离子为[∶C⋮⋮N∶]-;氨易溶于水的原因是NH3分子与水分子间存在分子间氢键,NH3是极性分子,水也是极性分子,相似相溶。(6)铂丝蘸取化合物NaCl在酒精灯上灼烧,吸收能量,钠离子的电子发生跃迁,产生的发射光谱为黄色。
答案:(1)SO2(或NO) 纺锤形(或哑铃形)
(2)d 4
(3)Cl->O2->Na+
(4)H—O H—N
(5)[∶C⋮⋮N∶]- NH3分子与水分子间存在分子间氢键,NH3是极性分子,水也是极性分子,相似相溶
(6)黄 C
13.(2022·天津三中月考)下表中A、B、C、D、E、F为短周期主族元素,G为第四周期元素,它们的原子序数依次增大。
A.元素周期表中原子半径最小的元素 |
B.原子最外层电子数是内层电子数的2倍 |
C.原子的核外p电子总数比s电子总数少1 |
D.元素价电子排布式为nsnnp2n |
E.同D主族元素,且原子序数为D的2倍 |
F.元素的主族序数与周期数的差为4 |
G.基态原子最外层电子排布为4s1,内层处于全充满状态 |
根据上述信息,回答下列问题:
(1)C基态原子电子排布式为______________,CA3中心原子的杂化方式为______,分子空间构型为__________。
(2)E的最高价氧化物的VSEPR模型名称为____________________________________,
其属于__________(填“极性”或“非极性”)分子。
(3)A2D的沸点比A2E的沸点高,其主要原因是________________________________
________________________________________________________________________。
(4)下列关于B2A2的说法中正确的是________(填字母)。
A.B2A2中的所有原子都满足8电子结构
B.B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子发生加成反应σ键断裂
(5)下列图像可表示两个F原子间成键后的电子云的图像是______(填字母)。
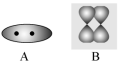

(6)向G2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,离子方程式为________________________________________________________________________
________________________________________________________________________,
继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,加入乙醇后有深蓝色晶体析出,其溶质的化学式为______________(不用写结晶水)。
解析:A为元素周期表中原子半径最小的元素,则A为H元素;B原子最外层电子数是内层电子数的2倍,则B为C元素;C原子的核外p电子总数比s电子总数少1,则C为N元素;D元素价电子排布式为2s22p4,则D为O元素;E与D同主族,且原子序数为D的2倍,则E为S元素;F元素的主族序数与周期数的差为4,且原子序数为大于16(硫)的短周期元素,则F为Cl元素;G基态原子最外层电子排布为4s1,内层处于全充满状态,则G为Cu元素。据此分析解答。(1)C为N元素,基态原子电子排布式为1s22s22p3;CA3为NH3,有三条σ键一对孤电子对,中心原子的杂化方式为sp3,分子空间构型为三角锥形。(2)E的最高价氧化物为SO3,无孤电子对,VSEPR模型名称为平面三角形,SO3是平面三角形分子,键角120°,因此它是非极性分子。(3)A2D(H2O)的沸点比A2E(H2S)的沸点高,其主要原因是因为水分子之间存在氢键。(4)B2A2(C2H2)为乙炔,含有三键。B2A2中的氢原子不满足8电子结构,故A项错误;B2A2分子中σ键和π键数目比为3∶2,故B项错误;B2A2是由极性键(CH)和非极性键(CC)形成的非极性分子,故C项正确;B2A2分子发生加成反应π键断裂,故D项错误;故选C。(5)两个F(氯)原子间成键后为F2(Cl2),两个F原子之间形成pp σ键,成键后的电子云在两个F原子之间,答案选E。(6)向Cu2+的硫酸盐溶液中滴加氨水直至过量,首先观察到生成蓝色沉淀,沉淀为氢氧化铜,离子方程式为Cu2++2NH3·H2O===Cu(OH)2↓+2NH,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,生成[Cu(NH3)4]2+,加入乙醇后有深蓝色晶体析出,其溶质的化学式为[Cu(NH3)4]SO4。
答案:(1)1s22s22p3 sp3 三角锥形 (2)平面三角形 非极性 (3)水分子之间存在氢键 (4)C (5)E (6)Cu2++2NH3·H2O===Cu(OH)2↓+2NH [Cu(NH3)4]SO4
2024届高考化学一轮总复习课时跟踪练30烃: 这是一份2024届高考化学一轮总复习课时跟踪练30烃,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习课时跟踪练16化学键: 这是一份2024届高考化学一轮总复习课时跟踪练16化学键,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2024届高考化学一轮总复习课时跟踪练30烃: 这是一份2024届高考化学一轮总复习课时跟踪练30烃,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。












