





- 高中化学学考复习第二讲钠及其化合物课件 课件 0 次下载
- 高中化学学考复习第三讲氯及其化合物课件 课件 0 次下载
- 高中化学学考复习第五讲铁、铝与金属材料课件 课件 0 次下载
- 高中化学学考复习第六讲原子结构与元素周期表课件 课件 0 次下载
- 高中化学学考复习第七讲元素周期律课件 课件 0 次下载
高中化学学考复习第四讲物质的量及在化学计算中的应用课件
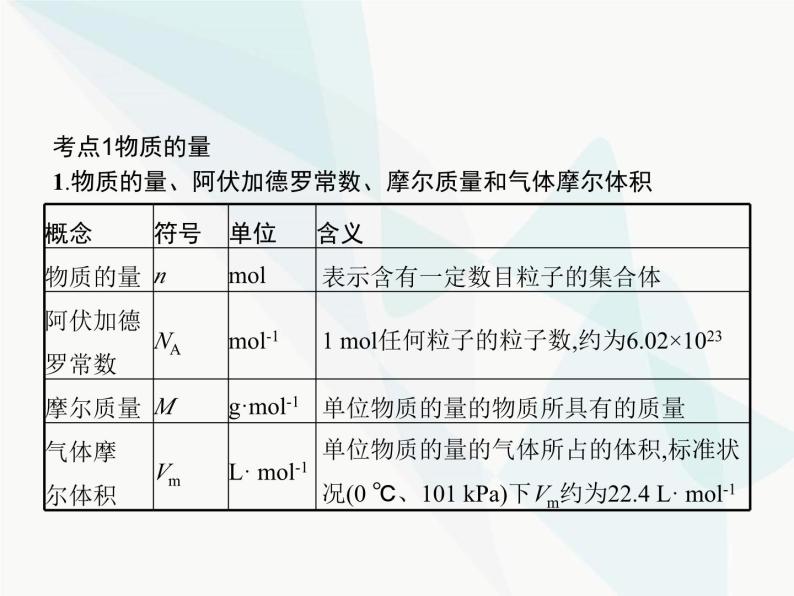
展开考点1物质的量1.物质的量、阿伏加德罗常数、摩尔质量和气体摩尔体积
摩尔质量以 g·ml-1为单位时,在数值上等于物质的相对原子质量(或相对分子质量)。
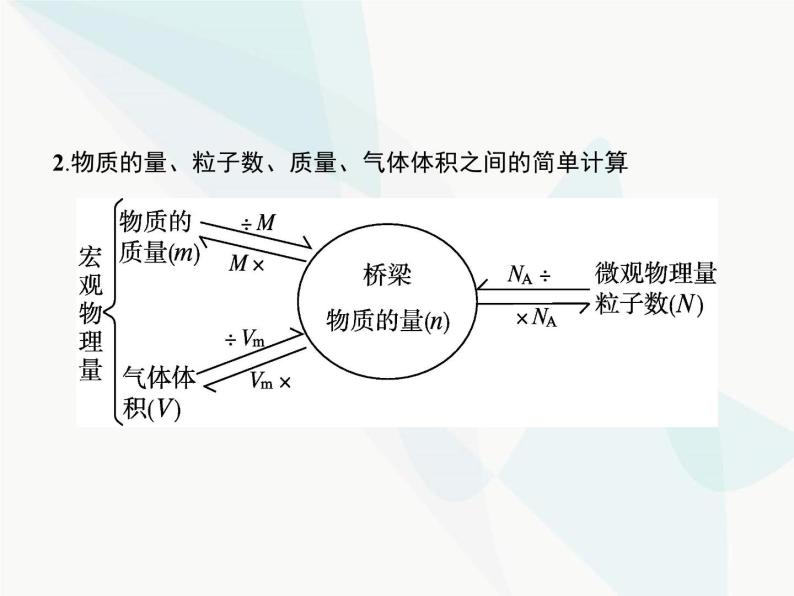
2.物质的量、粒子数、质量、气体体积之间的简单计算
典例1(2022年浙江7月学考)下列物理量的单位为“摩尔(ml)”的是( )A.质量B.物质的量 C.时间D.温度
答案 B 解析 质量的单位是“千克”“克”等,故不选A;物质的量的单位是“摩尔(ml)”,故选B;时间的单位是“秒”“分钟”等,故不选C;温度的单位是“开尔文”“摄氏度”等,故不选D。
典例2(2020年浙江1月学考,改编)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.28 g乙烯和丙烯的混合物完全燃烧,产生的CO2分子数目为2.5NAB.在0.01 ml·L-1的H2SO4溶液中,含有的H+数目为 g石墨中,含有的质子数目为6NAD.标准状况下,5.6 L CCl4中含有C—Cl的数目为NA
答案 C解析 A项,乙烯和丙烯的最简式相同为CH2,28 g乙烯和丙烯的混合物相当于2 ml CH2完全燃烧,产生的CO2分子数目为2NA,A不正确;B项,硫酸溶液中的c(H+)=0.02 ml·L-1,但未指明溶液体积,无法计算H+数目,B不正确;C项,12 g石墨含有1 ml碳原子,即6 ml质子,数目为6NA,C正确;D项,标准状况下,CCl4不是气体,已知5.6 L CCl4无法计算其物质的量,D不正确。故选C。
考点2物质的量浓度1.物质的量浓度的含义(1)物质的量浓度表示单位体积的溶液里所含溶质B的物质的量,符号为cB。(2)物质的量浓度的数学表达式是 ,常用单位为ml·L-1,nB为溶质B的物质的量,V为溶液的体积。
2.配制一定物质的量浓度的溶液(1)容量瓶的使用①常见的规格有50 mL、100 mL、250 mL、500 mL和1 000 mL等。②容量瓶上标注有温度、刻度线和容积。③使用容量瓶的第一步操作是检查是否漏水。(2)以配制1 000 mL 1.0 ml·L-1的NaCl溶液为例。②实验仪器:主要有天平、药匙、烧杯、量筒、玻璃棒、1 000 mL 容量瓶、胶头滴管。
计算:m(NaCl)=1.0 ml·L-1×1 L×58.5 g·ml-1=58.5 g称量:根据计算结果,称量NaCl固体溶解:将称量好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。转移:待恢复到室温后,将烧杯中的溶液沿玻璃棒转移到容量瓶中。洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。定容:将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶盖,反复上下颠倒,摇匀。装瓶:若不马上使用,应将配好的溶液装入试剂瓶,并贴好标签。
(3)误差分析。根据 判断,产生误差的根本原因是:在操作中溶质的质量mB和溶液的体积V存在误差。若在操作中造成mB偏大或V偏小,则cB偏大;若造成mB偏小或V偏大,则cB偏小。
典例3(2022年浙江7月学考)配制100 mL 1.00 ml·L-1 NaCl溶液,不需要用到的实验仪器是( )A.天平B.烧杯C.容量瓶(100 mL)D.圆底烧瓶
答案 D 解析 配制100 mL 1.00 ml·L-1 NaCl溶液,用天平称取氯化钠固体,用烧杯溶解氯化钠,用100 mL 容量瓶定容,不需要圆底烧瓶,故选D。
典例4关于容量瓶的使用,下列操作正确的是( )A.使用前要检查容量瓶是否漏水B.用蒸馏水洗涤后必须要将容量瓶烘干C.为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行D.为了使所配溶液浓度均匀,定容结束后,手握瓶颈,左右振荡
答案 A解析 A项,容量瓶使用前需检查是否漏水,方法是在容量瓶中装入少量水,塞好塞子,用右手食指顶住,左手持瓶底,倒转,观察是否漏水,若不漏水,将塞子旋转180度,再倒转看是否漏水,A正确;B项,容量瓶在配制溶液时需要加蒸馏水定容,故使用前不需要干燥,B不正确;C项,容量瓶只能用来配制溶液,不能在容量瓶中进行固体溶解、溶液稀释等操作,C不正确;D项,摇匀的方法是用右手食指顶住塞子,左手持瓶底倒转,反复数次即可,不可左右振荡,D不正确。故选A。
典例5实验室配制480 mL 0.10 ml·L-1的氢氧化钠溶液,有如下操作步骤:①将已经称量的氢氧化钠固体放入小烧杯中,加适量蒸馏水溶解。②把①所得溶液小心转入容量瓶中。③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,将洗涤液都转入容量瓶,并轻轻摇匀。⑤将NaOH溶液装入试剂瓶,贴上标签。⑥将容量瓶瓶塞塞紧,上下振荡摇匀。
请回答下列问题:(1)计算需要NaOH固体的质量为 g。 (2)本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、 。 (3)操作步骤的正确顺序为 。(填序号) (4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)没有进行步骤④ ;定容时俯视刻度线 。
答案 (1)2.0 g (2)500 mL容量瓶、胶头滴管(3)①②④③⑥⑤ (4)偏低 偏高解析 (1)配制500 mL 0.10 ml·L-1的氢氧化钠溶液,应选择500 mL的容量瓶,则需要氢氧化钠固体的质量为:0.5 L×0.10 ml·L-1×40 g·ml-1=2.0 g;(2)配制500 mL 0.10 ml·L-1的氢氧化钠溶液要用到的仪器:天平、药匙、烧杯、玻璃棒、500 mL容量瓶和胶头滴管,所以还缺少的仪器:500 mL容量瓶、胶头滴管;(3)配制500 mL 0.10 ml·L-1的氢氧化钠溶液的操作步骤:计算、称量、溶解、冷却、移液、洗涤、定容、装瓶、贴标签,所以正确的操作顺序是①②④③⑥⑤;(4)没有进行步骤④,会导致部分溶质损耗,溶质物质的量将偏小,所配的溶液浓度将偏低;定容时俯视刻度线,会导致溶液体积偏小,所配的溶液浓度将偏高。
考点3相关计算1.物质的量浓度的相关计算(1)正确判断溶液中的溶质,并求其物质的量。(2)准确计算溶液的体积:不能用水的体积代替溶液的体积,应根据V= 求算。(3)溶液稀释前后,溶质的物质的量不变:c1×V1=c2×V2。2.物质的量应用于化学方程式的简单计算在化学方程式中,参与反应的各物质的物质的量之比等于各物质的化学计量数之比。
3.有关过量问题的计算(1)化学反应中,给出两种或两种以上反应物的量,求生成物的量的计算。处理方法:先根据化学方程式判断哪种物质不足,再用实际参加反应的物质的物质的量进行计算。(2)化学反应中,溶液浓度的变化引起的过量或不足的计算。处理方法:根据反应原理,定性判断做出分析后再计算。例如:浓盐酸和MnO2反应制取氯气,随着反应的进行,浓盐酸变稀后不再与MnO2反应;浓硫酸和铜反应生成SO2,随着反应的进行,浓硫酸变稀后不再与铜反应;浓硫酸和锌反应生成SO2,随着反应的进行,浓硫酸变稀后继续与锌反应生成H2。(3)溶质不足,但溶剂可继续反应。处理方法:判断反应物是否与溶质、溶剂都能反应。如:钠与盐酸反应,先考虑与酸反应,酸反应完后,过量的钠还能与水继续反应。
4.其他重要计算(1)混合气体平均摩尔质量的计算: =M1×V1%+M2×V2%+……(M1、M2指成分1、2的摩尔质量,V1%、V2%指成分1、2的体积分数)(2)气体密度与气体摩尔质量的关系M=ρ×Vm(M:g·ml-1,ρ:g·L-1,Vm:L· ml-1)(3)溶液中溶质的物质的量浓度和质量分数间的关系
典例7(2022年浙江7月学考)为测定某抗胃酸药片中碳酸钙的质量分数(设该药片中的其他成分不与盐酸或氢氧化钠反应):Ⅰ.向0.100 0 g药片粉末中依次加入20.00 mL 蒸馏水、25.00 mL 0.100 0 ml·L-1稀盐酸,使之充分反应。Ⅱ.中和过量的盐酸,消耗0.100 0 ml·L-1 NaOH溶液13.00 mL。请计算:(1)Ⅱ中消耗NaOH的物质的量为 ml。 (2)0.100 0 g药片消耗HCl的物质的量为 ml。 (3)药片中碳酸钙的质量分数为 。
2024高考化学基础知识综合复习第4讲物质的量及在化学计算中的应用课件: 这是一份2024高考化学基础知识综合复习第4讲物质的量及在化学计算中的应用课件,共33页。PPT课件主要包含了要点导引·定锚点,教材研析·固基础,物质的量,关系与换算,物质的量浓度,③实验步骤,相关计算,实战演练·微知著,答案C,25mol等内容,欢迎下载使用。
高中化学学考复习第4讲物质的量及在化学计算中的应用课件: 这是一份高中化学学考复习第4讲物质的量及在化学计算中的应用课件,共33页。PPT课件主要包含了要点导引·定锚点,教材研析·固基础,物质的量,关系与换算,物质的量浓度,③实验步骤,相关计算,实战演练·微知著,答案C,25mol等内容,欢迎下载使用。
高中化学第二节 金属材料课文内容课件ppt: 这是一份高中化学第二节 金属材料课文内容课件ppt,共31页。PPT课件主要包含了mol·L-1,100mol,右盘2ag,72L,6mol·L-1,2mL,课堂练习等内容,欢迎下载使用。












