


- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题7 化学与传统文化课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题8 常见无机物性质的转化课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题9 原子结构、分子结构与性质的基础考查课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 晶体类型 晶体结构课件PPT 课件 0 次下载
- 新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT 课件 0 次下载
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题9 题型专攻2 分子结构与性质简答题集训课件PPT
展开一、以备课组为单位制定好二轮复习计划。第一,用什么资料,怎样使用资料;第二,在那些核心考点上有所突破,准备采取什么样的措施;第三,用时多长,怎样合理分配。二、怎样查漏。第一,教师根据一轮复习的基本情况做出预判; 第二,通过检测的方式了解学情。三、怎样补缺。1、指导学生针对核心考点构建本专题的知识网络;2、针对学生在检测或考试当中出现的问题,教师要做好系统性讲评;3、教育学生在对待错题上一定要做到:错题重做,区别对待,就地正法。 4、抓好“四练”。练基本考点,练解题技巧,练解题速度,练答题规范。
题型专攻2 分子结构与性质简 答题集训
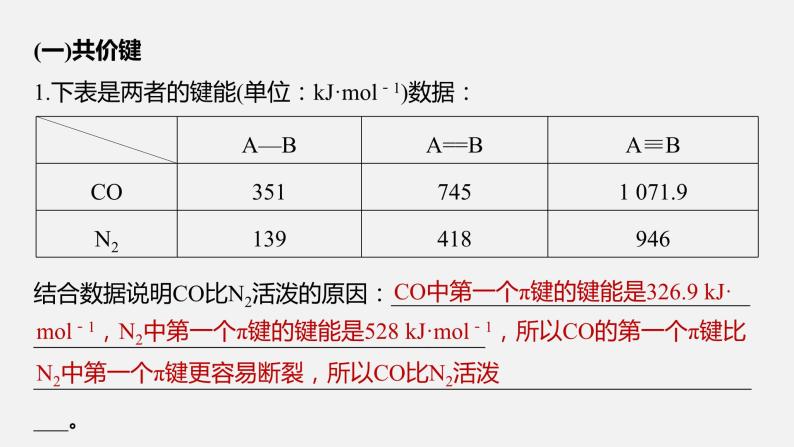
(一)共价键1.下表是两者的键能(单位:kJ·ml-1)数据:
结合数据说明CO比N2活泼的原因:_______________________________________________________________________________________________________________________________________。
CO中第一个π键的键能是326.9 kJ·
ml-1,N2中第一个π键的键能是528 kJ·ml-1,所以CO的第一个π键比N2中第一个π键更容易断裂,所以CO比N2活泼
2.两种三角锥形气态氢化物PH3和NH3的键角分别为93°6′和107°,试分析PH3的键角小于NH3的原因:_________________________________________________________________________________________________________________________________。3.NF3的键角____NH3的键角(填“>”“<”或“=”),理由是_____________________________________________________________________________________________。
电负性:N>P,中心原子的电负性越
大,成键电子对离中心原子越近,成键电子对之间的距离越小,成键电子对之间的排斥力增大,键角变大
性比H大,NF3中N原子周围电子云的密度减小,成键电子对之间的排斥力较小,因而键角较小
4.H3O+中H—O—H的键角比H2O中H—O—H的键角大,原因是______________________________________________________________________。5.CH4、NH3、H2O的VSEPR模型都是_________,键角分别是________、______、______;分析它们键角差异的原因:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
氧原子有2个孤电子对,H3O+中的氧原子有1个孤电子对,排斥力较小
CH4中键与键之间的排斥
力一样,是正四面体形,键角为109°28′;而其他两个分子均有未成键的孤电子对,孤电子对间的排斥力>孤电子对与σ键电子对间的排斥力>σ键电子对间的排斥力。由于孤电子对对成键电子的排斥作用,使得成键电子间夹角变小,H2O中有两个孤电子对,NH3中有一个孤电子对,故H2O中键角比NH3更小
6.H2S键角比H2Se大的原因:________________________________________________________。7. 的键角小于 的原因是______________________________________________________________________________________________________。8. 中H—N—H的键角比NH3中H—N—H的键角_____(填“大”或“小”),理由是_____________________________________________________________________________________________________。
电负性:S>Se,共用电子对离S近,共用
电子对,孤电子对与成键电子对间的斥力更大,导致 的键角小于
中N形成4个σ键,而NH3分子中N有1个孤电子
对,孤电子对对H—N的排斥力更大,H—N—H的键角变小
(二)氢键9.H2S的熔点为-85.5 ℃,而与其具有类似结构的H2O的熔点为0 ℃,极易结冰成固体,二者物理性质出现差异的原因是___________________________________________________________。10.NH3常用作制冷剂,原因是____________________________________________________________。11.硝酸和尿素的相对分子质量接近,但常温下硝酸为挥发性液体,尿素为固体,请解释原因:________________________________________________________________________________。
氢键,而H2S分子间只存在较弱的范德华力
NH3分子间能形成氢键,沸点高,易液
化,汽化时吸收大量的热
尿素分子间存在氢键,使其熔、沸点升高,而
硝酸分子内存在氢键,使其熔、沸点降低
12.氨气极易溶于水的原因为____________________________________________________________________________。13.N2H4与O2的相对分子质量相近,但N2H4的熔点(2 ℃)、沸点(114 ℃)分别远远高于O2的熔点(-218 ℃)、沸点(-183 ℃),原因是_________________________________________________________________。14.H2O、PH3、KH按熔点由高到低的顺序排列为______________,熔点差异的原因是____________________________________________________________。
氨气和水都是极性分子,依据“相似相溶”
规律,且氨气分子与水分子间能形成氢键
存在氢键,O2分子之间为范德华力,氢键比范德华力更强
KH为离子晶体,H2O、PH3均为分子晶体,H2O分子间
15.硼酸分子的结构简式可写为B(OH)3,其晶体为层型片状结构,容易在层与层之间裂解,这是因为在平面层内硼酸分子之间通过______结合,而层与层之间通过__________结合。16. 的分子内部存在氢键,画出氢键结构:__________。17.HSCN的结构有两种,其中硫氰酸(H—S—C≡N)的沸点低于异硫氰酸(H—N==C==S),原因是_______________________________________________________。
异硫氰酸分子间可形成氢键,而硫氰酸分子间
(三)配位键、配合物18.CO为配合物中常见的配体。CO作配体时,提供孤电子对的通常是C原子而不是O原子,其原因是______________________________________________________________________。19.镍的氨合离子[Ni(NH3)6]2+中存在的化学键有_______(填字母)。A.离子键 B.共价键 C.配位键 D.氢键E.σ键 F.π键20.Cu2O与NH3·H2O反应能形成较稳定的[Cu(NH3)2]+的原因是__________________________________________________。
C元素的电负性比O元素小,C原子提供孤
电子对的倾向更大,更易形成配位键
中的N原子提供孤电子对,与Cu+形成配位键
21.C3+在水中易被还原成C2+,而在氨水中可稳定存在,其原因为________________________________。22.一种钴的配合物乙二胺四乙酸合钴的结构为 ,1 ml该配合物形成的配位键有_____ ml,配位原子是________。
C3+可与NH3形成较稳定的配合物
23.TiCl4可以与胺形成配合物,如[TiCl4(CH3NH2)2]、[TiCl4(H2NCH2CH2NH2)]等。(1)[TiCl4(H2NCH2CH2NH2)]中Ti的配位数是_____。(2)1 ml H2NCH2CH2NH2中含有的σ键数目为_______。(3)配合物[TiCl4(H2NCH2CH2NH2)]与游离的H2NCH2CH2NH2分子相比,其H—N—H的键角______(填“较大”“较小”或“相同”),原因是________________________________________________________________________________________________________________________。
H2NCH2CH2NH2通过配位键与Ti结合后,原来的孤电子对变为成键电子对,对N—H成键电子对的排斥力减小,N—H之间的键角增大
24.邻二氮菲( )中N原子可与Fe2+通过配位键形成橙红色邻二氮菲亚铁离子,利用该反应可测定Fe2+浓度,该反应的适宜pH范围为2~9,试解释选择该pH范围的原因:__________________________________________________________________________________________________________________________________________。
当H+浓度较高时,邻二氮菲中的N优先
与H+形成配位键,导致与Fe2+配位的能力减弱;若OH-浓度较高时,OH-与Fe2+反应,也会影响与邻二氮菲配位
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题15 题型专攻5 化学反应历程图像分析课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题15 题型专攻5 化学反应历程图像分析课件PPT,共41页。PPT课件主要包含了高考化学二轮复习策略,真题演练,核心精讲,考向预测等内容,欢迎下载使用。
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题12 题型专攻4 电化学离子交换膜的分析与应用课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题12 题型专攻4 电化学离子交换膜的分析与应用课件PPT,共23页。PPT课件主要包含了高考化学二轮复习策略,高考必备,真题演练,H2O+2e-,由电极a到电极b,H2O-4e-,O2↑+4H+,考向预测,K2SO4等内容,欢迎下载使用。
新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT: 这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题10 题型专攻3 物质结构与性质选择题课件PPT,共50页。PPT课件主要包含了高考化学二轮复习策略,核心精讲,第一电离能FN,电负性CHSi,真题演练,B正确,考向预测等内容,欢迎下载使用。