













2024年高考化学一轮复习(新高考版) 第8章 第46讲 化学平衡状态与平衡常数
展开1.掌握化学平衡状态的特征及判定方法。2.了解化学平衡常数的含义及影响因素。3.能利用化学平衡常数进行有关计算。
考点一 可逆反应、化学平衡状态
考点二 化学平衡常数
真题演练 明确考向
可逆反应、化学平衡状态
1.可逆反应(1)概念在同一条件下,既可以向 进行,同时又能向 进行的化学反应。(2)特点
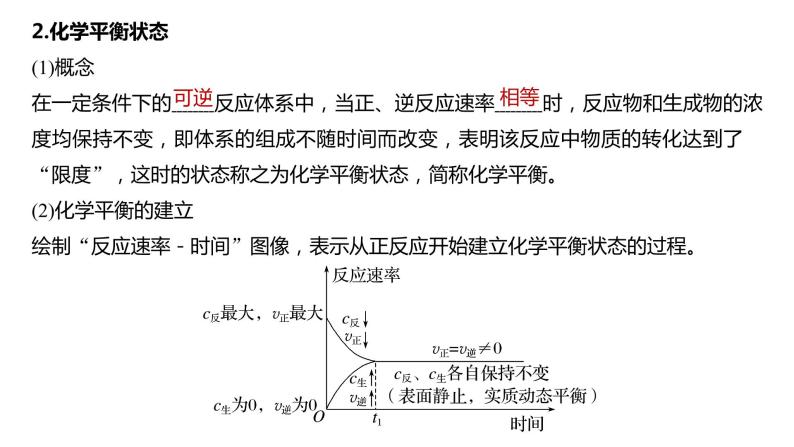
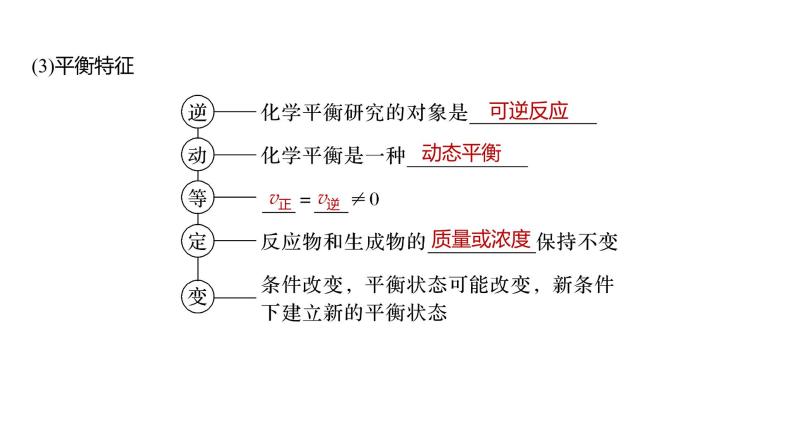
2.化学平衡状态(1)概念在一定条件下的 反应体系中,当正、逆反应速率 时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。(2)化学平衡的建立绘制“反应速率-时间”图像,表示从正反应开始建立化学平衡状态的过程。
(4)化学平衡状态的判断方法
②宏观组成标志各组分的浓度保持不变,或各组分的质量、物质的量、百分含量、质量分数等保持不变的状态是平衡状态。
③间接标志a.有气体参加的 反应,气体的总压强、总体积、总物质的量不变时,达到平衡状态。b.如果平衡体系中的物质有颜色,则平衡体系的颜色不变时,达到平衡状态。c.气体的密度、气体的平均相对分子质量不变时,要具体分析各表达式中的分子或分母变化情况,判断是否平衡(若体系中各组分均为气体,气体质量守恒;若体系中不全是气体,要注意气体质量变化)。
2.化学反应达到平衡后,反应物和生成物的浓度或百分含量相等( )3.在一定条件下,向密闭容器中充入1 ml N2和3 ml H2充分反应,生成2 ml NH3( )
一、可逆反应的特征1.在一密闭容器中进行反应:2X(g)+Y(g) 2Z(g)。已知反应过程中某一时刻X、Y、Z的浓度分别为0.3 ml·L-1、0.1 ml·L-1、0.4 ml·L-1,当反应达到平衡时,不可能存在的是A.c(X)=0.5 ml·L-1B.c(Y)+c(X)=0.5 ml·L-1C.c(Y)+c(Z)=1.05 ml·L-1D.c(X)+c(Y)+c(Z)=0.75 ml·L-1
不确定下一时刻反应进行的方向,因此需要考虑反应进行的方向并结合极限思想解答。若该时刻后反应正向进行且Y全部转化为Z,则 2X(g) + Y(g) 2Z(g)某时刻/(ml·L-1) 0.3 0.1 0.4转化/(ml·L-1) 0.2 0.1 0.2平衡/(ml·L-1) 0.1 0 0.6若反应逆向进行,且Z全部转化为X和Y,则 2X(g)+Y(g) 2Z(g)某时刻/(ml·L-1) 0.3 0.1 0.4转化/(ml·L-1) 0.4 0.2 0.4平衡/(ml·L-1) 0.7 0.3 0
平衡时0.1 ml·L-1<c(X)<0.7 ml·L-1,可能等于0.5 ml·L-1,故A不选;平衡时0.1 ml·L-1<c(Y)+c(X)<1.0 ml·L-1,c(Y)+c(X)可能等于0.5 ml·L-1,故B不选;平衡时0.3 ml·L-1<c(Y)+c(Z)<0.6 ml·L-1,不可能等于1.05 ml·L-1,故C选;平衡时0.7 ml·L-1<c(X)+c(Y)+c(Z)<1.0 ml·L-1,0.75 ml·L-1介于0.7 ml·L-1和1.0 ml·L-1之间,故D不选。
二、平衡状态的标志2.在一定温度下的恒容容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的浓度之比等于化学计量数之比;⑦某种气体的百分含量。(1)能说明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是__________(填序号,下同)。(2)能说明I2(g)+H2(g) 2HI(g)达到平衡状态的是________。(3)能说明2NO2(g) N2O4(g)达到平衡状态的是______________。(4)能说明C(s)+CO2(g) 2CO(g)达到平衡状态的是______________。(5)能说明NH2COONH4(s) 2NH3(g)+CO2(g)达到平衡状态的是_________。(6)能说明5CO(g)+I2O5(s) 5CO2(g)+I2(s)达到平衡状态的是_________。
3.若上述题目中的(1)~(4)改成一定温度下的恒压密闭容器,结果又如何?(1)__________________。(2)__________________。(3)__________________。(4)__________________。
1.概念在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,即化学平衡常数,用符号 表示。2.表达式对于一般的可逆反应mA(g)+nB(g) pC(g)+qD(g),当在一定温度下达到平衡时,K=____________ (固体和纯液体的浓度视为常数,通常不计入化学平衡常数表达式中)。
3.影响因素K只受 影响,与反应物或生成物的浓度变化无关,与压强变化、是否使用催化剂无关。4.平衡常数的意义及应用(1)判断可逆反应进行的程度
(2)判断反应是否达到平衡或进行的方向
Q<K,反应向 反应方向进行;Q=K,反应处于 状态;Q>K,反应向 反应方向进行。(3)判断可逆反应的热效应
2.平衡常数发生变化,化学平衡一定发生移动( )3.化学平衡发生移动,平衡常数一定发生变化( )4.平衡常数K越大,表示反应进行得越快( )5.温度不变,增大反应物浓度,平衡正向移动,平衡常数增大( )6.反应A(g)+B(g) C(g)达到平衡后,温度不变,增大压强,平衡正向移动,平衡常数增大( )
一、化学平衡常数与化学方程式的关系1.请写出下列反应的平衡常数,并找出K1和K2、K3的关系。
2.已知下列反应的平衡常数:①H2(g)+S(s) H2S(g) K1;②S(s)+O2(g) SO2(g) K2;则反应H2(g)+SO2(g) O2(g)+H2S(g)的平衡常数K=______(用K1和K2表示)。
(3)两化学方程式相加得到新的化学方程式,其化学平衡常数是两反应平衡常数的乘积。
二、化学平衡常数的应用3.研究发现,液态苯是优质储氢材料:C6H6(l)+3H2(g) C6H12(l)。一定温度下,在密闭容器中充入一定量液态苯(足量)和适量氢气,经反应达到平衡后,测得c(H2)=2 ml·L-1。保持温度不变,将体积压缩至原来的一半,达到新平衡时c(H2)为A.1 ml·L-1 B.2 ml·L-1C.3 ml·L-1 D.4 ml·L-1
4.在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表所示。下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应B.25 ℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5C.80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 ml·L-1,则此时v正>v逆D.80 ℃达到平衡时,测得n(CO)=0.3 ml,则Ni(CO)4的平衡浓度为2 ml·L-1
温度升高,平衡常数减小,故正反应为放热反应,A项正确;
80 ℃达到平衡时,若n(CO)=0.3 ml,c(CO)=1 ml·L-1,故c[Ni(CO)4]=K·c4(CO)=2×14 ml·L-1=2 ml·L-1,D项正确。
5.已知反应:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。(1)此反应的平衡常数表达式为K=________。(2)温度降低,则K______(填“增大”“减小”或“不变”)。(3)已知1 100 ℃时,K=0.263。若1 100 ℃时测得c(CO2)=0.025 ml·L-1,c(CO)=0.01 ml·L-1,此时该反应________(填“处于”或“不处于”)化学平衡状态,化学反应速率:正反应速率____(填“>”“<”或“=”)逆反应速率。
1.(2020·北京,10)一定温度下,反应I2(g)+H2(g) 2HI(g)在密闭容器中达到平衡时,测得c(I2)=0.11 mml·L-1,c(HI)=0.78 mml·L-1。相同温度下,按下列4组初始浓度进行实验,反应逆向进行的是
(注:1 mml·L-1=10-3 ml·L-1)
题目中缺少c(H2),无法计算K,则不能通过Q与K的关系判断平衡的移动方向,但可比较4个选项中Q的大小关系,Q越大,则可能逆向移动。
Q(C)的值最大,答案为C。
2.[2022·浙江6月选考,29(1)]主要成分为H2S的工业废气的回收利用有重要意义。回收单质硫。将三分之一的H2S燃烧,产生的SO2与其余H2S混合后反应:2H2S(g)+SO2(g) S8(s)+2H2O(g)。在某温度下达到平衡,测得密闭系统中各组分浓度分别为c(H2S)=2.0×10-5ml·L-1、c(SO2)=5.0×10-5 ml·L-1、c(H2O)=4.0×10-3 ml·L-1,计算该温度下的平衡常数K=________。
②tm时,v正______v逆(填“大于”“小于”或“等于”)。③tm时v逆______tn时v逆(填“大于”“小于”或“等于”),理由是__________________。④若平衡时溶液的pH=14,则该反应的平衡常数K为________。
1.一定温度下,向一体积不变的密闭容器中加入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·ml-1下列有关该反应的叙述正确的是A.达到平衡状态时,正、逆反应速率相等B.达到平衡状态时,SO2和O2的浓度都为0C.若起始时加入2 ml SO2和1 ml O2,则达平衡时放出的热量为196.6 kJD.若反应达到平衡状态后,2 min时生成a ml SO3,则4 min时生成2a ml SO3
可逆反应达到平衡状态时,正、逆反应速率相等,A正确;该反应为可逆反应,达到平衡状态时,反应物不能完全转化为生成物,所以SO2和O2的浓度不等于0,B错误;因为是可逆反应,所以消耗的SO2的物质的量小于2 ml、消耗O2的物质的量小于1 ml,放出的热量小于196.6 kJ,C错误;反应达到平衡状态时,各物质的物质的量不变,2~4 min三氧化硫的物质的量不变,为a ml,D错误。
2.一定条件下,对于可逆反应:X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 ml·L-1、0.3 ml·L-1、0.08 ml·L-1,则下列判断正确的是A.X、Y的转化率相等B.平衡时,Y和Z的生成速率之比为2∶3C.c1∶c2=3∶1D.c1的取值范围为0.04 ml·L-1<c1<0.14 ml·L-1
根据三段式, X(g)+ 3Y(g) 2Z(g)起始/ (ml·L-1) c1 c2 c3转化/(ml·L-1) x 3x 2x平衡/(ml·L-1) 0.1 0.3 0.08有关系式:c1-x=0.1,c2-3x=0.3,c3+2x=0.08或c1+x=0.1,c2+3x=0.3,c3-2x=0.08。
平衡时,Y和Z的生成速率之比应为化学计量数之比,即为3∶2,故B错误;根据关系式,若c3=0,则根据c3+2x=0.08,得x=0.04,c1-x=0.1,得c1=0.14,若c1=0,c1+x=0.1,则x=0.1,根据c2+3x=0.3,c3-2x=0.08,得c2=0,c3=0.28,所以0<c1<0.14 ml·L-1,故D错误。
3.下列关于化学平衡常数K的说法错误的是A.对于某一可逆反应来说,K只与温度有关,与浓度无关B.升高温度,K变小,正反应是放热反应C.K越大,反应进行得越彻底D.使用合适的催化剂,既可以改变反应速率,也可以改变平衡常数K
平衡常数只受温度影响,使用催化剂可以加快反应速率,但不影响平衡常数,D错误。
5.利用CO2和CH4反应制备合成气(CO、H2)的原理是CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH>0。温度为T ℃时,该反应的平衡常数为K。下列说法正确的是A.K越大,说明反应速率、CO2的平衡转化率越大B.增大压强,平衡向逆反应方向移动,K减小C.升高温度,反应速率和平衡常数K都增大D.加入催化剂,能提高合成气的平衡产率
K越大,说明反应进行的越完全,CO2的平衡转化率越大,但反应速率受外界因素影响,反应速率不一定越大,A错误;K只受温度影响,温度不变,则K不变,B错误;升高温度,活化分子百分数增大,反应速率增大,该反应ΔH>0,为吸热反应,则平衡常数K增大,C正确;加入催化剂,只能改变反应速率,平衡不移动,则不能提高合成气的平衡产率,D错误。
6.在一容积不变、绝热的密闭容器中发生可逆反应:2X(s) Y(g)+Z(g),以下说法不能说明该反应达到化学平衡状态的是A.混合气体的密度不再变化B.反应容器中Y的质量分数不变C.该反应的化学平衡常数不变D.容器中混合气体的平均相对分子质量不变
由2X(s) Y(g)+Z(g)可知,反应前后气体的质量是变量,容器的体积不变,反应过程中混合气体的密度是变量,当混合气体的密度不再变化时,各气体的质量不再改变,反应达到平衡状态,故A不符合题意;当反应容器中Y的质量分数不变时,体积不变,说明Y的浓度不再改变,反应达到平衡,故B不符合题意;由2X(s) Y(g)+Z(g)反应是在绝热的密闭容器中进行可知,温度是变量,而平衡常数只是温度的函数,当反应的化学平衡常数不变时,说明温度不再改变,反应达到平衡状态,故C不符合题意;
7.下列说法中可以证明反应H2(g)+I2(g) 2HI(g)已达平衡状态的是①单位时间内生成n ml H2的同时生成n ml HI;②一个H—H断裂的同时有两个H—I断裂;③百分含量w(HI)=w(I2);④反应速率v(H2)=v(I2)=v(HI);⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1;⑥温度和体积一定时,生成物浓度不再变化;⑦温度和体积一定时,容器内的压强不再变化;⑧条件一定时,混合气体的平均相对分子质量不再变化;⑨温度和体积一定时,混合气体颜色不再变化;⑩温度和压强一定时,混合气体的密度不再变化A.①②③④ B.②⑥⑨C.②⑥⑨⑩ D.③⑤⑥⑦⑧
①单位时间内生成n ml H2的同时生成n ml HI,速率之比不等于化学计量数之比,错误;②一个H—H断裂的同时有两个H—I断裂,等效于两个H—I形成的同时有两个H—I断裂,反应达到平衡状态,正确;③百分含量w(HI)=w(I2),相等并不是不变,错误;④反应速率v(H2)=v(I2)=v(HI),未体现正与逆的关系,且速率之比不等于化学计量数之比,错误;⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1不能说明反应达到平衡状态,错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正、逆反应速率相等,反应达到平衡状态,正确;⑦温度和体积一定时,容器内的压强始终不变,错误;⑧条件一定时,混合气体的平均相对分子质量始终不变,错误;⑨温度和体积一定时,混合气体颜色不再变化,说明c(I2)不再发生变化,反应达到平衡状态,正确;⑩温度和压强一定时,由于反应前后体积和气体的质量始终不变,则混合气体的密度始终不变,即密度不再变化不能说明反应达到平衡状态,错误。
8.一定温度下,反应N2O4(g) 2NO2(g)的焓变为ΔH。现将1 ml N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是
A.①② B.②④ C.③④ D.①④
ΔH是恒量,不能作为判断平衡状态的标志;该反应是充入1 ml N2O4,正反应速率应是逐渐减小直至不变,③曲线趋势不正确。
9.(2022·北京丰台区高三期末)某温度下,在密闭容器中进行反应:H2(g)+CO2(g) H2O(g)+CO(g) ΔH>0,已知H2(g)和CO2(g)的初始浓度均为0.01 ml·L-1,测得H2的平衡转化率为60%,下列说法不正确的是A.CO2的平衡转化率为60%B.升高温度平衡常数K增大C.该温度下反应的平衡常数K=2.25D.若初始H2(g)、CO2(g)、H2O(g)、CO(g)的浓度均为0.01 ml·L-1,则反应逆向进行
根据题目已知信息,列三段式:H2(g)+CO2(g) H2O(g)+CO(g)起始/(ml·L-1) 0.01 0.01 0 0转化/(ml·L-1) 0.006 0.006 0.006 0.006平衡/(ml·L-1) 0.004 0.004 0.006 0.006因此,二氧化碳的平衡转化率为60%,A项正确;此反应为吸热反应,温度升高,平衡正向移动,平衡常数K增大,B项正确;
10.在1 L密闭容器中,加入5 ml A物质,在一定条件下同时发生下列两个反应:①2A(g) 2B(g)+C(g);②A(g) C(g)+D(g)。当达到平衡时,测得c(A)=2.5 ml·L-1,c(C)=2.0 ml·L-1。则下列说法正确的是A.达到平衡时A的总转化率为40%B.达到平衡时K1=0.5C.达到平衡时c(B)=2c(D)D.达到平衡时K2=1.2
②A(g) C(g)+D(g),设参加此反应的A为y ml,根据②的化学方程式可知生成的C为y ml,生成的D为y ml,
平衡时c(B)=1 ml·L-1、c(D)=1.5 ml·L-1,则3c(B)=2c(D),故C错误;
11.(2021·重庆1月适应性测试,14)MTP是一类重要的药物中间体,可以由TOME经环化后合成。其反应式为:为了提高TOME的转化率,反应进行时需及时从溶液体系中移出部分甲醇。TOME的转化率随反应时间的变化如图所示。设TOME的初始浓度为a ml·L-1,反应过程中的液体体积变化忽略不计。下列说法错误的是A.X、Y两点的MTP的物质的量浓度相等B.X、Z两点的瞬时速率大小为v(X)>v(Z)
C项,若Z点为平衡点,此时c(TOME)=0.02a ml·L-1,c(MTP)= 0.98a ml·L-1,但因移出甲醇,甲醇浓度不为0.98a ml·L-1,错误;D项,0~150 min时间内,Δc(MTP)=0.67a ml·L-1,正确。
A项,因起始浓度相同,X、Y两点转化率相同,所以MTP的浓度也相等,正确;B项,Z点转化率高,此时TOME的浓度只有0.02a ml·L-1,所以瞬时速率:v(X)>v(Z),正确;
12.(1) 工业上,裂解正丁烷可以获得乙烯、丙烯等化工原料。反应1:C4H10(g,正丁烷) CH4(g)+C3H6(g) ΔH1反应2:C4H10(g,正丁烷) C2H6(g)+C2H4(g) ΔH2某温度下,向2 L恒容密闭容器中投入2 ml正丁烷,假设控制反应条件,只发生反应1,达到平衡时测得CH4的体积分数为 。下列情况表明上述反应达到平衡的是______(填字母,下同)。A.混合气体的密度保持不变B.甲烷、丙烯的生成速率相等C.混合气体压强保持不变D.丙烯的体积分数保持不变
气体密度等于气体质量除以容器体积,反应1的反应物和生成物都是气体,气体质量不变,容器体积不变,因此在恒温恒容条件下气体密度始终不变,因此密度不变不能作为判断平衡的标志,故A不符合题意;甲烷、丙烯均属于生成物,两者的化学计量数相同,无论是否达到平衡,它们的生成速率始终相等,故B不符合题意;在恒容恒温下,气体分子数逐渐增多,气体压强逐渐增大,当压强不变时反应达到平衡,故C符合题意;丙烯体积分数由0逐渐增大,丙烯体积分数不变时表明反应达到平衡,故D符合题意。
(2)深入研究碳、氮元素的物质转化有着重要的实际意义,合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l) ΔH=-87.0 kJ·ml-1若向某恒温且恒容的密闭容器中加入等物质的量的NH3和CO2,发生上述反应。下列叙述不能说明反应已经达到平衡状态的是_____。A.断裂6 ml N—H的同时断裂2 ml O—HB.压强不再变化C.混合气体的密度不再变化D.CO2的体积分数不再变化
根据方程式可知:每2分子NH3反应产生1分子CO(NH2)2,会断裂2个N—H,即1个NH3分子断裂1个N—H。现在断裂6 ml N—H, 就是6 ml NH3反应,要生成3 ml H2O,形成6 ml O—H;断裂2 ml O—H,就是1 ml水发生反应,生成水的物质的量大于消耗水的物质的量,正、逆反应速率不相等,没有达到平衡,A符合题意;该反应在恒温恒容条件下进行,反应前后气体的物质的量发生改变,当气体压强不再变化时,气体的物质的量不变,则反应达到了平衡状态,B不符合题意;反应前后气体的质量发生变化,而反应在恒温恒容条件下进行,气体的体积不变,则混合气体的密度不再变化,说明反应达到了平衡状态,C不符合题意;若CO2的体积分数不再变化,说明混合气体中各气体的物质的量不变,反应达到了平衡状态,D不符合题意。
(3)反应:4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),恒温恒容情况下,下列说法能判断此反应达到平衡的是________。A.气体物质中氮元素与氧元素的质量比不变B.容器内气体密度不变C.容器内气体颜色不变D.容器内NaNO3的浓度保持不变
反应物NO2中氮元素与氧元素的质量比为7∶16,生成物NO中氮元素和氧元素的质量比为7∶8,所以未平衡前气体物质中氮元素和氧元素的质量比是变量,当气体物质中氮元素与氧元素的质量比不变时,反应达到了平衡,故A选;随着反应的进行,气体物质的质量在减小,而容器体积不变,所以混合气体的密度在减小,当容器内气体密度不变时,反应达到了平衡,故B选;NO2是红棕色气体,Cl2是黄绿色气体,未平衡前混合气体的颜色在改变,当容器内气体颜色不变时,说明NO2和Cl2的浓度均不再改变,反应达到了平衡,故C选;NaNO3是固体,不能用固体浓度不变衡量反应是否达到平衡,故D不选。
13.已知:CO(g)+2H2(g) CH3OH(g) ΔH(1)经测定不同温度下该反应的平衡常数如下:
该反应为________(填“放热”或“吸热”)反应。
根据数据可知,随着温度的升高,平衡常数减小,平衡逆向移动,逆反应为吸热反应,则正反应为放热反应。
(2)250 ℃时,某时刻测得该反应的反应物与生成物浓度为c(CO)=0.4 ml·L-1、c(H2)=0.4 ml·L-1、c(CH3OH)=0.8 ml·L-1,则此时v正___(填“>”“=”或“<”)v逆。
(3)某温度下,在体积固定的2 L密闭容器中将1 ml CO和2 ml H2混合,使反应达到平衡,实验测得平衡时与起始时的气体压强比值为0.7,则该反应的平衡常数为______(结果保留1位小数)。
2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数课件PPT: 这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数课件PPT,共46页。PPT课件主要包含了同一条件,反应物,生成物,3特征,答案B,K1·K2,3意义及影响因素,答案D等内容,欢迎下载使用。
第46讲 化学平衡状态与平衡常数-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第46讲 化学平衡状态与平衡常数-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共37页。PPT课件主要包含了复习目标,可逆反应化学平衡状态,考点一,必备知识,易错辨析,专项突破,化学平衡常数,考点二,真题演练等内容,欢迎下载使用。
高考化学一轮复习课件18.化学平衡状态和化学平衡常数(含解析): 这是一份高考化学一轮复习课件18.化学平衡状态和化学平衡常数(含解析),共27页。PPT课件主要包含了化学平衡,可逆反应,同一条件,随堂练习,不再改变,正反应,逆反应,动态平衡,Ⅰ直接标志,逆反应方向必须对立等内容,欢迎下载使用。












