














2024年高考化学一轮复习(新高考版) 第1章 第4讲 氧化还原反应的概念和规律
展开第4讲 氧化还原反应的概念和规律
[复习目标] 1.了解氧化还原反应的概念。2.会用“单、双线桥”分析电子转移的方向和数目。3.掌握氧化性、还原性强弱的比较及价态规律的应用。
考点一 氧化还原反应及相关概念
1.氧化还原反应
(1)判断依据:反应前后有元素的________发生变化。
(2)本质:____________(得失或偏移)。
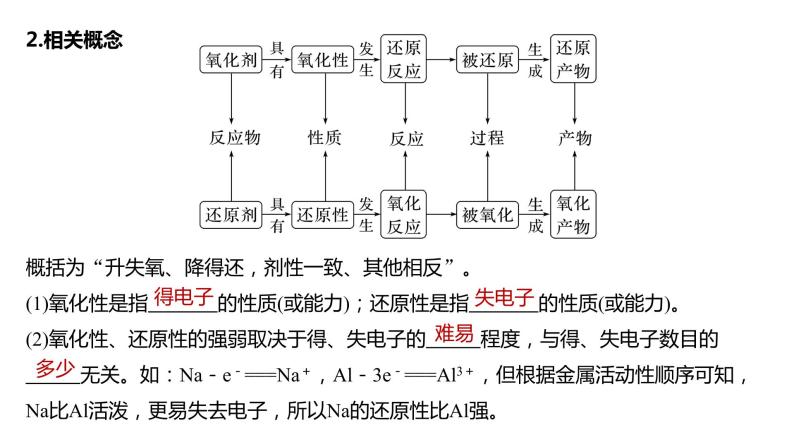
2.相关概念
概括为“升失氧、降得还,剂性一致、其他相反”。
(1)氧化性是指________的性质(或能力);还原性是指________的性质(或能力)。
(2)氧化性、还原性的强弱取决于得、失电子的________程度,与得、失电子数目的__________无关。如:Na-e-===Na+,Al-3e-===Al3+,但根据金属活动性顺序可知,Na比Al活泼,更易失去电子,所以Na的还原性比Al强。
应用举例
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
上述反应中,氧化剂是______,还原剂是________,氧化产物是__________,还原产物是________,KMnO4发生__________反应,HCl发生________反应,盐酸表现的性质是________性和________性;生成1 mol Cl2时转移电子数目为__________,被氧化的HCl的物质的量是________ mol。
3.氧化还原反应电子转移的表示方法
(1)双线桥法:①标变价,②画箭头(反应物指向生成物),③算数目,④说变化。
用双线桥法标出MnO2与浓盐酸加热反应的电子转移的方向和数目:
________________________________________________________________________。
归纳 。
(2)单线桥法:箭头由失电子原子指向得电子原子,线桥上只标电子转移的数目,不标“得”“失”字样。
用单线桥法标出铜和浓硝酸反应的电子转移的方向和数目:
________________________________________________________________________。
归纳 。
4.常见的氧化剂和还原剂
(1)常见的氧化剂
常见的氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(2)常见的还原剂
常见的还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
金属氢化物(如NaH等)、NaBH4也是重要还原剂。
(3)元素化合价处于中间价态的物质既有氧化性,又有还原性。如:
其中:Fe2+、SO主要表现________性,H2O2主要表现________性。
(4)分析氧化还原反应,走好关键第一步——正确标出元素的化合价
请标出下列陌生物质中元素化合价
Li2NH:N____,LiNH2:N____,N2H4:N____,
Na2S2O3:S____,S2O:S____,C2O:C____,
HCN:C____、N____,BH:B____、H____,CuH:Cu____、H____,MnO(OH):Mn____,FePO4:Fe____,CrO:Cr____,K2FeO4:Fe____,LiFePO4:Fe____,CuFeS2:Fe____。
5.氧化还原反应与四种基本反应类型的关系
分析下列四个化学反应:
A.2Na+2H2O===2NaOH+H2↑
B.2HClO2HCl+O2↑
C.4NH3+5O24NO+6H2O
D.4Fe(OH)2+O2+2H2O===4Fe(OH)3
其中属于区域“1”的是______(填字母,下同),属于区域“2”的是______,属于区域“3”的是______,属于区域“4”的是______。
1.在氧化还原反应中,非金属单质不一定是氧化剂( )
2.某元素从游离态变为化合态,则该元素一定被还原( )
3.有单质参加或生成的化学反应不一定是氧化还原反应( )
4.氧化还原反应中的反应物不是氧化剂就是还原剂( )
5.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原( )
一、氧化还原反应概念的考查
1.(2023·长沙模拟)关于反应5K2S2O8+2MnSO4+8H2O===2KMnO4+8H2SO4+4K2SO4的说法不正确的是( )
A.K2S2O8发生还原反应
B.KMnO4是氧化产物
C.消耗3.6 g H2O时,转移0.25 mol电子
D.氧化剂和还原剂的物质的量之比是2∶5
二、双线桥、单线桥表示法
2.氢化钠(NaH)广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为_______________________________________________。
(2)写出NaH与H2O反应的化学方程式,并用“双线桥”标出电子转移的方向和数目:________________________________________________________________________
________________________________________________________________________,
氧化产物和还原产物的物质的量之比为____________________________________________。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
3.已知NaBH4与水反应的化学方程式为NaBH4+2H2O===NaBO2+4H2↑
回答下列问题:
(1)用“单线桥”标出电子转移的方向和数目:
________________________________________________________________________,
氧化剂:____________,还原剂:____________。
(2)若生成标准状况下4.48 L H2,则转移电子的物质的量为________。
考点二 氧化还原反应的强弱规律及价态规律
(一)强弱规律
1.氧化性、还原性强弱的比较方法
(1)根据化学方程式判断
氧化剂(氧化性)+还原剂(还原性)===还原产物+氧化产物
氧化性:氧化剂____氧化产物;
还原性:还原剂____还原产物。
(2)根据相同条件下产物的价态高低判断
如2Fe+3Cl22FeCl3;Fe+SFeS,则氧化性:Cl2____S。
(3)根据反应条件、浓度大小及反应的剧烈程度判断
反应条件要求越低,浓度越大,反应越剧烈,对应物质的氧化性或还原性越强。
应用举例
1.MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,可判断氧化性:KMnO4____MnO2。
2.下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与FeCl3溶液 ⑤Cl2与NaOH溶液 ⑥Fe与HNO3溶液
⑦Fe与H2SO4溶液 ⑧Na与O2
(1)由于浓度不同而发生不同氧化还原反应的是______________________(填序号,下同)。
(2)由于温度不同而发生不同氧化还原反应的是________________________。
(3)氧化还原反应不受浓度、温度影响的是__________________________________________。
2.氧化性、还原性强弱的比较规律
(1)氧化性
一般规律:元素非金属性越强,其单质的氧化性越强;金属活动性越强,对应金属的简单阳离子氧化性越弱。
试比较下列单质或离子的氧化性
①Cl2、Br2、I2、S
______________________________________________________________________________
②H+、Cu2+、Zn2+、Na+
______________________________________________________________________________
(2)还原性
一般规律:元素金属性越强,其单质的还原性越强;非金属活动性越强,对应元素形成的简单阴离子还原性越弱;电解池中在阳极优先放电的微粒还原性较强。
试比较下列单质或离子的还原性
①Mg、Fe、Cu、Ag
______________________________________________________________________________
②Br-、I-、S2-
______________________________________________________________________________
③Cl-、SO、OH-、Cu
______________________________________________________________________________
3.先后规律及应用
(1)同时含有几种还原剂(或氧化剂),发生氧化还原反应时,还原性(或氧化性)强的优先反应,即“强者优先”,如在FeBr2溶液中通入少量Cl2时,因为还原性:________>________,所以________先与Cl2反应。
(2)常见的强弱顺序
氧化性:MnO(H+)>Cl2>Br2>Fe3+>I2>稀H2SO4>S,还原性:Mn2+<Cl-<Br-<Fe2+<I-<SO2(SO)<S2-。
(二)价态规律
1.价态归中规律思维模型
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
例如,不同价态的硫之间可以发生的氧化还原反应是
注:不会出现⑤中H2S转化为SO2而H2SO4转化为S的情况。
2.歧化反应规律思维模型
“中间价―→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH===NaCl+NaClO+H2O。
3.应用
(1)判断同种元素不同价态的物质间发生氧化还原反应的可能性。如浓H2SO4与SO2不发生反应。
(2)根据化合价判断反应体系中的氧化剂、还原剂及氧化产物、还原产物。如对于反应6HCl+NaClO3===NaCl+3Cl2↑+3H2O中,氧化剂为NaClO3,还原剂为HCl,氧化产物和还原产物都为Cl2。
1.金属原子失电子数越多,金属的还原性越强( )
2.元素的非金属性越强,其氧化性越强,相应单质越活泼( )
3.强氧化剂与强还原剂混合不一定能发生氧化还原反应( )
4.向浓H2SO4中通入H2S气体,1 mol浓H2SO4转移电子数可能是6NA,也可能是2NA( )
5.1 mol KClO3与足量的浓盐酸反应,转移电子数为6NA( )
6.SO2的还原性较强,而浓硫酸具有很强的氧化性,所以浓硫酸不能干燥SO2气体( )
一、强弱规律的应用
1.铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:①Tl3++2Ag===Tl++2Ag+,②Ag++Fe2+===Ag+Fe3+,③Fe+2Fe3+===3Fe2+,下列离子氧化性比较顺序正确的是( )
A.Tl3+>Fe3+>Ag+ B.Fe3+>Ag+>Tl3+
C.Tl+>Ag+>Fe2+ D.Tl3+>Ag+>Fe3+
2.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe2++Cl2===2Fe3++2Cl-
3.根据反应事实判断性质的强弱。
①向Co2O3固体中滴加浓盐酸,有黄绿色气体生成
②将氯气通入碘水中,溶液褪色生成两种酸(HCl和HIO3)
则Cl2、HIO3、Co2O3的氧化性由强到弱的顺序:_____________________;HCl、CoCl2、I2的还原性由强到弱的顺序:____________________________________________。
4.实验室制备高铁酸钾(K2FeO4)并探究其性质。
(1)制备K2FeO4的反应为3Cl2+2Fe(OH)3+10KOH===2K2FeO4+6KCl+8H2O,由此得出氧化性:Cl2________(填“>”或“<”)FeO。
(2)K2FeO4的性质探究:用KOH溶液将紫色K2FeO4固体溶出,得到紫色K2FeO4溶液。取少量该溶液,滴加盐酸,有Cl2产生。
该实验表明Cl2和FeO的氧化性强弱关系与(1)相反,原因是___________________________。
二、价态规律的应用
5.氯气跟氢氧化钾溶液在一定条件下发生如下反应:Cl2+KOH―→KX+KY+H2O(未配平),KX在一定条件下能自身反应:KX―→KY+KZ(未配平,KY与KZ的物质的量之比为1∶3),以上KX、KY、KZ均是含氯元素的一元酸的钾盐,由以上条件推知在KX中氯元素的化合价是( )
A.+1 B.+3 C.+5 D.+7
6.K35ClO3晶体与含有H37Cl的浓盐酸反应生成Cl2,化学方程式为KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O,该反应生成氯气的摩尔质量为________。
7.已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl
②Q+H2OX+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是________________。
1.(2020·山东,2)下列叙述不涉及氧化还原反应的是( )
A.谷物发酵酿造食醋
B.小苏打用作食品膨松剂
C.含氯消毒剂用于环境消毒
D.大气中NO2参与酸雨形成
2.(2020·北京,3)水与下列物质反应时,水表现出氧化性的是( )
A.Na B.Cl2 C.NO2 D.Na2O
3.(2022·辽宁,6)镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入CCl4,振荡,静置,液体分层。下列说法正确的是( )
A.褪色原因为I2被Fe还原
B.液体分层后,上层呈紫红色
C.镀锌铁钉比镀锡铁钉更易生锈
D.溶液恢复棕色的原因为I-被氧化
4.(2022·浙江6月选考,10)关于反应Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,下列说法正确的是( )
A.H2SO4发生还原反应
B.Na2S2O3既是氧化剂又是还原剂
C.氧化产物与还原产物的物质的量之比为2∶1
D.1 mol Na2S2O3发生反应,转移4 mol电子
5.(2022·湖南,9)科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO转化为N2进入大气层,反应过程如图所示。
下列说法正确的是( )
A.过程Ⅰ中NO发生氧化反应
B.a和b中转移的e-数目相等
C.过程 Ⅱ 中参与反应的n(NO)∶n(NH)=1∶4
D.过程Ⅰ→Ⅲ的总反应为NO+NH===N2↑+2H2O
新高考化学一轮复习精品课件 第1章 第4讲 氧化还原反应的概念和规律 (含解析): 这是一份新高考化学一轮复习精品课件 第1章 第4讲 氧化还原反应的概念和规律 (含解析),共60页。PPT课件主要包含了必备知识,应用举例,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024年高考化学一轮复习氧化还原反应的概念和规律课件: 这是一份2024年高考化学一轮复习氧化还原反应的概念和规律课件,共50页。PPT课件主要包含了目标导航,考点一,考点二,真题演练等内容,欢迎下载使用。
第04讲 氧化还原反应的概念和规律-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第04讲 氧化还原反应的概念和规律-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共50页。PPT课件主要包含了目标导航,考点一,考点二,真题演练等内容,欢迎下载使用。












