

- 考点05 分子的空间结构——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2) 学案 0 次下载
- 考点06 分子结构与物质性质——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2) 学案 0 次下载
- 考点07 晶体与晶胞的计算——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2) 学案 0 次下载
- 考点08 分子晶体 共价晶体——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2) 学案 0 次下载
- 考点10 过渡晶体 混合型晶体 配合物与超分子——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2) 学案 0 次下载
考点09 金属晶体 离子晶体——2022-2023学年高二化学下学期期末复习考点精练学案(人教版2019选择性必修2)
展开 必考点09 金属晶体 离子晶体
题型一 金属键、金属晶体的性质
例1.(2023·济南高二检测)下列有关金属的说法正确的是( )
A.金属原子的核外电子在金属晶体中都是自由电子
B.金属导电的实质是金属阳离子在外电场作用下的定向移动
C.金属原子在化学变化中失去的电子数越多,其还原性越强
D.金属晶体的堆积方式会影响金属的性质
【答案】D
【解析】因金属的价电子受原子核的吸引力小,则金属原
子中的价电子在金属晶体中为自由电子,而不是所有的核外电子,A错误;金属导电的实质是在外电场作用下自由电子定向移动而产生电流的结果,B错误;金属原子在化学变化中失去电子越容易,其还原性越强,C错误;金属晶体中原子的堆积方式会影响金属的性质,如延展性,D正确。
例2.(2023·四川达州·高二期末)下图是金属晶体的“电子气”理论示意图。用该理论解释金属导电的原因是( )
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有的电子作无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
【答案】B
【解析】“电子气”理论可以很好地解释金属的一些现象,如金属的导电、导热、延展性等。金属中含有金属阳离子和自由电子,在外加电场的作用下,自由电子定向移动形成电流。
例3.(2023·四川达州·高二期中)有四种不同堆积方式的金属晶体的晶胞如图所示,下列叙述错误的是
A.晶体中原子的配位数分别为:①6,②8,③12,④12
B.③为六方堆积
C.晶胞中含有的原子数分别为:③2,④4
D.金属晶体是一种“巨分子”,可能存在分子间作用力
【答案】D
【分析】由金属晶体的晶胞结构图可知,①为简单立方堆积,②为体心立方堆积,③为六方堆积,④为面心立方堆积。
【解析】A.根据晶胞结构可知,晶体中原子的配位数分别为:①6,②8,③12,④12,A项正确;
B.依据上述分析可知,③为六方堆积,B项正确;
C.晶胞中含有的原子数分别为:③为2,④为,C项正确;
D.金属晶体是一种“巨分子”,存在金属阳离子和自由电子之间的相互作用,不存在分子间作用力,D项错误。
答案选D。
例4.(2023·江苏南通·高二期末)对图中某金属晶体结构的模型进行分析,判断下列有关说法正确的是
A.该种堆积方式称为六方堆积 B.该种堆积方式称为体心立方堆积
C.该种堆积方式称为面心立方堆积 D.金属就属于此种堆积方式
【答案】C
【解析】A.由题图知该堆积方式为面心立方堆积,A错误;
B.由题图知该堆积方式为面心立方堆积,B错误;
C.由题图知该堆积方式为面心立方堆积,C正确;
D.的堆积模型为六方堆积,D错误;
故选C。
【解题技巧提炼】
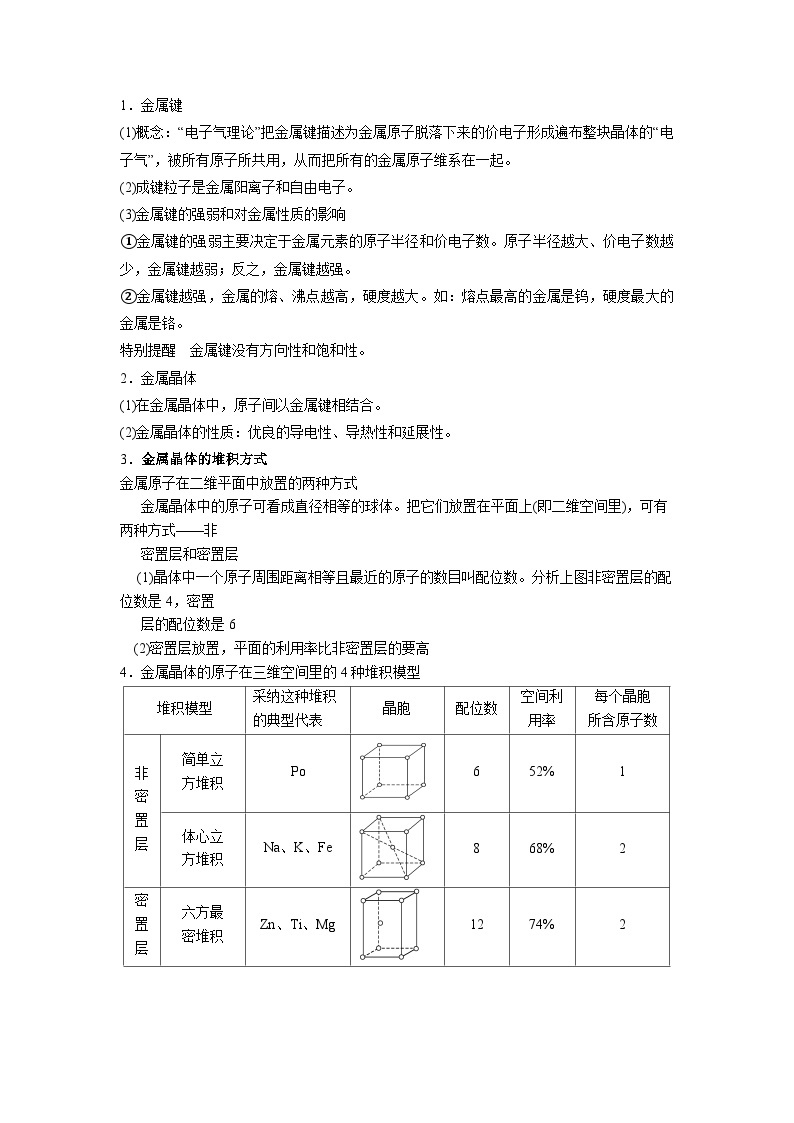
1.金属键
(1)概念:“电子气理论”把金属键描述为金属原子脱落下来的价电子形成遍布整块晶体的“电子气”,被所有原子所共用,从而把所有的金属原子维系在一起。
(2)成键粒子是金属阳离子和自由电子。
(3)金属键的强弱和对金属性质的影响
①金属键的强弱主要决定于金属元素的原子半径和价电子数。原子半径越大、价电子数越少,金属键越弱;反之,金属键越强。
②金属键越强,金属的熔、沸点越高,硬度越大。如:熔点最高的金属是钨,硬度最大的金属是铬。
特别提醒 金属键没有方向性和饱和性。
2.金属晶体
(1)在金属晶体中,原子间以金属键相结合。
(2)金属晶体的性质:优良的导电性、导热性和延展性。
3.金属晶体的堆积方式
金属原子在二维平面中放置的两种方式
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(即二维空间里),可有两种方式——非
密置层和密置层
(1)晶体中一个原子周围距离相等且最近的原子的数目叫配位数。分析上图非密置层的配位数是4,密置
层的配位数是6
(2)密置层放置,平面的利用率比非密置层的要高
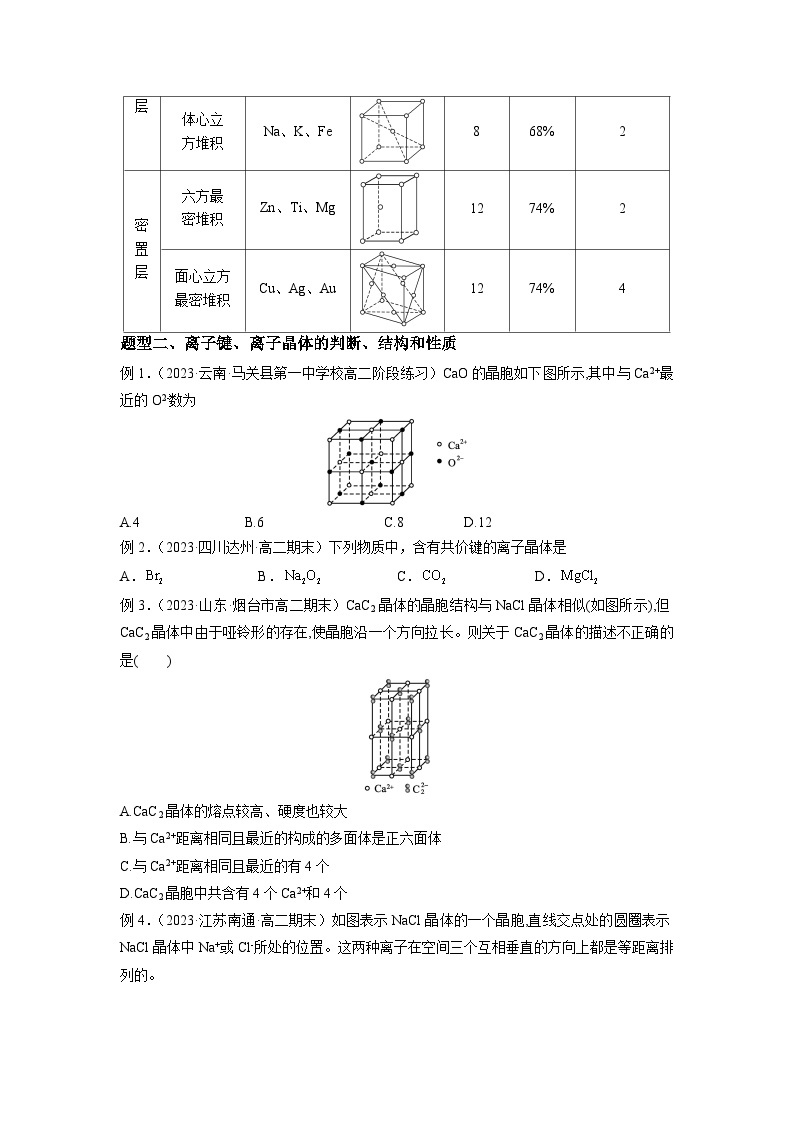
4.金属晶体的原子在三维空间里的4种堆积模型
堆积模型
采纳这种堆积
的典型代表
晶胞
配位数
空间利用率
每个晶胞
所含原子数
非密置层
简单立
方堆积
Po
6
52%
1
体心立
方堆积
Na、K、Fe
8
68%
2
密置层
六方最
密堆积
Zn、Ti、Mg
12
74%
2
面心立方
最密堆积
Cu、Ag、Au
12
74%
4
题型二、离子键、离子晶体的判断、结构和性质
例1.(2023·云南·马关县第一中学校高二阶段练习)CaO的晶胞如下图所示,其中与Ca2+最近的O2-数为
A.4 B.6 C.8 D.12
【答案】B
【解析】根据CaO的晶胞图示可知,与Ca2+最近的O2-有6个,分别位于Ca2+的前、后、左、右、上、下方位。
例2.(2023·四川达州·高二期末)下列物质中,含有共价键的离子晶体是
A. B. C. D.
【答案】B
【解析】A.溴单质是含有非极性键的分子晶体,故A不符合题意;
B.过氧化钠是含有离子键和非极性共价键的离子晶体,故B符合题意;
C.二氧化碳是只含有极性键的分子晶体,故C不符合题意;
D.氯化镁是只含有离子键的离子晶体,故D不符合题意;
故选B。
例3.(2023·山东·烟台市高二期末)CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是( )
A.CaC2晶体的熔点较高、硬度也较大
B.与Ca2+距离相同且最近的构成的多面体是正六面体
C.与Ca2+距离相同且最近的有4个
D.CaC2晶胞中共含有4个Ca2+和4个
【答案】B
【解析】CaC2晶体属于离子晶体,故有较高的熔点和较大的硬度,A正确;因为晶胞沿一个方向拉长,故和Ca2+距离相同且最近的只有4个(与拉长方向垂直的同一面上),4个构成的是正方形,B错;以Ca2+为中心,与之等距离且最近的是同一平面上的4个,C正确;该晶胞中含有Ca2+的个数=12×1/4+1=4,含有的个数=8×1/8+6×1/2=4,D正确。
例4.(2023·江苏南通·高二期末)如图表示NaCl晶体的一个晶胞,直线交点处的圆圈表示NaCl晶体中Na+或Cl-所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表Na+的圆圈涂黑(不必考虑体积大小),以完成NaCl晶胞结构示意图。
(2)在NaCl晶体中,在每个Na+的周围与它最接近且距离相等的Na+共有 个。
(3)在NaCl晶胞中正六面体的顶点上、面上、棱上的Na+或Cl-为该晶胞与其相邻的晶胞所共有。根据(1)中画出的NaCl的晶胞结构示意图分析,一个晶胞中Cl-的个数等于 ,即 (填计算式);Na+的个数等于 ,即 (填计算式)。
(4)设NaCl的摩尔质量为M g·mol-1,NaCl晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA。则NaCl晶体中两个距离最近的钠离子中心之间的距离为 cm。
【答案】(1)答案不唯一,合理即可
(2)12
(3)4 12×+1=4 4 8×+6×=4
(4)
【解析】(1)根据题意可画出NaCl的晶胞结构示意图如下:
(或其他合理的情况)
(2)根据(1)中画出的NaCl晶胞结构示意图分析,每个Na+的周围最接近且距离相等的Na+共有12个。
(3)根据(1)中画出的NaCl晶胞结构示意图分析,在一个NaCl晶胞中,含Cl-的个数为12×+1=4;含Na+的个数为8×+6×=4。
(4)设Cl-与Na+中心之间的最近距离为a cm,则两个最近的Na+中心之间的距离为a cm,根据·NA=M,则a=。所以Na+间的最近距离为 cm。
【解题技巧提炼】
1.离子键及其影响因素
(1)概念:阴、阳离子之间通过静电作用形成的化学键。
(2)影响因素:离子所带电荷数越多,离子半径越小,离子键越强。
特别提醒 离子键没有方向性和饱和性。
2.离子晶体及其物理性质
(1)概念:由阳离子和阴离子相互作用而形成的晶体。
(2)离子晶体的性质
①熔、沸点较高,硬度较大。
②离子晶体不导电,但熔化或溶于水后能导电。
③大多数离子晶体能溶于水,难溶于有机溶剂。
3.常见离子晶体的结构
(1)NaCl晶胞
NaCl晶胞如图所示,每个Na+周围距离最近的Cl-有6个(上、下、左、右、前、后各1个),构成正八面体,每个Cl-周围距离最近的Na+有 6个,构成正八面体,由此可推知晶体的化学式为NaCl。回答下列问题:
①每个Na+(Cl-)周围距离相等且最近的Na+(Cl-)是12个。
②每个晶胞中实际拥有的Na+数是4个,Cl-数是4个。
③若晶胞参数为a pm,则氯化钠晶体的密度为 g·cm-3。
(2)CsCl晶胞
CsCl晶胞如图所示,每个Cs+周围距离最近的Cl-有8个,每个Cl-周围距离最近的Cs+有 8个,它们均构成正六面体,由此可推知晶体的化学式为CsCl。回答下列问题:
①每个Cs+(Cl-)周围距离最近的Cs+(Cl-)有 6个,构成正八面体。
②每个晶胞中实际拥有的Cs+有 1个,Cl-有 1个。
③若晶胞参数为a pm,则氯化铯晶体的密度为 g·cm-3。
题型一 金属键、金属晶体的性质
1.(2023·天津静海·高二阶段练习)下列关于金属及金属键的说法不正确的是
A.金属键不具有方向性和饱和性
B.金属键是金属阳离子与自由电子间的相互作用
C.金属导电是因为在外加电场作用下产生自由电子
D.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用,因而具有延展性
【答案】C
【解析】A.金属键存在于金属阳离子和“自由电子”之间的强的相互作用,不是存在于相邻原子之间的作用力,而是属于整块金属,没有方向性和饱和性,A项正确;
B.金属键是存在于金属阳离子和“自由电子”之间的强的相互作用,这些“自由电子”为所有阳离子所共用,其本质也是电性作用,B项正确;
C.金属中存在金属阳离子和“自由电子”,当给金属通电时,“自由电子”定向移动而导电,C项错误;
D.金属具有具有良好的延展性,受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用,D项正确;
答案选C。
2.(2023·山东济宁·高二期中)下列四种性质的叙述,可能属于金属晶体的是( )
A.由分子间作用力结合而成,熔点低
B.固态时或熔融后易导电,熔点在1 000 ℃左右
C.以共价键结合成三维骨架结构,熔点高
D.固态时不导电,但溶于水或熔融后能导电
【答案】B
【解析】由分子间作用力结合而成,熔点低,为分子晶体的特点,A错误;固态或熔融后能导电,熔点在1 000 ℃左右,可能为金属晶体,B正确;以共价键结合成三维骨架结构,熔点高,是共价晶体的特点,C错误;固态时不导电,不符合金属晶体的特征,D错误。
3.(2023秋·四川内江·高二威远中学校校考期中)有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是
A.①为简单立方堆积;②、③为体心立方堆积;④为面心立方最密堆积
B.每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C.晶胞中原子的配位数分别为:①6,②8,③8,④12
D.空间利用率的大小关系为:①<②<③<④
【答案】B
【解析】A.由金属晶体的晶胞结构图可知:①为简单立方堆积;②为体心立方堆积;③为六方最密堆积;④为面心立方最密堆积,A错误;
B.顶点为8个晶胞共用;面为2个晶胞共用;晶胞体内原子为1个晶胞单独占有。晶胞①中原子个数=8×=1;晶胞②中原子个数=1+8×=2;晶胞③中原子个数=1+8×=2,晶胞④中原子个数=8×+6×=4,B正确;
C.①为简单立方堆积,配位数为6;②为体心立方堆积,配位数为8;③为六方最密堆积,配位数为12;④为面心立方最密堆积,配位数为12,C错误;
D.六方最密堆积与面心立方最密堆积的空间利用率相等,简单立方堆积、体心立方堆积不是最密堆积,空间利用率比六方最密堆积和面心立方最密堆积的小;体心立方堆积空间利用率比简单立方堆积的高,故空间利用率的大小关系为:①<②<③=④,D错误;
故合理选项是B。
4.(2023春·云南曲靖·高二曲靖市马龙区第一中学校考阶段练习)物质结构理论推出:金属键越强,其金属的硬度越大,熔、沸点越高。且研究表明,一般来说,金属阳离子半径越小,所带电荷越多,则金属键越强,由此判断下列说法错误的是
A.硬度:Mg>Al B.熔点:Mg>Ca
C.硬度:Mg>K D.熔点:Ca>K
【答案】A
【解析】A.Mg2+半径比Al3+大,带电荷数比Al3+少,则金属键能Mg<Al,硬度:Mg<Al,A错误;
B.Mg2+半径比Ca2+小,带电荷数相同,则金属键能Mg>Ca,熔点:Mg>Ca,B正确;
C.Mg2+半径比K+小,带电荷数比K+多,则金属键能Mg>K,硬度:Mg>K,C正确;
D.Ca2+半径比K+小,带电荷数比K+多,则金属键能Ca>K,熔点:Ca>K,D正确;
故选A。
题型二、离子键、离子晶体的判断、结构和性质
1.(2023秋·吉林通化·高二梅河口市第五中学校考期末)下列说法中正确的有
①金属晶体的导电性、导热性均与自由电子有关
②离子键是阴、阳离子间的相互吸引作用
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧NaCl晶体中,阴离子周围紧邻的阳离子数为8
A.2个 B.3个 C.4个 D.5个
【答案】B
【解析】①金属晶体的导电性、导热性均与自由电子有关,故正确;
②离子键是阴、阳离子间的静电作用力,包括吸引力和排斥力,故错误;
③分子晶体的熔点不一定比金属晶体低,如汞在常温下为液体,碘是分子晶体,常温下为固体,故错误;
④分子晶体熔、沸点的高低由分子间作用力决定,故错误;
⑤共价晶体是原子通过共价键结合而成,所以共价晶体含有共价键,故正确;
⑥金属晶体由金属阳离子和电子构成,所以含有离子的晶体不一定是离子晶体,可能是金属晶体,故错误;
⑦金刚石、碳化硅、晶体硅均为原子晶体,键能越大,硬度越大,原子半径:C>Si,键长:C-C>C-Si>Si-Si,键能:C-C>C-Si>Si-Si,故硬度由大到小:金刚石>碳化硅>晶体硅,故正确;
⑧NaCl晶体中,阴离子周围紧邻的阳离子数为6,故正确;
综上所述,共4个正确;
故选C。
2.(2023秋·河北邢台·高二邢台市第二中学校考期末)共价键、离子键、范德华力、氢键等都是微观粒子之间的不同作用力,下列物质在熔化时破坏的作用力相同的是
A.硼和金刚石 B.NaCl 和AlN C.干冰和冰 D.Fe和S
【答案】A
【分析】大多非金属元素之间形成的键是共价键,以共价键结合的物质可能为共价晶体,也可能为分子晶体,在分子晶体中还存在分子间作用力;活泼金属和活泼的非金属之间形成的键大多是离子键,离子晶体中含有离子键;金属晶体中含有金属键;电负性很大的元素(N、O、F)与氢元素形成共价键时,H原子几乎是裸露的质子,不同分子之间存在氢键,以此来解答。
【解析】A.金刚石和硼单质都属于共价晶体,原子与原子之间形成共价键,熔化时破坏共价键,A符合题意;
B.NaCl属于离子晶体,钠离子与氯离子之间形成离子键,只存在离子键,熔化时破坏离子键;AlN属于共价晶体,铝原子与氮原子之间通过共价键结合, 熔化时破坏共价键,B不符合题意;
C.干冰和冰都属于分子晶体,分子中都存在共价键,干冰分子间存在分子间作用力,冰中H2O分子间存在分子间作用力和氢键,熔化时干冰破坏分子间作用力,冰熔化时破坏分子间作用力和氢键,C不符合题意;
D.Fe是金属晶体,铁原子与铁原子间形成金属键,熔化时破坏金属键;S单质是分子晶体,硫分子和硫分子之间存在分子间作用力,所以熔化时破坏分子间作用力,D不符合题意;
故选A。
3.(2023秋·吉林通化·高二梅河口市第五中学校考期末)下列有关离子晶体的说法正确的是
A.离子晶体中一定含有金属元素,含有金属元素的化合物一定是离子晶体
B.离子键只存在于离子晶体中,离子晶体中一定含有离子键
C.离子晶体中不可能含有共价键
D.离子晶体受热熔化破坏化学键,吸收热量,属于化学变化
【答案】B
【解析】A.离子晶体中不一定含有金属元素,含有金属元素的化合物不一定是离子晶体,A错误;
B.含有离子键的化合物一定是离子晶体,离子晶体中可能含有共价键,B正确;
C.离子晶体中可能含有共价键,如过氧化钠,C错误;
D.离子晶体受热熔化时,虽然离子键被破坏,但没有生成新的物质,不属于化学变化,如氯化钠晶体熔化,D错误;
故选:B。
4.(2023秋·四川遂宁·高二遂宁中学校考期末)萤石是制作光学玻璃的原料之一,其主要成分氟化钙的晶胞结构如图所示。下列说法错误的是
A.Ca位于元素周期表s区
B.每个周围距离最近且等距的有4个
C.位于构成的四面体空隙
D.基态氟原子核外电子的原子轨道有四种伸展方向
【答案】B
【解析】A.Ca位于第四周期第ⅡA族,为元素周期表s区,A正确;
B.由面心的可知,每个周围距离最近且等距的有8个,B错误;
C.由晶胞结构图可知,距离最近且等距的为4个,所以位于构成的四面体空隙,C正确;
D.基态氟原子核外电子排布式为1s22s22p5,其中s能级有一种伸展方向,p能级有三种伸展方向,共4种,D正确;
故选B。
5.如图为一些晶体中的部分结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨中的某一种。
(1)其中代表金刚石的是 (填字母,下同),其中每个碳原子与 个碳原子最近且距离相等,金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个六元环平均占有的碳原子数为 。
(3)其中表示NaCl的是 ,NaCl晶体中每个Na+周围与它最近且等距离的Na+有 个。
(4)代表CsCl的是 ,它属于 晶体,每个Cs+与 个Cl-紧邻。
(5)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
【答案】(1)D 4 共价 (2)E 2 (3)A 12
(4)C 离子 8 (5)B 分子 12
【解析】根据不同物质晶体的结构特点来分析各图形所代表的物质。NaCl晶胞是立方单元,每个Na+与6个Cl-紧邻,每个Cl-又与6个Na+紧邻,每个Na+周围与其最近且等距离的Na+有12个。CsCl晶体由Cs+、Cl-构成体心立方结构。干冰也是立方体结构,在立方体每个顶点和面心都有1个CO2分子,所以每个CO2分子在三维空间里与其紧邻的CO2分子有12个。金刚石中每个碳原子紧邻4个其他碳原子。石墨的片层结构中每个碳原子紧邻3个碳原子,即每个正六边形占有的碳原子数是6×1/3=2。
1.(2023秋·吉林通化·高二梅河口市第五中学校考期末)萤石是制作光学玻璃的原料之一其主要成分氟化钙的晶胞结构如下图所示。下列说法正确的是
A.氟化钙的化学式为CaF B.每个晶胞中含有14个
C.氟化钙中只含有离子键 D.每个周围距离最近且等距的有4个
【答案】C
【分析】由图可知,位于晶胞的顶点和面心,数目为,位于晶胞体内,数目为8。
【解析】A.根据上述分析可知,数目为4,数目为8,则氟化钙的化学式为2,故A错误;
B.每个晶胞中含有4个,故B错误;
C.氟化钙是由钙离子和氟离子构成的化合物,只含有离子键,故C正确;
D.以面心处为研究对象,每个周围距离最近且相等的有8个,故D错误;
故选C。
2.(2023秋·吉林通化·高二梅河口市第五中学校考期末)金属晶体中金属原子有三种常见的堆积方式,六方最密堆积、面心立方最密堆积和体心立方堆积,下图分别代表着三种晶体的晶体结构,其晶胞内金属原子个数比为
A.1∶2∶1 B.11∶8∶4 C.9∶8∶4 D.9∶14∶9
【答案】A
【解析】根据均摊法可推知,第一个为六方最密堆积的晶胞,此晶胞中有两个金属原子;第二个为面心立方最密堆积的晶胞,此晶胞中有4个金属原子;第三个为体心立方堆积的晶胞,此晶胞中有2个金属原子;所以原子个数比为2∶4∶2,化简为1∶2∶1,所以选A。
3.(2023·高二课时练习)下列关于金属晶体的叙述正确的是
A.用铂金做首饰不能用金属键理论解释
B.固态和熔融时易导电,熔点在1000℃左右的晶体可能是金属晶体
C.Al、Na、Mg的熔点逐渐升高
D.温度越高,金属的导电性越好
【答案】B
【解析】A.用铂金做首饰利用了金属晶体的延展性,能用金属键理论解释,A错误;
B.金属晶体在固态和熔融时能导电,其熔点差异很大,故题设条件下的晶体可能是金属晶体,B正确;
C.一般来说,金属中单位体积内自由电子的数目越多,金属元素的原子半径越小,金属键越强,故金属键的强弱顺序为Al>Mg>Na,其熔点的高低顺序为Al>Mg>Na,C错误;
D.金属的导电性随温度的升高而降低,温度越高,其导电性越差,D错误;
故选:B。
4.(2023秋·山西长治·高二长治市上党区第一中学校校考期末)钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法错误的是
A.该晶体属于离子晶体
B.晶体的化学式为
C.该晶体晶胞结构与相似
D.与每个距离最近且相等的共有3个
【答案】D
【解析】A.Ba是活泼金属,O元素是活泼非金属性,钡在氧气中燃烧时得到一种钡的氧化物属于离子晶体,故A正确;
B.晶胞中Ba2+离子位于晶胞的顶点和面心位置,晶胞中共含有Ba2+离子的个数为8× +6× =4,阴离子位于晶胞的边上和体心位置,共含有阴离子的个数为12×+1=4,阴离子是两个氧原子结合而成的O22-,所以晶胞中Ba2+与阴离子的个数比为1:1,该氧化物为BaO2,故B正确;
C.由晶胞结构可知,离子配位数为6,与NaCl结构相似,故C正确;
D.以顶点Ba2+离子研究,与之距离相等且最近的Ba2+位于面心上,每个Ba2+离子为12个面共用,相等且最近的Ba2+共有12个,故与每个Ba2+距离相等且最近的Ba2+共有12个,故D错误;
故答案:D。
5.(2023·高二课时练习)图a~d是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是
A.a和c B.b和c C.b和d D.a和d
【答案】D
【解析】NaCl晶体是简单立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由图可知,a和d属于从NaCl晶体中分割出来的结构图,故选D。
6.(2023·高二课时练习)下列有关金属键的叙述错误的是
A.金属键没有饱和性和方向性
B.金属键中的自由电子属于整块金属
C.金属的性质和金属固体的形成都与金属键有关
D.金属键是金属阳离子和自由电子之间存在的强烈的静电吸引作用
【答案】D
【解析】A.金属键是金属阳离子和自由电子之间的强烈相互作用,自由电子为整个金属的所有阳离子所共有,所以金属键没有方向性和饱和性,故A正确;
B.自由电子在金属中自由运动,为整个金属的所有阳离子所共有,属于整块金属,故B正确;
C.金属的性质和金属固体的形成都与金属键有关,故C正确;
D. 金属键是金属阳离子和自由电子之间的强烈相互作用,既包括金属阳离子与自由电子之间的静电吸引作用,也包括金属阳离子之间及自由电子之间的静电排斥作用,故D错误;
故答案选D。
7.(2023·高二课时练习)离子晶体熔点的高低取决于晶体中阳离子与阴离子之间的静电作用,静电作用大则熔点高,静电作用小则熔点低。试根据学过的知识,判断、、、四种晶体熔点的高低顺序是
A. B.
C. D.
【答案】C
【解析】离子晶体中,离子键越强,熔、沸点越高,而离子所带电荷数越多,半径越小,离子键越强。、、都带2个电荷,、、都带1个电荷,,,故熔点,故选:C。
8.(2023·高二课时练习)要使金属晶体熔化必须破坏其中的金属键。金属晶体熔点的高低和硬度的大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷的多少及半径大小有关。由此判断下列说法正确的是
A.金属镁的熔点大于金属铝 B.碱金属的熔点从到是逐渐增大的
C.金属铝的硬度大于金属钠 D.金属钙的硬度小于金属钡
【答案】C
【解析】A.镁离子的半径比铝离子大且所带电荷数少,所以金属镁的金属键比金属铝弱,熔点和硬度都小,A错误;
B.从到,离子的半径是逐渐增大的,所带电荷数相同,金属键逐渐减弱,熔点和硬度都逐渐减小,B错误;
C.因离子的半径小而所带电荷数多,故金属铝的金属键比金属钠强,所以金属铝的熔点和硬度比金属钠都大,C正确;
D.钙离子的半径比钡离子小而所带电荷数相同,则金属钙的金属键比金属钡强,所以金属钙的熔点和硬度比金属钡都大,D错误;
故选C。
9.(2023·高二课时练习)下图是金属晶体内部的电气理论示意图,仔细观察并用电气理论解释金属导电的原因是
A.金属能导电是因为含有金属阳离子
B.金属能导电是因为含有的自由电子在外电场作用下做定向运动
C.金属能导电是因为含有电子且无规则运动
D.金属能导电是因为金属阳离子和自由电子的相互作用
【答案】B
【分析】金属能导电,是由于金属晶体中存在自由移动的电子,在外加电场作用可发生定向移动,以此解答该题。
【解析】组成金属晶体的微粒为金属阳离子和自由电子,在外加电场作用下电子可发生定向移动,故能导电,与金属阳离子无关。
综上所述,本题选B。
10.(2023春·四川内江·高二四川省内江市第六中学校考开学考试)下列物质的熔、沸点高低顺序中,正确的是
A.金刚石>晶体硅>金刚砂 B.
C. D.金刚石>生铁>纯铁>钠
【答案】B
【解析】A.金刚石、晶体硅、金刚砂都是共价晶体,原子半径越小,键能越大,熔沸点越高,熔沸点:金刚石>金刚砂>晶体硅,故A错误;
B.都是分子晶体,相对分子质量越大熔沸点越高,熔沸点 ,故B正确;
C.MgO是离子晶体,熔沸点最高,H2O、Br2、O2都是分子晶体,H2O 分子间能形成氢键,熔沸点较高,Br2的相对分子质量大于O2,所以熔沸点,故C错误;
D.金刚石是共价晶体,熔沸点最高,生铁、纯铁、钠都是金属晶体,合金的熔沸点低于成分金属,所以熔沸点:金刚石>纯铁>生铁>钠,故D错误;
选B。
11.(2022秋·甘肃张掖·高二高台县第一中学校考阶段练习)氧化亚铜(Cu2O)主要用于制造杀虫剂、分析试剂和红色玻璃等,在潮湿的空气中会被逐渐氧化为黑色的氧化铜。以肼(N2H4)为原料与醋酸铜反应制取Cu2O的反应为4Cu(CH3COO)2+N2H4+2H2O=2Cu2O↓+N2+8CH3COOH。生成的沉淀需先用水洗涤,再用乙醇洗涤。下列说法错误的是
A.N2H4能与水分子形成分子间氢键
B.如图所示的Cu2O的晶胞中,与Cu+距离最近且等距离的O2-的个数是4
C.每生成标准状况下2.24 LN2,反应转移电子数为0.4×6.02×1023
D.沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,从而快速得到较干燥的产品
【答案】B
【解析】A.含N、O元素的电负性大,原子半径小,它们的氢化物之间含氢键,则N2H4能与水分子形成分子间氢键,A正确;
B.图中白球位于顶点和体心,其个数为8×+1=2;黑球位于体内,个数为4,则白球与黑球的个数比为1:2,由Cu2O可知黑球为Cu+,白球的配位数为4,Cu+的配位数是8,B错误;
C.由反应可知生成l mol气体转化4 mol电子,每生成标准状况下2.24 L N2,其物质的量是0.1 mol,则反应转移电子数为0.4×6.02×1023,C正确;
D.乙醇与水互溶,且具有还原性,则沉淀用水洗后,再用乙醇洗可以除去Cu2O表面的水,防止被氧气氧化,D正确;
故合理选项是B。
12.(2023·高二课时练习)CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。则关于CaC2晶体的描述不正确的是
A.CaC2晶体的熔点较高、硬度也较大
B.与Ca2+距离相同且最近的构成的多面体是正六面体
C.与Ca2+距离相同且最近的有4个
D.CaC2晶胞中共含有4个Ca2+和4个
【答案】B
【解析】A.CaC2晶体属于离子晶体,故有较高的熔点和较大的硬度,故A正确;
B.因为晶胞沿一个方向拉长,故和Ca2+距离相同且最近的Ca2+只有4个(与拉长方向垂直的同一面上),4个Ca2+构成的是正方形,故B错误;
C.以Ca2+为中心,与之等距离且最近的是同一平面上的4个Ca2+,故C正确;
D.根据均摊原则,该晶胞中含有Ca2+的个数=12×1/4+1=4,含有的个数=8×1/8+6×1/2=4,故D正确;
选B。
13.(2022春·山东聊城·高二校考阶段练习)已知冰晶石(Na3AlF6)熔融时的电离方程式为Na3AlF6=3Na++。现有冰晶石的结构单元如图所示,位于大立方体顶点和面心,位于大立方体的12条棱的中点和8个小立方体的体心,▽是图中、中的一种。下列说法正确的是
A.冰晶石是共价晶体
B.大立方体的体心处▽代表Na+
C.与Na+距离相等且最近的Na+有6个
D.冰晶石晶体的密度为g•cm-3
【答案】BD
【解析】A.由冰晶石熔融时能发生电离,可知冰晶石是离子晶体,A项错误;
B.每个晶胞中含有的个数为8×+6×=4,的个数为12×+8=11,根据冰晶石的化学式可知,与Na+的个数比为1∶3,故▽与必然表示同一种微粒,即为Na+,B项正确;
C.▽和8个小立方体的体心间的距离最近且相等,则与Na+距离相等且最近的Na+有8个,C项错误;
D.由B选项的分析可以得出,晶胞中含有4个“Na3AlF6”,晶胞的体积为(a×10-8cm)3,则晶体的密度为=g·cm-3,D项正确;
故选BD。
14.(2023秋·山东烟台·高二统考期末)是目前使用最广泛的储氢材料,储氢后转化为。合金由甲、乙两个原子层交替紧密堆积而成,丙是该合金的晶胞结构(已知晶胞的体积约为)。下列说法正确的是
A.该晶体为离子晶体
B.该晶体的一个晶胞中原子数为15
C.该晶体中1个原子与12个原子配位
D.若忽略储氢前后晶胞体积变化,储氢后氢在合金中的密度约为
【答案】BD
【解析】A.该晶体为合金,不属于离子晶体,A错误;
B.根据“均摊法”,晶胞中含个La,结合化学式可知,该晶体的一个晶胞中原子数为15,B正确;
C.以底面La为例,同层周围有6个Ni,上下层还各有6个,则该晶体中1个原子与18个原子配位,C错误;
D.根据“均摊法”,晶胞中含个La,储氢后转化为,则晶胞含有18个氢,储氢后氢在合金中的密度约为,D正确;
故选BD。
15.(2022春·河北唐山·高二统考期中)下图为几种晶体或晶胞的示意图:
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是_______。
(2)冰、金刚石、MgO、干冰4种晶体的熔点由高到低的顺序为_______。
(3)MgO晶胞与NaCl晶胞相同,每个MgO晶胞中平均占有_______个Mg2+,由与Mg2+最近的O2-围成的空间几何构型为_______。
(4)Cu晶体中原子堆积方式如上图所示,则该堆积方式为_______,CaCl2晶体中Ca2+的配位数是_______。
(5)冰的熔点远高于干冰,除H2O是_______分子外(填“极性”或“非极性”),还有一个重要的原因是_______。
【答案】(1)金刚石(晶体)
(2)金刚石>MgO>冰>干冰
(3) 4 正八面体
(4) 面心立方堆积 8
(5) 极性 水分子间存在氢键
【分析】冰晶体为分子晶体,靠氢键和范德华力结合;金刚石晶体为共价晶体,碳原子以共价键结合;Cu晶体为金属晶体,靠金属键结合;MgO为离子晶体,靠离子键结合;CaCl2为离子晶体,靠离子键结合;干冰为分子晶体,靠范德华力结合。
(1)
粒子之间以共价键结合形成的晶体为共价晶体,即金刚石晶体;
(2)
一般情况下,熔点:共价晶体>离子晶体>分子晶体,冰和干冰虽都为分子晶体,但冰晶体中还存在氢键,熔点较高,所以4种晶体的熔点由高到低的顺序为:金刚石>MgO>冰>干冰;
(3)
MgO晶胞中Mg2+位于顶点和面心,个数为=4;以任一顶点的Mg2+为例,距离其最近的O2-位于该Mg2+所在棱的棱心,共有6个,围成正八面体;
(4)
该晶胞中,Cu位于顶点和面心,为面心立方堆积;以顶面面心的Ca2+为例,该晶胞中距离其最近的Cl-有4个,其上方的晶胞中还有4个,所以CaCl2晶体中Ca2+的配位数是8;
(5)
H2O分子的正负电荷中心不重合,为极性分子;且水分子间存在氢键,所以冰的熔点远高于干冰。
16.(2022·全国·高二专题练习)回答以下问题:
(1)金属Cu晶体采取的是以下___________(填序号)面心立方最密堆积方式。
(2)CuSO4晶体类型为___________晶体。的空间构型为___________(填“正四面体”、“直线型”或“平面三角”)。
(3)如图所示,(代表Cu原子,代表O原子),一个Cu2O晶胞中Cu原子的数目为___________。
(4)鉴别晶体与非晶体最科学的实验方法为:___________。
【答案】 ④ 离子晶体 正四面体 4 X-射线衍射实验
【解析】(1)金属Cu晶体采取的是面心立方最密堆积;
(2) CuSO4中铜离子和硫酸根离子间是离子键,故为离子晶体。中S原子是sp3杂化,故为正四面体结构;
(3)黑球代表是Cu原子,数目是体内的4个;
(4) 鉴别晶体与非晶体最科学的实验方法为X-射线衍射实验。
17.(2022·全国·高二专题练习)金属的通性与其晶体结构有若密切的关系,根据铝晶体内部结构示意图,回答下列问题。
(1)图中“大球”指___________其结构示意图为___________,微粒间产生的强烈地相互作用称为___________键。
(2)因为铝晶体内部存在___________微粒,所以金属铝具有导电性。
(3)国产C919飞机外壳应用了铝合金材料。下列铝合金的性质与其用于飞机外壳无关的是___________
a.密度小 b.能导电 c.抗腐蚀性能强 d.硬度大
(4)、MgO和都可以制耐火材料,是因为它们都是___________。
a.不溶于水b.白色固体c.氧化物d.很高熔点物质
(5)是用量最大、应用最广的无机阻燃添加剂,结合化学方程式说明解释其能做阻燃剂的原因___________,在胶性溶液中的电离方程式是___________。
【答案】(1) Al3+ 金属键
(2)自由移动的电子
(3)b
(4)d
(5) 受热分解吸收大量的热,同时分解生成高熔点的氧化铝覆盖在可燃物表面,阻止与氧气接触
【解析】(1)
金属晶体是由金属阳离子和自由电子通过金属键结合形成的,其中金属阳离子的半径大于电子半径,则金属铝中铝离子半径大于电子,铝离子的结构示意图为:,故答案为:Al3+;;金属键;
(2)
金属之所以能导电是因存在自由移动的电子,故答案为:自由移动的电子;
(3)
铝合金能制成飞机外壳,是因为其密度较小,铝合金的硬度很大,且具有一定的抗腐蚀性,与其导电性无关,故答案为:b;
(4)
、MgO和都可以制耐火材料,主要是因为三种物质的熔点都很高,故答案为:d;
(5)
受热分解吸收大量的热,同时分解生成高熔点的氧化铝覆盖在可燃物表面,阻止与氧气接触,因此常用其作阻燃剂,不完全电离生成氯离子和氢氧化根离子,其电离方程式为:,故答案为:受热分解吸收大量的热,同时分解生成高熔点的氧化铝覆盖在可燃物表面,阻止与氧气接触;;
18.(2022秋·上海宝山·高二上海交大附中校考开学考试)现有几组物质的熔点(℃)数据:
A组
B组
C组
D组
金刚石:3550℃
Li:181℃
HF:-83℃
NaCl:801℃
硅晶体:1410℃
Na:98℃
HCl:-115℃
KCl:776℃
硼晶体:2300℃
K:64℃
HBr:-89℃
RbCl:718℃
二氧化硅:1723℃
Rb:39℃
HI:-51℃
CsCl:645℃
据此回答下列问题:
(1)A组属于_______晶体,其熔化时克服的微粒间的作用力是_______。
(2)B组晶体共同的物理性质是_______(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中自HCl至HI熔点依次升高,原因是_______。
(4)D组晶体可能具有的性质是_______(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______。
【答案】(1) 原子晶体 共价键
(2)①②③④
(3)含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常
(4)②④
(5)这些都属于离子晶体,熔点与晶格能有关,由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
【解析】(1)
A组熔点很高,为原子晶体,构成微粒是原子,原子晶体是由原子通过共价键形成的,熔化时克服的是共价键;
(2)
B组为金属晶体,根据金属晶体的特征可知,B组金属晶体具有①②③④四条共性;
(3)
HF的分子之间除存在范德华力外,分子之间还含有分子间氢键,增加了分子之间的吸引力,使物质熔化、气化需消耗更高的能量,因此其熔点反常;
(4)
D组属于离子晶体,离子晶体的构成微粒是阴、阳离子,离子之间通过离子键结合,离子键是一种比较强的相互作用,具有一定的硬度;一般能够溶于水,在水分子作用下电离产生自由移动的离子,因而能够导电;在固体时离子之间通过离子键结合,不能自由移动,因此固态时不能导电;在熔融状态时断裂离子键,产生自由移动的离子,因此在熔融状态下也可以导电,故②④两个性质符合;
(5)
D组属于离子晶体,其熔点与离子键键能有关。离子半径越小,离子之间作用力越强,离子键的键能越大,晶格能越大,物质的熔沸点就越高。由于离子半径:r(Na+)<r(K+)<r(Rb+)<r(Cs+),在离子所带电荷数相同的情况下,半径越小,晶格能越大,熔点就越高。
19.(2022春·天津静海·高二校考期中)(1)氯酸钾熔化,粒子间克服了_____的作用力;二氧化硅熔化,粒子间克服了_____的作用力;碘的升华,粒子间克服了_____的作用力。三种晶体的熔点由高到低的顺序是_____。
(2)下列六种晶体:①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,它们的熔点从低到高的顺序为_____ (填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,五种物质的熔点由高到低的顺序是_____。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500℃
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A_____;B_____;C_____;D_____。
A. B. C. D.
【答案】 离子键 共价键 分子间作用力 二氧化硅>氯酸钾>碘 ①<⑤<③<②<④<⑥ H2<CO2<HF<(NH4)2SO4<SiC 金属晶体 分子晶体 离子晶体 原子晶体 氯化铯 氯化钠 二氧化硅 金刚石
【分析】分析构成晶体的结构微粒及微粒间的作用力,确定晶体的所属类型,根据晶体的物理性质变化的一般规律并结合具体情况进行分析。
【解析】(1)氯酸钾属于离子化合物,其在熔化过程中粒子间克服了离子键;二氧化硅属于只含有共价键的原子晶体,其熔化时粒子间克服了共价键的作用力;碘属于分子晶体,其在升华时粒子间克服了分子间作用力。在通常情况下,原子晶体的熔点高于离子晶体、离子晶体高于分子晶体,故三种晶体的熔点由高到低的顺序是:二氧化硅>氯酸钾>碘。
(2)①CO2属于分子晶体,在常温下是气体;
②NaCl属于离子晶体,在常温下是固体;
③Na属于熔点较低的金属晶体,在常温下是固体;
④Si属于原子晶体,在常温下是固体;
⑤CS2属于分子晶体,在常温下是液体,且其相对分子质量大于CO2;
⑥金刚石属于原子晶体,在常温下是固体,碳原子的半径小于硅原子,故金刚石的熔点高于晶体硅。
在通常情况下,原子晶体的熔点高于离子晶体、离子晶体高于分子晶体。综上所述,它们的熔点从低到高的顺序为①<⑤<③<②<④<⑥。
(3)H2属于分子晶体,相对分子质量为2,在常温下是气体;(NH4)2SO4属于离子晶体,在常温下是固体;SiC属于原子晶体,在常温下是固体;CO2属于分子晶体,相对分子质量为44,在常温下是气体;HF属于分子晶体,其分子间可以形成氢键,在常温下是气体;在分子晶体中,相对分子质量较大,其熔点较高,存在分子间氢键的,其熔点较高。在通常情况下,原子晶体的熔点高于离子晶体、离子晶体高于分子晶体,因此,五种物质的熔点由高到低的顺序是H2<CO2<HF<(NH4)2SO4<SiC。
(4)A.固态时能导电,说明其中含有能够自由移动的电子,故A为金属晶体;
B. CS2属于非极性分子,根据相似相溶原理可知,能溶于CS2、不溶于水的晶体,其一定是由非极性分子组成的,故B属于分子晶体;
C.固态时不导电,液态时能导电,说明其熔化后可以产生自由移动的离子,故C为离子晶体;
D.固态、液态时均不导电,不可能是金属晶体或石墨;熔点为3500℃,其熔点很高,故D为原子晶体。
(5)如图中A~D是中学化学教科书上常见的几种晶体结构模型:
A. 该晶体中,两种粒子的配位数均为8,故其为氯化铯;
B. 该晶体中,两种粒子的配位数均为6,故其为氯化钠;
C. 该晶体中每个Si原子与相邻的4个O原子形成共价键,每个O原子与相邻的2个Si原子形成共价键,并且向空间发展形成空间立体网状结构,故其为二氧化硅;
D. 该晶体中每个原子与相邻的4个原子形成共价键,并且向空间发展形成空间立体网状结构,故其为金刚石。
20.(2022·新疆·高二竞赛)白钨矿晶体结构
白钨矿是钨的重要矿物。其晶胞参数为a=b=523.9pm,c=1137.8pm,α=β=γ=90°。晶体结构如图1所示,隐去氧离子后的晶胞如图2所示,请根据所学知识,回答下列问题。
(1)请给出白钨矿的化学式_____。
(2)已知晶胞中的各离子都只有一种化学环境,请给出各离子的配位数_____。
(3)请写出晶胞中所有钙离子与钨离子的原子坐标_____。
(4)请计算白钨矿的密度_____。
【答案】(1)CaWO4
(2)Ca2+离子的配位数为8,W6+离子的配位数为4,O2-离子的配位数为3
(3)Ca2+:(,,0),(0,,),(0,0,),(,0,);W6+:(0,0,0),(,0,),(,,),(0,,)
(4)6.127g/cm3
【解析】略
考点09糖类 蛋白质与核酸 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3): 这是一份考点09糖类 蛋白质与核酸 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3),文件包含考点09-糖类蛋白质与核酸高二化学下学期期末复习考点精练学案人教版2019选择性必修3解析版docx、考点09-糖类蛋白质与核酸高二化学下学期期末复习考点精练学案人教版2019选择性必修3原卷版docx等2份学案配套教学资源,其中学案共36页, 欢迎下载使用。
考点05 卤代烃 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3): 这是一份考点05 卤代烃 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3),文件包含考点05-卤代烃高二化学下学期期末复习考点精练学案人教版2019选择性必修3解析版docx、考点05-卤代烃高二化学下学期期末复习考点精练学案人教版2019选择性必修3原卷版docx等2份学案配套教学资源,其中学案共35页, 欢迎下载使用。
考点02 烷烃 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3): 这是一份考点02 烷烃 ——高二化学下学期期末复习考点精练学案(人教版2019选择性必修3),文件包含考点02烷烃高二化学下学期期末复习考点精练学案人教版2019选择性必修3解析版docx、考点02烷烃高二化学下学期期末复习考点精练学案人教版2019选择性必修3原卷版docx等2份学案配套教学资源,其中学案共30页, 欢迎下载使用。