
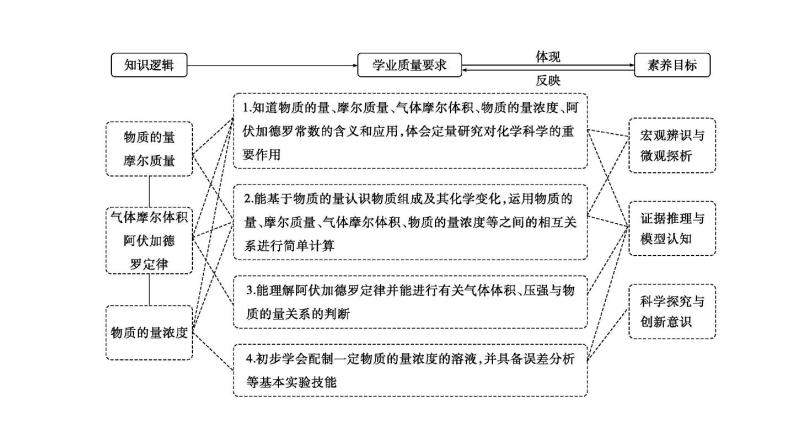





2024届高考化学一轮复习课件 第二章 物质的量 第1讲 物质的量
展开第二章 物质的量第1讲 物质的量
必备知识·整合
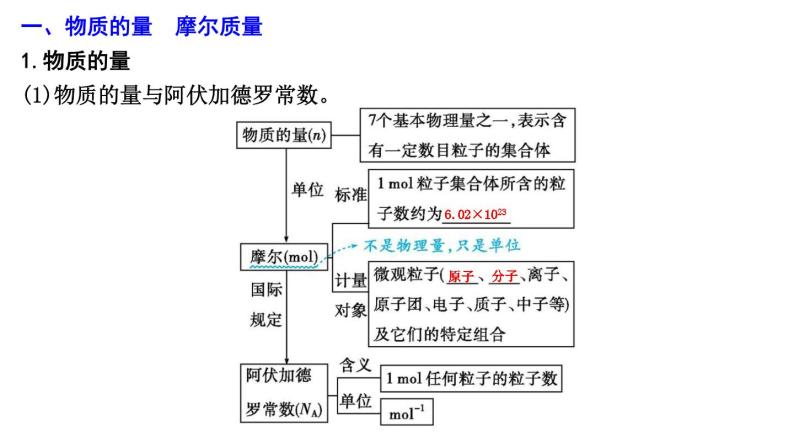
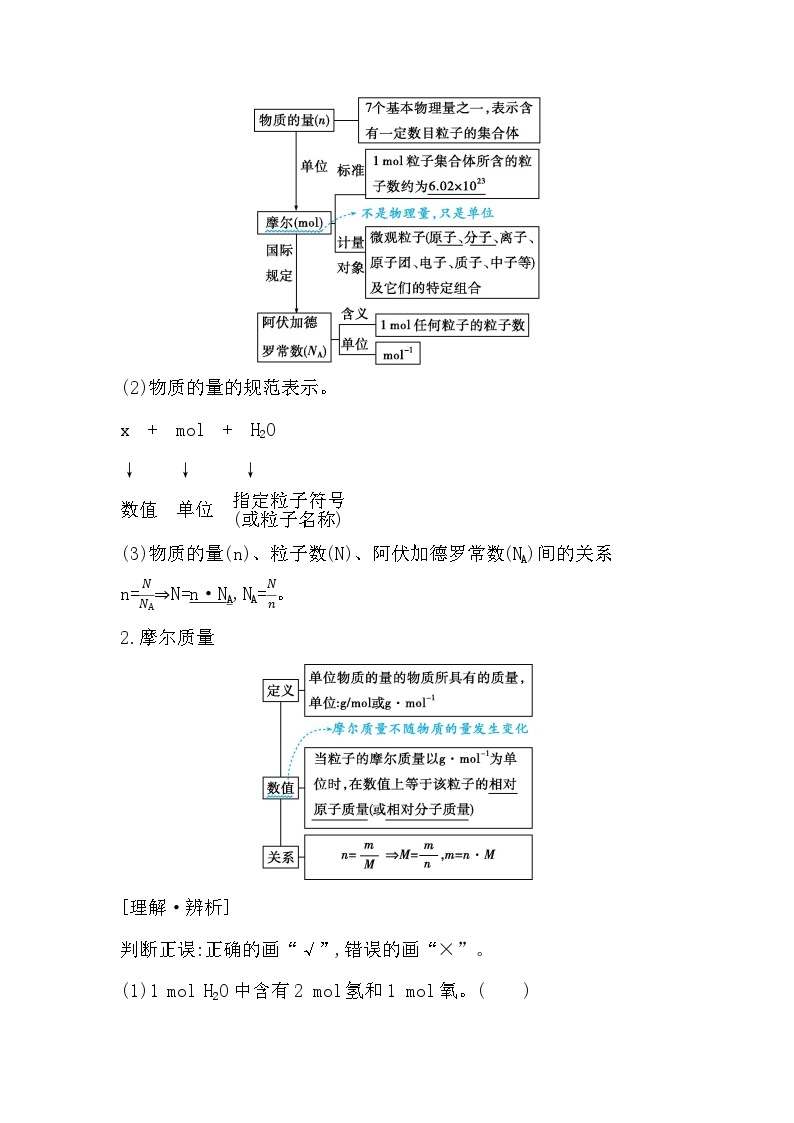
一、物质的量 摩尔质量1.物质的量(1)物质的量与阿伏加德罗常数。
6.02×1023
原子
分子
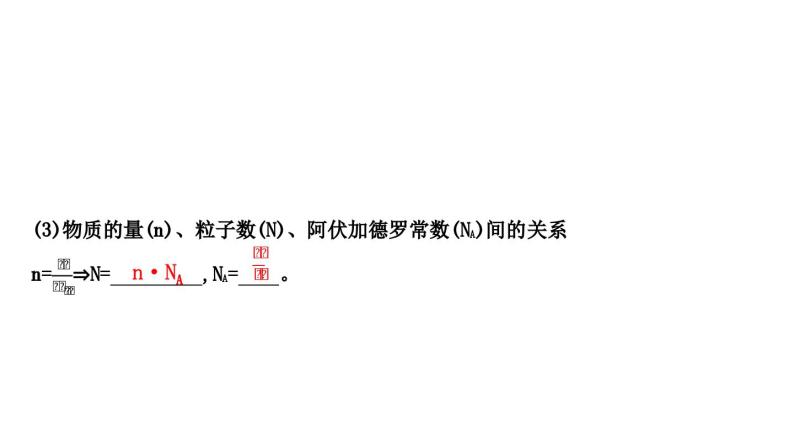
n·NA
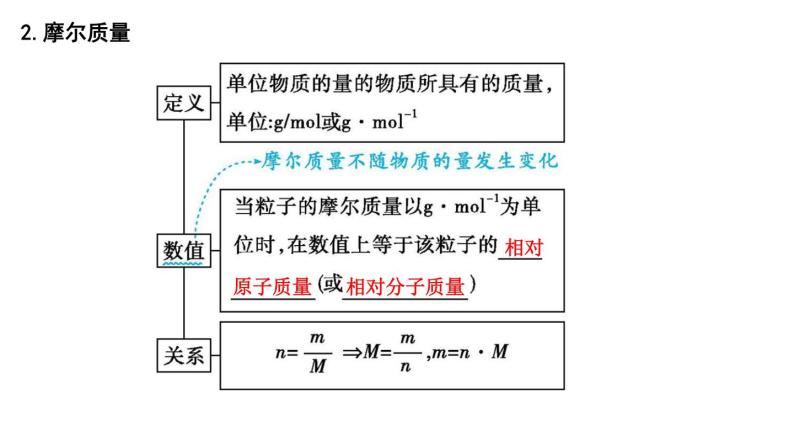
2.摩尔质量
相对
相对分子质量
原子质量
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)1 mol H2O中含有2 mol氢和1 mol氧。( )解析:(1)1 mol H2O中含有2 mol H和1 mol O。(2)12 g 12C中所含碳原子的数目约为6.02×1023。( )(3)2 mol CO2的摩尔质量是1 mol CO2的摩尔质量的2倍。( )解析:(3)CO2的摩尔质量为44 g·mol-1。
×
√
×
×
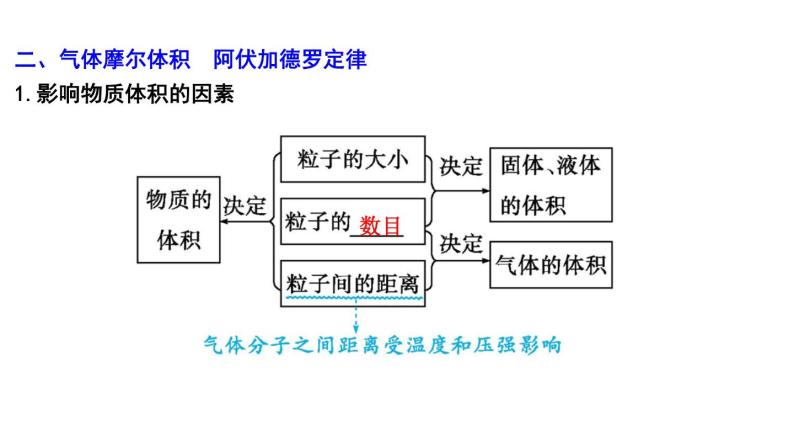
二、气体摩尔体积 阿伏加德罗定律1.影响物质体积的因素
数目
L·mol-1(或L/mol)
22.4L·mol-1
(2)阿伏加德罗定律的推论。
体积
相同
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)不同的气体,若体积不同,则它们所含的分子数一定不同。( )解析:(1)1 mol的气体在温度和压强不同时体积不同,但它们所含的分子数相同。(2)标准状况下,11.2 L O2和H2的混合气体所含原子数约为6.02×1023。( )(3)同温、同体积的条件下,等质量的SO2和O2的压强之比为2∶1。( )解析:(3)同温、同体积条件下,压强之比等于其物质的量之比,等质量的SO2和O2的压强之比为1∶2。(4)常温常压下,28 g N2和CO的混合气体的体积约为22.4 L。( )解析:(4)在常温常压下,气体摩尔体积不为22.4 L·mol-1。
×
√
×
×
三、物质的量浓度及计算1.物质的量浓度
单位体积
mol/L(或mol·L-1)
浓度
物质的量
2.溶质的质量分数
溶质
溶液
[理解·辨析] 判断正误:正确的画“√”,错误的画“×”。(1)1 L水中溶解5.85 g NaCl所形成的溶液的物质的量浓度为0.1 mol·L-1。( )解析:(1)1 L水中溶解5.85 g NaCl形成的溶液体积不为1 L。(2)将25 g CuSO4·5H2O晶体溶于75 g水中所得溶质的质量分数为25%。( )解析:(2)25 g CuSO4·5H2O晶体溶于75 g水中所得溶液的溶质是CuSO4,溶质的质量小于25 g,故质量分数小于25%。(3)从100 mL 5 mol·L-1H2SO4溶液中取出了 10 mL,所得硫酸的物质的量浓度为 0.5 mol·L-1。( )(4)50 mL 1 mol·L-1FeCl3溶液与150 mL 3 mol·L-1 NaCl溶液中c(Cl-)相等。( )
×
×
×
√
关键能力·提升
考点一 物质的量 摩尔质量
物质的量及相关计算
C
(1)C项参加反应的HNO3与被还原的HNO3,有什么区别?
(2)根据物质的质量,怎样计算该物质中某种粒子的数目?
1.“物质的量”是国际单位制中的一个基本物理量,下列有关说法正确的是( )A.2 g H2含有1 mol氢分子B.1 mol H2O由1 mol H2和1 mol O构成C.1 mol任何物质都约含有6.02×1023个分子D.质量相等的CO和CO2,物质的量之比为2∶3
A
解析:0.5 mol Na2SO4中含有的离子数为0.5×3NA=1.5NA,含氧原子的物质的量为0.5 mol×4=2 mol,质量为2 mol×16 g·mol-1=32 g。
2.在0.5 mol Na2SO4中含有的离子的个数和氧原子的质量分别是(NA代表阿伏加德罗常数的值)( )A.1.5NA 2 mol B.1.5NA 32 gC.3.01×1023 4 mol D.NA 64 g
B
3.材料科学家研究发现了首例带结晶水的晶体在 5 K下呈现超导性。据报道,该晶体的化学式为Na0.35CoO2·1.3 H2O。若用NA表示阿伏加德罗常数的值,试计算12.2 g该晶体中含氧原子数约为 ,氢原子的物质的量约为 mol。(已知Na0.35CoO2·1.3 H2O的摩尔质量为122 g·mol-1)
答案:0.33NA 0.26
摩尔质量及相关计算
D
(1)请列出该氯原子摩尔质量的两种表示方法。
(2)若该氯原子的质量为m g,其物质的量怎么用含a、b的代数式表示?
B
2.下列叙述正确的是( )A.24 g镁与27 g铝中,含有相同的质子数B.同等质量的氧气和臭氧中,电子数相同C.1 mol重水与1 mol水中,中子数之比为2∶1D.1 mol乙烷和1 mol乙烯中,化学键数目相同
解析:A项,Mg、Al均为1 mol,所含质子数分别为12NA和13NA,错误;B项,所含氧原子质量相同,则所含电子数相同,正确;C项,每个2H2O和H2O分子所含中子数分别为10和8,两者等物质的量时,所含中子数之比为10∶8=5∶4,错误;D项,1个 C2H6和1个C2H4中所含共价键数目分别为7和6,两者均为1 mol时,所含化学键数目不相同,错误。
B
[归纳拓展] 摩尔质量的“三性”
考点二 气体摩尔体积 阿伏加德罗定律
气体摩尔体积及其计算
1.CO和CO2是碳的两种重要氧化物,在标准状况下:(1)14 g CO的物质的量为 ,体积为 。
解析:(1)M(CO)=28 g·mol-1,则14 g CO的物质的量为0.5 mol,在标准状况下的体积为0.5 mol×22.4 L·mol-1=11.2 L。
答案:(1)0.5 mol 11.2 L
1.CO和CO2是碳的两种重要氧化物,在标准状况下:(2)4.4 g CO2所占的体积为 。
解析:(2)4.4 g CO2的物质的量为0.1 mol,在标准状况下的体积为0.1 mol×22.4 L·mol-1=2.24 L。
答案:(2)2.24 L
1.CO和CO2是碳的两种重要氧化物,在标准状况下:(3)相同质量的CO和CO2的体积之比为 。
答案:(3)11∶7
2.在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g)。按要求填空。(1)若所得混合气体对H2的相对密度为d,则混合气体的物质的量为 ,NH4HCO3的摩尔质量为 (用含m、d的代数式表示)。
2.在一定条件下,m g NH4HCO3完全分解生成NH3、CO2、H2O(g)。按要求填空。(2)若所得混合气体的密度折合成标准状况为ρ g·L-1,则混合气体的平均摩尔质量为 。
答案:(2)22.4ρ g·mol-1
(3)在该条件下,所得NH3、CO2、H2O(g)的体积分数分别为a%、b%、c%,则混合气体的平均相对分子质量为 。
答案:(3)17a%+44b%+18c%
[归纳拓展] 计算气体摩尔质量的常用方法
(3)根据标准状况下气体的密度ρ:M=ρ×22.4 (g· mol-1)。
(5)对于混合气体,求其平均摩尔质量,上述计算式仍然成立;还可以用下式计算:M=M1×a%+M2×b%+M3×c%……,a%、b%、c%指混合物中各成分的物质的量分数(或体积分数)。
阿伏加德罗定律及推论的应用
(2022·天津模拟)向三个密闭容器中分别充入Ne、H2、O2三种气体,下列有关这三种气体的叙述中正确的是( )A.温度、压强相同时,三种气体的密度关系:H2>Ne>O2B.质量、温度、压强均相同时,三种气体的体积关系:O2>Ne>H2C.温度、密度相同时,三种气体的压强关系:H2>Ne>O2D.温度、压强、体积均相同,三种气体的质量关系:H2>Ne>O2
C
(1)Ne、H2、O2三种气体的温度、压强和体积均相同,分子数和原子数之比是多少?提示:根据阿伏加德罗定律可知,T、P、V相同时,N相同,即分子数之比为1∶1∶1;由分子组成可确定原子数之比为1∶2∶2。(2)同温同压时,相同质量的Ne、H2、O2三种气体的物质的量之比是多少?
1.(2022·安徽池州一中月考)在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。根据甲、乙的摩尔质量(M)的关系判断,下列说法中正确的是( )A.若M(甲)
C
解析:若M(甲)
2.(2022·上海交大附中摸底)标准状况下,m g气体A与n g气体B所含分子数相同,下列说法不正确的是( )A.A与B相对分子质量之比为m∶nB.同质量的A与B所含分子数之比为n∶mC.标准状况下,同体积的A与B的质量之比为 m∶nD.标准状况下,A与B的密度之比为n∶m
解析:由m g气体A与n g气体B所含分子数相同,可知A与B的摩尔质量之比为m∶n,即相对分子质量之比为m∶n,A正确;同质量的A与B的物质的量之比为n∶m,即所含分子数之比为 n∶m,B正确;标准状况下,同体积的A与B的物质的量相同,则质量之比为m∶n,C正确;标准状况下,密度之比等于摩尔质量之比,即密度比为m∶n,D错误。
D
[思维建模] 应用阿伏加德罗定律解题的一般思路第一步,分析“条件”:分析题干中的条件,找出相同与不同。第二步,明确“要求”:分析题目要求,明确所要求的比例关系。第三步,利用“规律”:利用阿伏加德罗定律及其推论,根据条件和要求进行判断。
考点三 物质的量浓度
A
解答本题关键是结合题中信息厘清下列关系:
B
A
C
[归纳拓展] 物质的量浓度的相关计算方法(1)物质的量浓度的简单计算。
(2)溶液稀释、同种溶质的溶液混合的计算。①溶液稀释。a.溶质的质量在稀释前后保持不变,即m1w1=m2w2。b.溶质的物质的量在稀释前后保持不变,即c1V1=c2V2。②同种溶质的溶液混合:c1V1+c2V2=c混V混。
微专题4 常考常新的NA
阿伏加德罗常数的正误判断是全国各地历年高考的高频考点,通常以选择题形式呈现。命题时主要以阿伏加德罗常数为载体,结合气体摩尔体积、物质的组成结构、氧化还原反应及电离、水解等基本概念和理论,考查多种量间的相互转化及其计算等。试题设计的相关选项中有较多的知识隐藏,一不小心就易进入命题人设计的陷阱中而导致判断错误。现从五方面入手,突破命题人设计的陷阱,从“源头”上找到解题突破口。
1.重“两看”,排“干扰”,突破陷阱(1)看“气体”是否处于“标准状况”。常温常压(25 ℃,101 kPa)、室温(20 ℃)都不是标准状况。(2)看“标准状况”下物质是否为“气体”(如H2O、SO3、苯、CCl4、戊烷、HF等在标准状况下为非气态)。(3)物质的量、物质的质量、摩尔质量不受温度、压强等外界条件的影响。2.记“组成”,明“结构”,突破陷阱(1)熟记特殊物质中所含粒子(分子、原子、电子、质子、中子等)的数目,常考查的特殊粒子如Ne、D2O、18O2、O3、P4、H37Cl、—OH、OH-等。
(3)牢记有特定组成的物质,如最简式相同的物质,NO2和N2O4,乙烯和丙烯(C3H6)等;质量相同的乙烯和丙烯所含的原子数、电子数均相等;由同一种元素组成的不同单质,如O2、O3;相对分子质量相同的物质,如N2、CO、C2H4,Na2O2和Na2S等。(4)明确物质中所含化学键的数目,如1 mol硅中含Si—Si的数目为2NA,1 mol SiO2中含Si—O的数目为4NA,1 mol白磷(P4)中含有的P—P的数目为6NA,1 mol S8含8NA S—S,再如一个H2O2、CnH2n+2分子中化学键的数目分别为3、3n+1,苯环中不含碳碳双键等。3.析“反应”,抓“价态”,突破陷阱(1)同一种物质在不同反应中不同“角色”的判断。如Cl2和Fe、Cu等反应,Cl2只作氧化剂,而Cl2和NaOH反应,Cl2既作氧化剂,又作还原剂。Na2O2与CO2或H2O反应,Na2O2既作氧化剂,又作还原剂,而Na2O2与SO2反应,Na2O2只作氧化剂。
(2)量不同,所表现的化合价不同。如Fe和HNO3反应,Fe不足,生成Fe3+,Fe过量,生成Fe2+。(3)氧化剂或还原剂不同,所表现的化合价不同。如Cu和Cl2反应生成CuCl2,而Cu和S反应生成Cu2S。(4)注意氧化还原的顺序。如向FeI2溶液中通入Cl2,首先氧化I-,再氧化Fe2+。4.细“审题”,明“原理”,突破陷阱(1)是否指明了溶液的体积。(2)是否有弱电解质或可水解的盐,如1 L 0.1 mol·L-1的乙酸溶液和1 L 0.1 mol·L-1的乙酸钠溶液中含有CH3COO-的数目不相等且都小于0.1NA。(3)所给条件是否与电解质的组成有关,如pH=1的H2SO4溶液c(H+)=0.1 mol·L-1,与电解质的组成无关;而0.05 mol·L-1的Ba(OH)2溶液,c(OH-)=0.1 mol·L-1,与电解质的组成有关。
5.记“隐含”,析“变化”,突破陷阱
(4)隐含“钝化”。如常温下,铁、铝遇浓硫酸、浓硝酸发生“钝化”。
(2022·全国甲卷)NA为阿伏加德罗常数的值,下列说法正确的是( )A.25 ℃,101 kPa下,28 L氢气中质子的数目为2.5NAB.2.0 L 1.0 mol·L-1 AlCl3溶液中,Al3+的数目为2.0NAC.0.20 mol苯甲酸完全燃烧,生成CO2的数目为1.4NAD.电解熔融CuCl2,阴极增重6.4 g,外电路中通过电子的数目为0.10NA
C
(1)A项若将“25 ℃、101 kPa”改成“标准状况”,能否计算氢气中质子数目?
(2)B项溶液中,Cl-数目能否计算?提示:AlCl3溶液中虽然Al3+部分水解,但对Cl-无影响,溶液中含n(Cl-)=2.0 L×1.0 mol·L-1×3=6 mol,即含Cl-数目为6NA。
1.(2022·山东师大附中月考)NA表示阿伏加德罗常数的值,下列说法不正确的是( )A.2.4 g Mg与一定量的浓硫酸完全反应,转移的电子数一定为0.2NAB.78 g过氧化钠完全发生氧化还原反应时,转移的电子数一定为NAC.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数一定小于0.2NAD.Na2O2与二氧化碳反应生成标准状况下2.24 L O2转移的电子数为0.2NA
B
2.(2022·河北石家庄期末改编)每年10月23日上午6:02到晚上6:02被誉为“摩尔日”,这个时间的美式写法为6:02 10/23,外观与阿伏加德罗常数近似值6.02×1023相似。用NA表示阿伏加德罗常数的值,下列说法不正确的是( )A.标准状况下,4.48 L CO2所含有的分子数目为0.2NAB.常温常压下,48 g O2含有的氧原子数目为3NAC.4.6 g Na与足量氧气充分反应,转移电子的数目一定为0.2NAD.0.2 mol/L的CaCl2溶液中,含有Cl-的数目为0.4NA
D
3.(2022·湖南师大附中月考)NA代表阿伏加德罗常数的值,下列说法正确的是( )A.17 g —OH与17 g OH-所含电子数目均为10NAB.常温常压下,44 g N2O和CO2的混合气体含有的原子总数为3NAC.常温常压下,40 g SiC中所含C—Si数目为2NAD.1 mol丙烯和乙烷的混合物完全燃烧生成水分子数为6NA
解析:17 g —OH与17 g OH-均为1 mol,—OH所含电子数目为9NA,A错误;44 g N2O和CO2的混合物为1 mol,均为三原子分子,故混合气体含有原子总数为3NA,B正确;40 g SiC为1 mol,所含C—Si数目为4NA,C错误;乙烷和丙烯中均含6个H原子,故1 mol乙烷和丙烯中含6 mol氢原子,完全燃烧生成水分子数为3NA,D错误。
B
4.(2022·广东实验中学三模)若用NA表示阿伏加德罗常数的值,下列叙述错误的是( )A.142 g Na2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数目为3NAB.锌与某浓度的浓硫酸反应,生成SO2和H2的混合气体22.4 L(标准状况),锌失去电子数目为2NAC.标准状况下,22.4 L甲烷和乙烯混合物中含碳氢共价键数目为4NAD.0.1 mol/L的CH3COONH4溶液显中性,1 L该溶液中含CH3COO-数等于0.1NA
D
C
[思维建模] 解答阿伏加德罗常数类题目的思维步骤
学生必做实验(二) 配制一定物质的量浓度的溶液
1.主要仪器天平、药匙、量筒、玻璃棒、 、 、 。2.容量瓶的构造及使用(1)构造及用途。
烧杯
容量瓶
胶头滴管
250mL
500mL
(2)查漏操作。
(3)使用容量瓶的注意事项。①不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液;②不能将固体(或浓溶液)直接放在容量瓶中溶解(或稀释);③不能将过冷(或过热)的溶液转移到容量瓶中;④向容量瓶中注入液体时,一定要用玻璃棒引流,防止溶液洒落;⑤容量瓶不能用来长期贮存溶液。
倒立
180°
3.配制过程(以配制100 mL 1.00 mol·L-1NaCl溶液为例)(1)计算:需NaCl固体的质量为 g。(2)称量:根据计算结果,用 称量NaCl固体 g。(3)溶解:将称好的NaCl固体放入烧杯中,加入适量蒸馏水溶解,并用玻璃棒搅拌。(4)移液:待烧杯中的溶液 后,用玻璃棒引流将溶液注入 mL容量瓶中。(5)洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒 次,洗涤液 . ,轻轻摇动容量瓶,使溶液混合均匀。(6)定容:将蒸馏水注入容量瓶,当液面距瓶颈刻度线 时,改用 滴加蒸馏水,至 。(7)摇匀:盖好瓶塞,反复上下颠倒,摇匀。(8)装瓶、贴签。
5.85
天平
5.9
冷却至室温
100
2~3
全部注入容
量瓶
1~2 cm
胶头滴管
溶液的凹液面与刻度线相切
配制流程如图所示:
1.误差分析的思维流程
2.误差分析举例(1)从改变溶质物质的量角度分析误差(用“偏大”“偏小”或“无影响”填空)。①配制450 mL 0.1 mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8 g: 。 ②配制500 mL 0.1 mol·L-1的硫酸铜溶液,用天平称取胆矾8.0 g: 。 ③配制NaOH溶液,用天平称量NaOH时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确: 。 ④配制一定物质的量浓度的NaOH溶液,需称量溶质4.4 g,称量时物码放置颠倒: 。 ⑤配制一定物质的量浓度的稀硫酸,用量筒量取浓硫酸时,仰视读数: 。 ⑥定容时,加水超过刻度线,用胶头滴管吸取多余的液体至刻度线: 。 ⑦配制一定物质的量浓度溶液时,烧杯及玻璃棒未洗涤: 。
解析:(1)②所需胆矾质量为0.5 L×0.1 mol·L-1×250 g·mol-1=12.5 g。③NaOH易吸水潮解。④实际称量质量为4 g-0.4 g=3.6 g。
答案:(1)①偏小 ②偏小 ③偏小 ④偏小 ⑤偏大 ⑥偏小 ⑦偏小
2.误差分析举例(2)从改变溶液体积角度分析误差(用“偏大”“偏小”或“无影响”填空)。①配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容: 。 ②定容摇匀后,发现液面下降,继续加水至刻度线: 。 ③定容时仰视刻度线: 。 ④定容摇匀后少量溶液外流: 。 ⑤容量瓶中原有少量蒸馏水: 。
解析:(2)①NaOH溶于水放热,溶液的体积比室温时大,应恢复至室温后再移液、定容。
答案:(2)①偏大 ②偏小 ③偏小 ④无影响 ⑤无影响
[易错易混] 容量瓶读数引起的误差图示分析(1)仰视容量瓶刻度线[图(a)],导致溶液体积偏大,结果偏低。(2)俯视容量瓶刻度线[图(b)],导致溶液体积偏小,结果偏高。
1.(2022·全国乙卷,27节选)由CuSO4·5H2O配制CuSO4溶液,下列仪器中不需要的是 (填仪器名称)。
解析:由CuSO4·5H2O配制溶液,需用天平称量CuSO4·5H2O的质量,称量好放烧杯中,用量筒量取一定体积水溶解固体,实验中不用的仪器有分液漏斗和球形冷凝管。
答案:分液漏斗和球形冷凝管
2.(2022·广东卷节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用Hac表示)。(1)配制250 mL 0.1 mol·L-1的HAc溶液,需5 mol·L-1HAc溶液的体积为 mL。
解析:(1)溶液稀释过程中,溶质的物质的量不变,因此250 mL×0.1 mol·L-1=V×5 mol·L-1,解得 V=5.0 mL。
答案:(1)5.0
2.(2022·广东卷节选)食醋是烹饪美食的调味品,有效成分主要为醋酸(用HAc表示)。(2)下列关于250 mL容量瓶的操作,正确的是 (填字母)。
解析:(2)不能用手等触碰瓶口,以免污染试剂,应用瓶塞塞住容量瓶口,故A错误;定容时,视线应与刻度线相平,不能仰视或俯视,且胶头滴管尖嘴不能插入容量瓶内,故B错误;向容量瓶中转移液体,需用玻璃棒引流,玻璃棒下端位于刻度线以下,同时玻璃棒不能接触容量瓶口,故C正确;定容完成后,盖上瓶塞,将容量瓶来回颠倒,将溶液摇匀,颠倒过程中,左手食指抵住瓶塞,防止瓶塞脱落,右手扶住容量瓶底部,防止容量瓶从左手掉落,故D错误。
答案:(2)C
1.(2022·浙江诸暨适应性考试)用浓硫酸配制 950 mL 2.50 mol·L-1稀硫酸,包括计算、量取、稀释、转移、定容等多个步骤,下列说法不适当的是( )A.图1仪器的规格应选择1 000 mLB.图2稀释过程中应将浓硫酸加入水中C.图3洗涤后需将洗涤液转入容量瓶D.按图4操作加水至溶液凹液面与刻度线相平
解析:实验室没有950 mL规格的容量瓶,所以选择1 000 mL的容量瓶,故A正确;浓硫酸稀释过程会释放大量的热,所以应将浓硫酸缓慢加入水中,并不断搅拌,故B正确;洗涤后的洗涤液中含有溶质,所以需将洗涤液转入容量瓶,故C正确;定容时当液面距刻度线1~2 cm时,改用胶头滴管继续滴加蒸馏水至凹液面与刻度线相平,故D错误。
D
2.(2022·江西南昌八一中学期末)Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题。(1)配制过程中不需要使用的化学仪器有 (填字母)。 A.烧杯 B.500 mL容量瓶C.漏斗 D.胶头滴管E.玻璃棒
答案:Ⅰ.(1)C
解析:Ⅰ.(1)溶液配制过程中需要烧杯溶解固体,需要500 mL容量瓶和胶头滴管定容,需要玻璃棒搅拌和引流,没有用到的是漏斗,应选择C。
(2)用天平称取氢氧化钠,其质量为 g。
答案:(2)4.0
解析:(2)用天平称取m(NaOH)=c×V×M=0.2 mol/L×0.5 L×40 g/mol=4.0 g。
2.(2022·江西南昌八一中学期末)Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题。(3)下列主要操作步骤的正确顺序是 (填序号)。 ①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;②加水至液面离容量瓶瓶颈刻度线1~2 cm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;③待冷却至室温后,将溶液转移到500 mL容量瓶中;④盖好瓶塞,反复上下颠倒,摇匀;⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
答案:(3)①③⑤②④
解析:(3)实验操作的步骤为计算、称量、溶解、移液、洗涤移液、定容、摇匀,所以其排列顺序为①③⑤②④。
2.(2022·江西南昌八一中学期末)Ⅰ.实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题。(4)如果实验过程中缺少步骤⑤,会使配制出的NaOH溶液浓度 (填“偏高”“偏低”或“不变”)。
答案:(4)偏低
解析:(4)因洗涤液中含有溶质,未将洗涤液转入容量瓶,溶质的质量减少,浓度偏低。
Ⅱ.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。
答案:Ⅱ.(5)11.9
盐酸分子式:HCl相对分子质量:36.5密度:1.19 g/cm3HCl的质量分数:36.5%
(5)该浓盐酸中HCl的物质的量浓度为 mol/L。
Ⅱ.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。
盐酸分子式:HCl相对分子质量:36.5密度:1.19 g/cm3HCl的质量分数:36.5%
(6)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是 (填字母)。 A.溶液中HCl的物质的量 B.溶液的浓度C.溶液中Cl-的数目
D.溶液的密度
答案:(6)BD
解析:(6)n=cV,即与溶液体积有关,A错误;溶液的浓度是均一的,与所取溶液的体积无关,B正确;N=nNA=cVNA,与溶液体积有关,C错误;溶液的密度是均一的,与所取溶液的体积无关,D正确。
Ⅱ.如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题。
盐酸分子式:HCl相对分子质量:36.5密度:1.19 g/cm3HCl的质量分数:36.5%
(7)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取 mL上述浓盐酸进行配制。
答案:(7)16.8
解析:(7)稀释前后溶质的量不变,即V(浓盐酸)×11.9 mol/L=0.400 mol/L×0.5 L,解得V(浓盐酸)≈0.016 8 L=16.8 mL。
答题规范(2) 容量瓶查漏操作
(2022·浙江浦江月考)下列关于容量瓶及其使用方法的叙述,正确的是( )①是配制一定物质的量浓度的溶液的专用仪器②使用前要先检查容量瓶是否漏液③容量瓶可以用来加热④不能用容量瓶贮存配制好的溶液⑤一定要用500 mL容量瓶配制250 mL溶液A.①③ B.①②④C.①②④⑤ D.①②③④
B
解析:容量瓶是配制一定物质的量浓度的溶液的专用仪器,由于有瓶塞,在使用前要先检查容量瓶是否漏液,但由于属于精密玻璃仪器,不能用来加热,不能贮存配制好的溶液,配制时,要选择相应规格的容量瓶,故③⑤不正确。综上分析B正确。
哪些实验仪器在使用前需检查是否漏液?提示:容量瓶、分液漏斗、酸式(或碱式)滴定管。
[答题规范] 容量瓶查漏操作(1)规范操作:向容量瓶中加适量水,塞紧瓶塞,手指顶住瓶塞,倒立,用吸水纸检查是否有水珠渗出;如果不漏,将容量瓶正立,把塞子旋转180°,塞紧,再倒立,用同样方法检查。(2)答题关键:①装水;②倒立;③检查是否漏水;④旋转180°;⑤重复操作。
高考真题·导向
1.(2022·辽宁卷)设NA为阿伏加德罗常数的值,下列说法正确的是( )A.1.8 g 18O中含有的中子数为NAB.28 g C2H4分子中含有的σ键数目为4NAC.标准状况下,22.4 L HCl气体中H+数目为NAD.pH=12的Na2CO3溶液中OH-数目为0.01NA
A
D
C
D
点击进入 课后作业·集训
2024版新教材高考化学全程一轮总复习第二章物质的量第6讲物质的量浓度课件: 这是一份2024版新教材高考化学全程一轮总复习第二章物质的量第6讲物质的量浓度课件,共52页。PPT课件主要包含了单位体积,物质的量,答案C,95×10-3%,容量瓶,胶头滴管,刻度线,000mL,2查漏操作,冷却至室温等内容,欢迎下载使用。
高考化学一轮复习第1章物质的量第2讲物质的量在化学实验中的应用课件: 这是一份高考化学一轮复习第1章物质的量第2讲物质的量在化学实验中的应用课件,共60页。PPT课件主要包含了mol·L-1,molL,m1w1=m2w2,c1V1=c2V2,容量瓶,胶头滴管,刻度线,托盘天平,冷却至室温,全部注入容量瓶等内容,欢迎下载使用。
高考化学一轮复习第1章物质的量第1讲物质的量气体摩尔体积课件: 这是一份高考化学一轮复习第1章物质的量第1讲物质的量气体摩尔体积课件,共60页。PPT课件主要包含了mol,gmol,g·mol-1,L·mol-1等内容,欢迎下载使用。












